Направление органического синтеза хелатообразующих производных азотсодержащих гетероциклов особенно актуально на сегодняшний день ввиду широкого применения этих соединений в различных областях химии, физики и химической технологии. Многие методы экстракционного разделения ионов d- металлов, различных видов химического анализа ионов редких и рассеянных элементов, а также получения устойчивых молекулярных магнетиков основаны на хелатировании ионов металлов в растворах. В частности, диантипирилметан и его гомологи нашли широкое применение в аналитической химии ионов кадмия, висмута, таллия, осмия, титана, кобальта (II), железа (III), меди (I), цинка, сурьмы, индия, галлия, германия и многих других элементов [2].
Целью настоящей работы явилось получение гомолога ряда ароматических производных диантипирилметана на основе антипирина, этиленгликоля и бензальдегида.
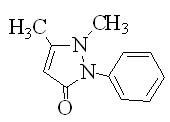
Антипирин или феназон (рисунок 1) относится к производным пиразолона, впервые полученным синтетическим способом Людвигом Кнорром в 1883 году [1]. Став одним из первых синтетических анальгетиков, антипирин в настоящее время широкого применения в медицинской практике не имеет. По химической природе функциональных групп антипирин относится к ряду слабых однокислотых оснований (рКа 1,5), способных благодаря ароматической природе пиразолонового кольца выступать в качестве субстрата в реакциях конденсации, протекающих по типу электрофильного замещения в ароматическое кольцо. При взаимодействии с альдегидами антипирин конденсируется с образованием диантипирилметанов; с кетонами, содержащими электронодонорные заместители, дает антипириновые красители типа хромпиразолов; сочетается с диазосоединениями с образованием азокрасителей [3].
 |
|
Рисунок 1 − Структурная формула антипирина |
Синтез ароматического производного диантипирилметана осуществляли с применением этиленгликоля, антипирина и бензальдегида в качестве исходных реагентов, а также хлороводородной кислоты, серной кислоты, аммиака и раствора едкого натра. В качестве базовых были выбраны методики окисления этилового спирта хромовой смесью [4], а также синтеза диантипирилметана и фенилдиантипирилметана из антипирина с применением формальдегида и бензальдегида соответственно [2].
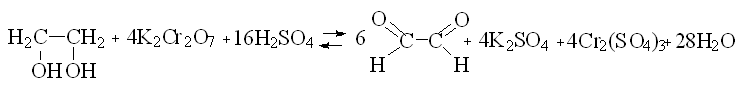
Синтез производного осуществляли путем последовательного взаимодействия антипирина с продуктом окисления гликолевого спирта в среде серной кислоты и далее с бензальдегидом. Количество диантипирилметана рассчитывалось исходя из предположения полного окисления этиленгликоля до глиоксаля. Мольное соотношение реагентов составляло (глиоксаль:антипирин:бензальдегид) 1:2:1.
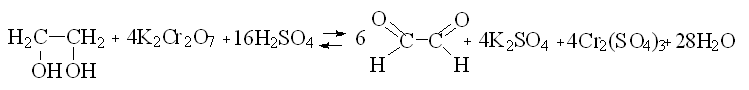
Окисление гликолевого спирта осуществляли по методике [4] с помощью установки, представленной на рисунке 2. Согласно методике, для лучшего выделения альдегида из реакционной смеси необходимо пропускание через раствор углекислого газа, который получали в аппарате Киппа. В круглодонную колбу вливали спирт (этиленгликоль) и смесь из 10 мл концентрированной серной кислоты и 20 мл воды. Содержимое колбы нагревали до кипения. Затем готовили смесь из 85 мл воды и 25 мл концентрированной серной кислоты, растворяли в этой смеси двухромовокислый натрий и еще теплый раствор вливали в капельную воронку, следя за тем, чтобы вся трубка воронки была наполнена жидкостью. Постепенно приливают хромовую смесь к кипящему спирту, одновременно пропуская через жидкость струю углекислого газа (с такой скоростью, чтобы можно было считать проходящие пузырьки газа). Так как реакция экзотермична, смесь продолжает кипеть без подогревания извне. После окончания добавления хромовой смеси еще около 10 минут продолжали пропускать углекислый газ, поддерживая слабое кипение реакционной смеси, чтобы полностью удалить альдегид из колбы.
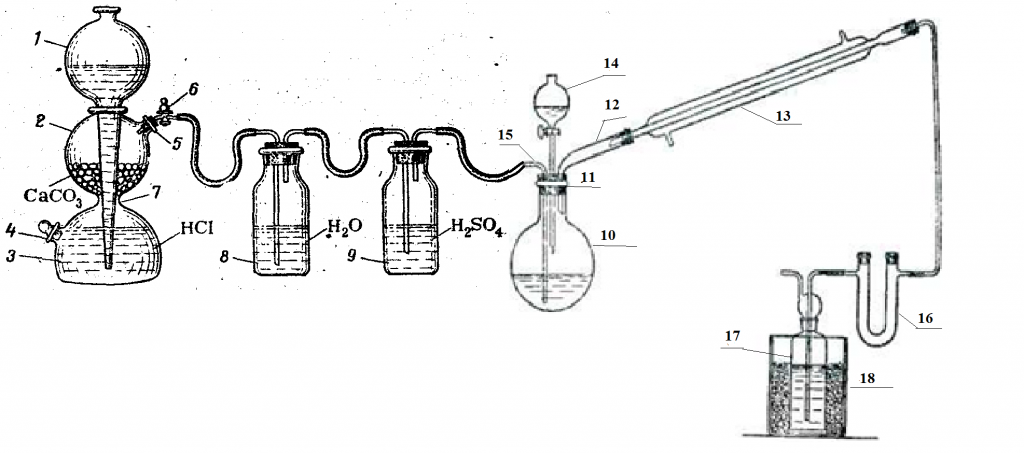
1) шарообразная воронка; 2, 3) соединенные между собой резервуары; 4, 5) тубусы; 6) кран; 7) перетяжка; 8, 9) промывные склянки; 10) круглодонная колба (приемник СО2); 11) резиновая пробка с тремя отверстиями; 12) изогнутая насадка; 13) обратный холодильник; 14) капельная воронка; 15) трубка для пропускания углекислого газа; 16) U-образная трубка (наполненная прокаленным хлористым кальцием); 17) колба-приемник; 18) стакан со льдом.
Рисунок 2 – Установка для окисления этиленгликоля хромовой смесью
|
1) |
 |
|
2) |
 |
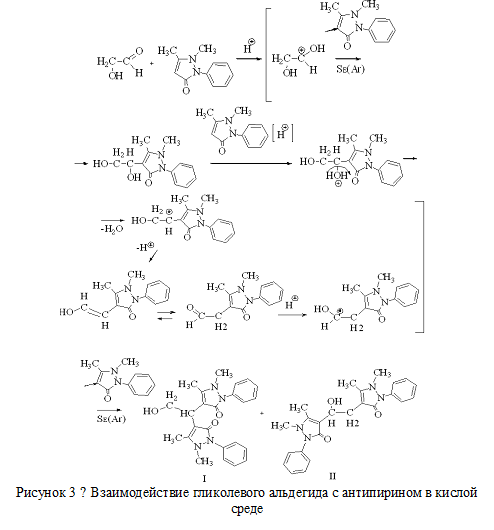
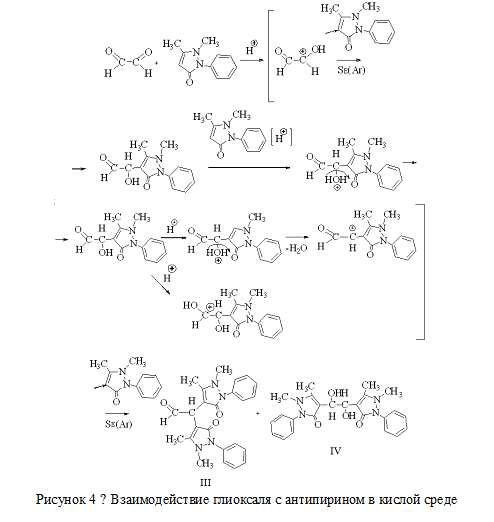
Полученное альдопроизводное этиленгликоля смешивали с раствором антипирина в серной кислоте. Раствор готовили путем растворения при нагревании 10 г антипирина в 25 мл серной кислоты (3:2). Смесь нагревали при постоянном перемешивании при 80-90 ˚С в течение 2-3 часов. Смесь приобрела желтую окраску. В целях выделения продуктов полной конденсации антипирина и глиоксаля/гликолевого альдегида к раствору добавляли аммиак до нейтральной реакции среды. Поскольку осадка не образовалось, был сделан вывод о том, что конденсация прошла не полностью, т.е. в составе продуктов есть спиртовые или кислотные группы, образующие водорастворимые соли с катионом аммония. Схемы наиболее вероятно протекающих процессов данной стадии синтеза приведены на рисунках 3, 4. Возможные продукты конденсации обозначены цифрами I, II, III, IV.
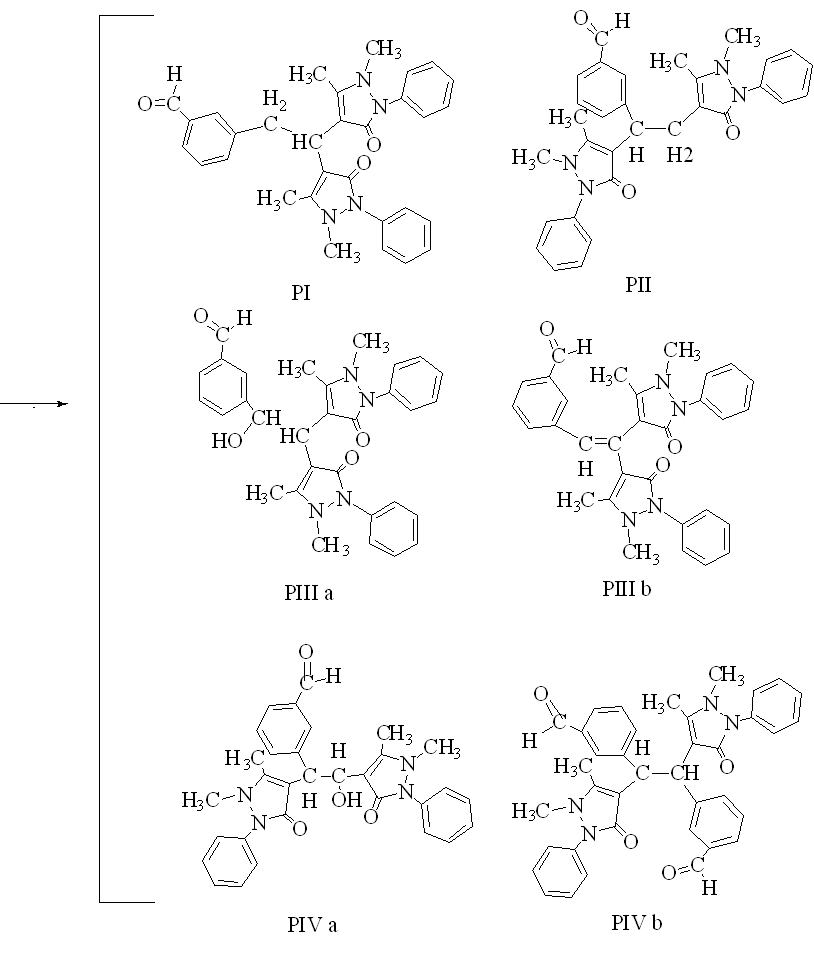
Далее к смеси полученных продуктов первой стадии конденсации добавляли расчетное количество концентрированной хлороводородной кислоты до создания кислотности среды 3,3 моль/л и далее вводили 2,5 мл свежеперегнанного бензальдегида. По мере на водяной бане смеси происходило образование аморфного осадка белого цвета. Осадок с маточным раствором выдерживали на бане в течение 2 часов, затем отфильтровывали на воронке Бюхнера и отмывали от примесного остатка реагентов. Для этого вещество переносили в стакан, приливали 200 мл воды и нагревали на водяной бане в течение 1 часа. Полученный продукт представляет собой хлоридную соль производного пиразолония. Для перевода солевой формы производного диантипирилметана в основание добавляли раствор гидроксида натрия. Продукт синтеза отфильтровывали через воронку Бюхнера, промывали водой и высушивали в эксикаторе над серной кислотой. Схема образования продуктов второй стадии конденсации приведена на рисунке 5.
|
Рисунок 3 − Взаимодействие гликолевого альдегида с антипирином в кислой среде |
 |
|
Рисунок 4 − Взаимодействие глиоксаля с антипирином в кислой среди |
 |
|
Рисунок 5 – Схема конденсации возможных продуктов первой стадии синтеза с бензальдегидом |
Продукт синтеза нерастворим в воде и спирте, плохо растворим в пертролейном эфире и четыреххлористом углероде, хорошо растворим в ацетоне. Таким образом, синтезированное нами вещество представляет собой полярное соединение, не содержащее гидрофильных групп.
Определение состава продукта синтеза осуществляли на основании температуры плавления и данных ИК-спектроскопии. Область температур плавления вещества, определенная с помощью прибора Жукова, составила от 135 до 137 ˚C. Поскольку интервал температур плавления получился достаточно узким, то можно заключить, что в результате синтеза образовалось одно вещество. Согласно литературным данным, ни одно из известных производных диантипирилметана не обладает такой температурой плавления (наиболее близко − гексилдиантипирилметан (110-111 ˚C), бутилдиантипирилметан (150 ˚C), изопропилдиантипирилметан (153 ˚C) [2]). Таким образом, мы получили новое, еще неизвестное вещество.
Дальнейшее определение структуры полученного вещества проводили по данным ИК-спектроскопии. Спектры записывали в суспензии вещества в вазелиновом масле на приборе SpLUM v1.02.117ws.
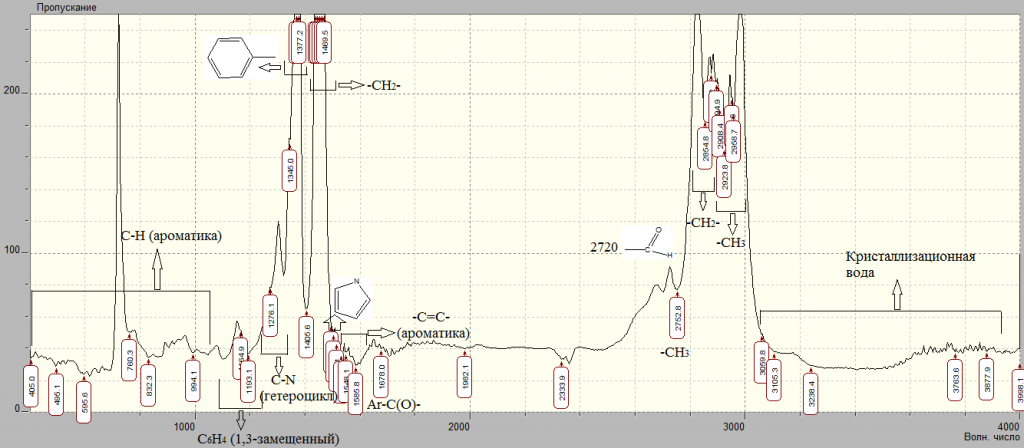
Рисунок 6 – ИК-спектр продукта реакции в интервале частот от 4000 до 500 см-1
Таблица 1 – Полосы поглощения по ИК-спектру
| Полосы поглощения | Функциональные группы | |
| 3290; 3105; 3059 | Кристаллизационная вода | |
| 2951; 2752 | СH3 | |
| 2923; 2854; 1469; 1462; 1453; 1446; 1438 | -CH2— | |
| 2720 | Альдо-группа | |
| 1678 | Ar-C(O)- | |
| 2894; 1345 | -CH | |
| 1585; 1514 | -C=C- (ароматическое кольцо) | |
| 1495 | Гетероцикл с N | |
| 1377; 1369 | Фенольная группа | |
| 1276 | C-N (в ароматике) | |
| 1102; 832; 760 | C-H (в ароматике) | |
| 1164; 1193 | C6H4 (1,3-замещенный) | |
Анализ приведенных на рисунке 6 ИК-спектров вещества показал, что в составе соединения однозначно присутствует альдогруппа, связанная с ароматическим кольцом (2720), 1,3-дизамещенное ароматическое кольцо (1164; 1193), азотсодержащий гетероцикл (1276; 1495), фенольная группа (1377; 1369), метиленовая группа (2923; 2854; 1469; 1462; 1453; 1446; 1438), метильная группа (2951; 2752), а также кристаллизационная вода (3290; 3105; 3059). В веществе однозначно нет карбоксильных и спиртовых групп.
Таким образом, на основании выше описанных процессов, принимая во внимание природу функциональных групп и углеводородных фрагментов, можно предполагать наиболее вероятными структуры PII и PIII. В целях уточнения структуры необходимо записать масс- и ЯМР 1Н спектры.
Список литературы
- Дегтев, М.И. Физико-химические свойства антипирина / М.И. Дегтев. — Пермь, 2009. — 174 с.
- Диантипирилметан и его гомологи / Сб. ст. Ученые записки № 324. − Пермь, 1974. — 244 с.
- Крыльский, Д.В. Гетероциклические лекарственные вещества / Д.В. Крыльский. — Воронеж, 2007. —234 с.
- Леонард, Н.Д. Синтез органических препаратов / Н.Д. Леонард. — Москва, 1958. — 89 с.
- Тарасевич, Б.Н. ИК спектры основных классов органических соединений / Б.Н. Тарасевич. — Москва, 2012. — 52 с.[schema type=»book» name=»Синтез производного диантипирилметана» description=»В статье описывается методика синтеза нового производного диантипирилметана. Предложена структура продукта синтеза на основании данных ИК-спектроскопии, а также схем наиболее вероятно протекающих реакций превращения антипирина при участии глиоксаля, гликолевого альдегида и бензальдегида. » author=»Строганова Елена Алексеевна, Улядарова Виктория Евгеньевна, Журавлева Дарья Вячеславовна» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-03-04″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_27.06.2015_06(15)» ebook=»yes» ]