Благодаря специфическим свойствам, обусловленным наличием пяти-членного гетероцикла с вицинальными диоксогруппами, циклические ацетали 1,3-диоксоланового ряда и их производные привлекают пристальное внимание исследователей. Они находят применение в качестве пластификаторов поли-мерных материалов [4, 5, 12-14], мономеров для получения полимеров, обла-дающих комплексом полезных свойств [7, 9, 23], растворителей эфиров целлю-лозы [15], селективного гербицида для зерновых культур [2, 18, 19] и заслу-живают внимание как перспективные соединения в фармакологии [1, 6, 24] с одной стороны, и как удобной объект для решения различных проблем теоре-тической органической химии – с другой [10, 22].
В настоящей работе приведены сведения по синтезу производных 1,3-ди-оксолана из 3-циклогексен-1-карбальдегида (3-ЦГ-1-КА), 5-норборнен-2-эндо-карбальдегида (5-Н-2-Э-КА) и бензальдегида (БА) действием 1,2-пропандиола и его 3-хлорпроизводным в присутствии катионообменной смолы КУ-2 (Н+-форма) по схеме:
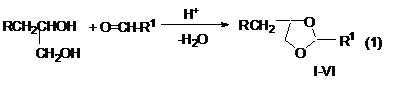
R=H или Cl: R1=3-циклогексен-1-ил- (І, ІV); 5-норборнен-2-ил- (ІІ, V); фенил (ІІІ,VІ).
Зависимость выхода целевого продукта от соотношения реагирующих компонентов, температуры, количества катализатора и времени контроли-ровали методом ГЖХ (хромотограммы соединений І–VІ снимали на приборе Chrom-4 с детектором по теплопроводности). Колонка из нержавеющей стали (3600×4мм), заполненная Chromton M-AW-DMCS с нанесенным на него 5%-ного ХЕ-60. Температура колонки 160-1800С, скорость газоносителя гелий 30 мл/мин, ток детектора 80 Ма. Для количественного расчета превращения исходных компонентов в целевой продукт применяли метод внутреннего стандарта [16]. Внутренним стандартом служил диметил- или диэтилфталат. Содержание целевого продукта, а при необходимости и расхода исходных компонентов в реакционной смеси, рассчитывали по площадям хроматог-рафических пиков с введением поправочных коэффициентов, полученных при анализе искусственных смесей методом ГЖХ [8]. В хроматограммах, на при-мере синтеза соединения (ІV) компоненты реакционной смеси располагаются согласно времени их удерживания в следующей последовательности: толуол (растворитель), 3-хлор-1,2-пропандиол (3-Сl-1,2-ПД), 3-ЦГ-1-КА, диэтилфта-лат (стандарт) и 2-(3-циклогексенил)-4-хлорметил-1,3-диоксолан (ІV).
Анализ хроматограмм (ГЖХ) соединений (І–VІ) указывает на наличие в них двух изомеров, которые четко разделяются в виде двух пиков с соот-ношением в пределах 55:45 %. Поскольку заместители в молекулах 2,4-ди-замещенных 1,3-диоксоланов (І–VІ) могут располагаться по одну или разные стороны относительно плоскости пятичленнего гетероцикла с вицинальными диоксагруппами, они, как и следовало ожидать, являются смесью цис- и транс- изомеров [11]. Причем изомер с меньшим временном удерживания, который мы относим к транс-конфигурации, во всех случаях преобладает, что хорошо согласуется с литературными данными [3, 22].
Далее, при изучении влияния природы заместителя карбонильного компо-нента на его относительную реакционную способность установлено, что на-чальные скорости (W0∙104) реакции образования диоксоланов (І, ІV) из 3-ЦГ-1-КА составляют 2.75±0.22 и 5.60±0.48 моль/(л.с.) соответственно и существенно превосходят те же показатели реакции образования диоксоланов (ІІ,V) из 5-Н-2-Э-КА 1.75±0.16 и 2.40±0.32 моль/(л. с.) и диоксоланов (ІІІ,VІ) из БА 1.80±0.26 и 2.46±0.19 моль/(л. с.). Относительно высокое значение скорости ре-акции образования соединения (ІV) объясняется, по-видимому, тем, что эквато-риальная ориентация альдегидной группы в молекуле 3-ЦГ-1-КА [22] обус-лавливает ее доступность для нуклеофильной атаки, по сравнению с той же группой, занимающей фиксированное эндо-положение в молекуле 5-Н-2-Э-КА [17]. В случае последнего, альдегидная группа испытывает не только эффектив-ное экранирование карбоцикла с норборненовым каркасом, но на ее реакции-онную способность, определенное влияние накладывает, по-видимому и элек-тронный фактор. Поскольку из двух возможных положений схема 2, в которых альдегидная группа может находиться вследствие свободного вращения, затор-моженное (А) предпочтительнее, что затрудняет ее доступность нуклеофилом и скорость реакции подавляется.

Фенильная группа также способствует снижению электрофильной актив-ности карбонильного углеродного атома в молекуле БА (по сравнению с той же группой в молекуле 3-ЦГ-1-КА) – как электронодонорный (в данном случае) заместитель [21].
Установлено, что окисление синтезированных соединений (І, ІІ, ІV и V) 50%-ной перуксусной кислотой (ПУК) в среде хлороформа приводит к образованию соответствующих цис-2-(1,2-эпокси-3-циклогексил)- и цис-2-(5,6-эпоксинорборнан-2-ил)-4-R-1,3-диоксоланов (VІІ–X) с высокими выходами, а бромирование соединений (І, ІV) к соответствующим бромпроизводным (XІ, XII). На примере соединений (І, ІV) показано, что производные 1,3-диоксолана с циклогексенильным фрагментом обладают диенофильной активностью и могут быть использованы в реакции Дильса-Альдера в качестве диенофила. Указанные характерные реакции осуществлены по схеме:
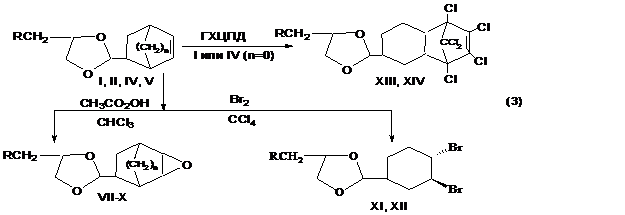
VII-X. n=0: R=H(VII), Cl(VIII). n=1: R=H (IX), Cl(X). XI, XII. R=H(XI), Cl(XII). XIII, XIV. R=H(XIII), Cl(XIV).
Состав синтезированных соединений (І-VI) и продуктов их превращений (VII-XIV) подтвержден элементным анализом, строение доказано определением MRD, данными ИК и ЯМР 1Н спектров. Спектр ПМР соединения (ІV) (CCl4. δ. м. д.):1.50-2.50 м (7Н, СН2СН2СН2СН2), 3.15-4.25 м (5Н, СН2О, СНО, СН2Сl ), 4.64-д(1Н, ОСНО-транс), 4.76 д (1Н, ОСНО-цис), 5.60 с (2Н, -СН=СН-).
Синтезированные соединения (І-VI) и продукты их превращения (VII-XIV) являются прозрачными жидкостями почти без запаха. В воде не растворимы, хорошо растворяются в органических растворителях (ацетон, эфир, бензол и т.д.).
В силу того, что проблема создания композиционных материалов, облада-ющих высокими эксплуатационными свойствами, на базе промышленных эпоксидных смол актуальна и по мере роста технического прогресса приоб-ретает все большую значимость, некоторые представители синтезированных соединений, в частности диоксоланы с норборненовым каркасом (XІІІ, XІV) были испытаны (в лабораторных условиях) в качестве активного разбавителя композиции на базе эпоксидиановой смолы ЭД-20, отверждаемой полиэтилен-полиамином (ПЭПА). Процесс модификации проводили следующим образом: в нагретую до 800С смолу ЭД-20 вводили (при интенсивном перемешивании) одно из приведенных соединений в пределах 10-30 масс.ч. Композицию тща-тельно перемешивали и заливали в формы для отверждения. После отверж-дения образцов в течение 24 ч. при комнатной температуре их подвергли термообработке при 800/2 ч и 1200/2 ч, после чего определяли соответствующие физико-механические свойства полученных материалов. Электрическая проч-ность образцов измерялась с использованием электродов шар-плоскость при толщине образца 0.4 мм. Результаты испытаний приведены в таблице. Для сравнения указаны и соответствующие показатели композиции ЭД-20 отвержденной ПЭПА без модификатора.
Таблица.
Свойства модифицированных эпоксидиановых композиций
отвержденных ПЕПА (20 масс.ч)
|
Модификаторы |
Содерж. моди-
фикатора, масс.ч.
|
Предел прочнос-
ти при растяжении, МПа
|
Относ. удл. при разрыве, % | Теплостойкость по Вика, 0С. | Электрическая прочность, кВ/мм | Тангенс угла диэлектрических потерь при 50Гц | Диэлектрическая проницаемость при 50 Гц |
Самозатухае- мость,сек |
Потери веса при
горении, %. |
|
XIII |
10
20 30 |
68,8
78.0 76.2 |
12
20 17 |
130
170 110 |
31.9
44.8 42.5 |
0.0046
0.0011 0.0072 |
―
4.8 ― |
Горит
3.2 3.0 |
―
6.3 4.0 |
|
XIV |
10
20 30 |
71.8
88.0 83.0 |
18
20 18 |
154
178 136 |
58.3
74.2 46.6 |
0.020
0.045 0.019 |
4.92
5.19 7.96 |
Горит
4.5 3.4 |
―
7.5 7 |
| ЭД-20+
ПЕПА |
― | 36.0 | 1.5 | 100 | 15-20 | 0.003 | 3.8 | Горит | ― |
Как следует из данных таблицы, разработанные композиции по физико-механическим, диэлектрическим и другим свойствам превосходят соответ-ствующие показатели немодифицированной композиции ЭД-20 и, в отличие от последней, обладают самозатухаемостью. Они могут найти применение в ка-честве заливочных композиций для эффективной герметизации электрических узлов в электротехнической промышленности.
Список литературы:
- Bobbinqton A., Brinblecombe R. W. // Adv. Druq. Res. 1965. Vol. 2. p. 143.
- Böhm R. Wiss. Z. Univ. 1980. Bd. 29. № 2. s. 97.
- Eliel E. L., Rao V. S., Pietrusiewicz K. M. // OMR. 1979. Vol. 12. № 8. p. 461.
- Pat. 2113454 США // С. А., 1972, Vol. 77. p. 164665.
- R.Alan Aiken, Stephen S. // Proqress in Heterocyclic Chemistru. 2003, Vol. 15. p. 249.
- Richard S. P., Label J. //Kompaunds. 1974. Vol.10. № 3. p. 381.
- А.С.702020 СССР. Б.И., 1979. №45.
- Бабаев М. Г. Автореф. конд. дис. Баку. 1987. 24 с.
- Бабаев М.Г., Халилов Х.Д., Керимов А.Х. // Пласт. массы. 2005. № 11. С.15.
- Карабаков К. И., Иванов А. В. ИХГС. 2001. № 5. с. 579.
- Керимов А. Х. // ЖОрХ . 2001. Т. 37. Вып. 1. С. 144.
- Керимов А. Х., Мамедова Х. А., Оруджева А. Т. Исследования «Института полимерных материалов» НАН Азербайджана (сборник научных трудов). Баку. 2014. с. 189.
- Керимов А.Х. //ЖОХ.2004. Т.74. Вып.2. С. 287.
- Керимов А.Х., Оруджева А.Т. //Пласт. массы. 2013. № 3. С. 17.
- Лебедев Н. Н. Химия и технология основного органического и нефтехимического синтеза. М.: Химия, 1975. С. 671.
- Олышанова К. М., Потапова М. А., Морозова Н. М. Практикум по хроматографическому анализу. М.: ВШ. 1970. с. 64.
- Онищенко А.С. Диеновый синтез. М.: Химия. 1963. с. 281.
- Пат. 3661929 США. // С. А., 1972 Vol. 77. р. 48436.
- Пат. 587839. Великобр. Питер К., Эрлис Р. // Б. И. 1978. № 1.
- Потапов В. М. Стереохимия. М.: Химия. 1976. с. 335.
- Сайкс П. Механизмы реакции в органической химии. М.: Химия. 1991. с. 228.
- Хабибулин И. Р., Терегулова Г.Т., Рольник Л. З. // ЖОрХ. 1991. Т. 27. Вып. 5. С. 1078.
- Шевчук А. С., Подгорнова В. А., Тикайкина Е. Г. //ЖПХ. 1999. Т.72. Вып. 5.С.815.
- Шрот В. // ХГС. 1985. № 11. С. 1443.[schema type=»book» name=»СИНТЕЗ ПЯТИЧЛЕННЫХ ГЕТЕРОЦИКЛОВ С ВИЦИНАЛЬНЫМИ ДИОКСОГРУППАМИ НА ОСНОВЕ АЛЬДЕГИДОВ КАРБОЦИКЛИЧЕСКОГО И АРОМАТИЧЕСКОГО РЯДОВ И ИЗУЧЕНИЕ ИХ СВОЙСТВ» author=»Керимов Алверди Ханкиши оглы, Оруджева Арзу Таджир кызы, Мамедова Хураман Алим кызы» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-05-29″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_ 30.01.2015_01(10)» ebook=»yes» ]

