Введение
Целью настоящей работы было исследовать, как влияет состояние анионов в растворах солей молибденовой, вольфрамовой и хромовой кислот на их физико-химические свойства до и после электрохимической обработки в ячейке с медным катодом.
В работе использованы соли Na2MoO4, Na2WO4, Li2WO4 и K2Cr2O7. Концентрация их в растворе составляла 0,02 моль/л. Согласно литературным данным [1], в области концентраций 0,2…0,002 моль/л вольфрамат- и молибдат- ионы образуют полиядерные комплексы типа [MonO3n+3]6- или [НMonO3n+3]5-, где n =7, концентрация которых может достигать 99% (область рН 2-6). Преобладающее влияние электрохимической адсорбции и последующих твердофазных превращений с образованием в адсорбированном слое оксидных соединений промежуточной валентности Me(VI)→ Me(IV)→ Me(II), имеющих каркасную структуру, по каналам которой свободно движутся катионы щелочных металлов [2,3]. Это неизбежно приводит к образованию в поверхностном слое большого количества свободных катионов щелочного металла. За счет градиента концентрации они перемещаются в глубь электрода к границе с металлом основы, где разряжаются по механизму катодного внедрения с образованием сплава NaxCu. Таким образом, способность полианионов [MеnO3n+3]6- или [НMеnO3n+3]5- к электрохимической адсорбции позволяет сочетать процесс катодного внедрения щелочного металла с образованием гетерометаллических оксидов типа Na2xCu3+xMo2O7+x.
Медный электрод изготовляли из фольги (ГОСТ 1173-2006) в виде пластин с площадью рабочей поверхности 1 см2. Противоэлектродом служил титан (S = 10 cм2). В качестве электрода сравнения использовали хлорсеребряный электрод. Во всех растворах исходный бестоковый Eб/т потенциал лежал в пределах 0,06±0,02 В. Электрохимическая обработка велась в двух режимах. При первом Cu электрод выдерживали при плотности тока 25 мА/см2 в течение 30 мин и затем циклировали в потенциодинамическом режиме в интервале потенциалов от Еб/т до -3 В и обратно до Еб/т в условиях последовательно возрастающей скорости развертки потенциала: 4→8→20→40→80 мВ/с. Во втором случае электрохимическую обработку вели в потенциостатическом режиме при потенциале -2,7 В в течение 30 мин. Как следует из рис. 1 и 2 изменение режима обработки практически не сказывается на ходе кривых оптической плотности, остается в тех же пределах электропроводность растворов, однако заметно возрастает плотность растворов (рис 1,2, таблицы 1-3). Определяющим является влияние полианионной структуры раствора и природы катиона щелочного металла. Для измерения плотности ρ жидкости использовали набор ареометров постоянной массы. Электропроводность определяли кондуктометром «Эксперт-002-2-6-n» (датчик InLab 710). Оптическую плотность растворов определяли на фотометре КФК – 3-01-«ЗОМЗ» в автоматическом режиме. Число повторений составляло 3-6.
Для растворов K2Cr2О7 концентрации 0,02 моль/л характерно наличие на кривых оптической плотности двух размытых максимумов в области длин волн ~360±20 нм и ~460±40 нм (рис.1, 2). Это может указывать на присутствие в растворе двух форм анионов, находящихся в равновесии друг с другом: HMeO4— и MeO42-. В отличие от K2Cr2О7, в растворах молибдатов и вольфраматов оптическая плотность снижается на порядок и более, а максимумы оптической плотности смещаются в область более низких длин волн 320±20 и 400±20 нм. При этом, второй максимум значительно ниже. Как следует из таблицы 1-2, при наиболее низкой плотности раствора K2Cr2О7 его удельная электропроводность более чем в 2 раза выше, по сравнению с растворами молибдатов и вольфраматов. Это согласуется с фактом образования в растворах исследуемой концентрации полианионных структур:
7MeO42-+9H+↔HMe7O245-+4H2O (1)
или 7MeO42-+9Na++4H2O↔NaMe7O245-+8NaOH (2)
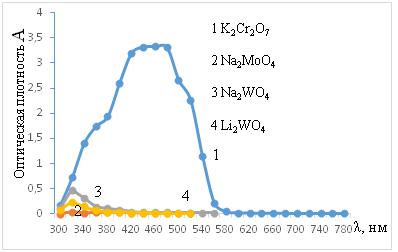
Рисунок 1. Оптическая плотность исходных растворов 1-K2Cr2O7, 2-Na2MoO4, 3-Na2WO4, 4-Li2WO4, (С = 0,02 моль/л)
В зависимости от соотношения концентраций ионов Н+ и молибдат-(вольфрамат)-ионов содержание фрагмента МеО3 в полианионе может сильно различаться:
MeO42-↔Me7O246-↔Me8O264-↔Me36O1128-↔MeO3*Н2О. (3)
После электрохимической обработки характер кривых оптической плотности практически не меняется. Не меняется и электропроводность растворов, однако заметно возрастает величина ρ.
Таблица 1.
Электропроводность и плотность растворов (С=0,02М) до катодной обработки
| Электролит | Κ, См/м | ρ, г/см3 |
| K2Cr2O7 | 8,38*10-3 | 1,005 |
| Na2MoO4 | 3,60*10-3 | 1,015 |
| Na2WO4 | 3,56*10-3 | 1,012 |
| Li2WO4 | 2,65*10-3 | 1,015 |
Это может быть вызвано накоплением в растворе анионов с более высоким молекулярным весом, структура которых не затрудняет, а облегчает перемещение ионов щелочных металлов к электроду и участие их в катодном процессе.
Таблица 2.
Электропроводность и плотность растворов после катодной обработки с Cu-электродом в потенциостатическом режиме (при Е = -2,7 В, t = 30 мин)
| Электролит | Κ, См/м | ρ, г/см3 |
| K2Cr2O7 | 8,55*10-3 | 1,020 |
| Na2MoO4 | 4,40*10-3 | 1,015 |
| Na2WO4 | 3,60*10-3 | 1,025 |
| Li2WO4 | 2,65*10-3 | 1,026 |
Наблюдаемое при этом изменение окраски растворов указывает, что одним из возможных продуктов реакции являются соли меди (СuCr2O7, CuMoO4, CuWO4), которые частично переходят в раствор.
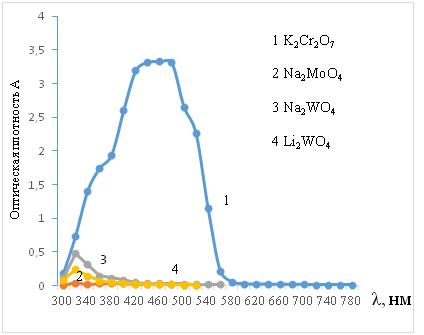
Рисунок 2. Оптическая плотность растворов после катодной обработки с медным электродом в потенциостатическом режиме (при Е = -2,7 В, в течение t = 30 мин).
Со временем исходный бестоковый потенциал Еб/т значительно смещается в область отрицательных значений. Это однозначно указывает на специфическую адсорбцию полианионов и их участие в твердофазных превращениях. Такая сильная поляризация Cu- электрода уже в отсутствие внешнего тока возможна вследствие протекания двух процессов:
NMoO3▪MoO42-+2H2O+2e—→ nMoO3▪MoO2 + 4OH— , (4)
2H2O+2e—→H2+2OH— . (5)
Сильное подщелачивание электролита у поверхности электрода сопровождается внедрением ОН— — ионов в решетку металла:
xCu+2yOH—→ CuxOy2-+yH2O (6)
Увеличение отрицательного заряда поверхности приводит к тому, что становится возможным внедрение катионов натрия и образования гетерометаллических оксидов типа:
(5+х)Na++yCu+NaMo7O245-+xe—→Na6+xCuyMo7O24 (7)
Это подтверждают и микрофотографии поверхности меди (рис 3)

Рисунок 3. Микрофотография поверхности медного электрода после обработке в растворе: а- K2Cr2O7 , б- Na2MoO4, в- Na2WO4 (0,02 М), в гальваностатическом режиме при iк= 25 мА/см2 в течение t=30 мин с последующей поляризацией в потенциодинамическом режиме с возрастающей скоростью развертки, мВ/с: 4→8→20→40→80; увеличение-1200, в1-увеличение – 200.
Использование методов катодной и бестоковой хронопотенциометрии, циклической вольтамперометрии, оптической микроскопии, кондуктометрии, фотометрии и денсиметрии позволило обнаружить, что как в отсутствие тока, так и при поляризации электрохимические превращения на Cu электроде сопровождаются заметными изменениями физико-химических свойств растворов: их удельной электропроводности, плотности и оптической плотности, что подтверждает участие анионов раствора в твердофазных превращениях, которые можно рассматривать как сопряженный электрохимический процесс, включающий электровосстановление полианионов с образованием на поверхности оксидов промежуточного валентного состояния (Cr, Mo, W) и сопряженное с ним окисление металла катода за счет освобождающего кислорода. Освобождающиеся катионы щелочного металла за счет градиента концентрации перемещаются в глубь металла электрода и разряжаются по механизму катодного внедрения с образованием сплава MexCu (Me = Li,Na).
Список литературы:
- Попова С.С., Гусева Е.С., Жускеев А.Р. Электрохимическое поведение MnO2 – электрода в растворах молибдатов и вольфраматов щелочных металлов //Вестник СГТУ, 2014. №2(75). С.76-83
- Текуцкая Е.Е., Турьян И.Я., Кравцов В.И., Кондратьев В.В. Потенциометрическое исследование равновесной реакции образования полиядерных комплексов молибдена (VI)// Электрохимия, 1991. Т.28, №4. С.407-409
- Кузнецов В.В., Кладити С.Ю. Особенности электрохимического поведения диоксидномарганцевых анодов, модифицированных оксидами молибдена // Известия ВУЗОВ. Химия и хим технология, 2012. Т. 55, №2.С. 55-58.[schema type=»book» name=»ЭЛЕКТРОХИМИЧЕСКОЕ МОДИФИЦИРОВАНИЕ РАСТВОРОВ СОЛЕЙ ПОЛИАНИОННЫХ КИСЛОТ НА МЕДНОМ ЭЛЕКТРОДЕ» description=»Исследовано влияние состояния анионов в растворах солей молибденовой, вольфрамовой и хромовой кислот на их физико-химические свойства до и после электрохимической обработки в ячейке с медным катодом. Использование методов катодной и бестоковой хронопотенциометрии, кондуктометрии, фотометрии и денсиметрии позволило обнаружить, что как при поляризации, так и в отсутствие тока, электрохимические превращения на Cu электроде сопровождаются заметными изменениями физико-химических свойств растворов.» author=»Гусева Екатерина Станиславовна, Жускеев Артем Романович, Попова Светлана Степановна, Строколенко Юлия Алексеевна» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-02-06″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_26.09.15_09(18)» ebook=»yes» ]

