Методы, основанные на цветных реакциях вольфрама с различными органическими реагентами, чрезвычайно многочисленны, но в практике химического анализа используют лишь некоторые из них [3,с.240]. Наибольшее распространение получили методы с применением толуол-3,4-дитиола и роданида[10,с.711]. Реагенты, содержащие -OH и -COOH группы, или две -ОН в орто положении друг к другу, взаимодействуют с вольфрамом преимущественно в слабокислых и нейтральных средах с образованием окрашенных комплексных соединений [11,с.286]. Для определения вольфрама использован 2-окси-5-хлортиофенол [5,с.71; 6,с.230], нитропроизводные пирокатехина, 2,3-дигидроксинафталина [6] и различные реагенты для ионной ассоциации [4,с.187;13,с.1305].
Настоящая работа посвящена исследованию взаимодействия вольфрама с 2-гидрокси-5-бромтиофенол (H2R, R) в присутствии аминофенолов. Из аминофенолов (АФ) использованы 2-(N,N-диетиламинометилтио)-4-метоксифенол (АФ1), 2-(N,N-дибутиламинометилтио)-4-метоксифенол (АФ2), 2,6-бис(N,N-диметиламинометил)-4-метилфенол (АФ3), 2,6-бис(N,N–диметиламинометил)-4-хлорфенол (АФ4), 2-(N,N-диметиламинометил)-4-метилфенол (АФ5), 2-(N,N-диметиламинометил)-4-бромфенол (АФ6) и 4-хлор-2-(N,N-диметиламинометил)-6-тиофенилметилфенол (АФ7). На основании полученных данных разработаны новые избирательные и высокочувствительные методики экстракционно-фотометрического определения микроколичеств вольфрама в сталях.
Материалы и методики исследований
Реагенты. Исходный раствор W(VI) готовили растворением в воде точной навески Na2WO4∙2H2O «ч.д.а.». Концентрацию раствора вольфрама устанавливали гравиметрически — осаждением вольфрама в виде H2WO4 и взвешиванием WO3 [7,с.201]. Растворы с концентрацией 0.1 мг/мл получали разбавлением исходного раствора. В работе использовали 0.01 М растворы R и АФ в хлороформе. R и АФ синтезировали по методике: [8,с.426] и [9,с.32] соответственно.
Для создания оптимальной pH среды использовали 0.1 М растворы NaOH и KOH. Ионную силу растворов поддерживали постоянным (µ=0,1) введением рассчитанного количества KCl.
Аппаратура. Оптическую плотность экстрактов измеряли на фотоколориметре КФК-2 и на спектрофотометре СФ-26, равновесное значение pH водной фазы измеряли на иономерe И-120.2 со стеклянным электродом. Спектры ЭПР растворов разнолигандных комплексов снимали на спектрометре JEOS-JES-PE-3X (Япония) с рабочей частотой 9400 МГЦ.
Методика. В градуированные пробирки с притертыми пробками вводили от 0.1 до 0.8 мл с интервалом 0.1 мл исходного раствора вольфрама(VI), 2.4 мл 0.01 М раствора R и 2.2- 2.3 мл 0.01 М раствора АФ. Необходимое значение pH устанавливали добавлением 0.1 М раствора NaOH. Объем органическoй фазы доводили до 5 мл хлороформом, а объем водной фазы до 25 мл дистиллированной водой. После полного расслаивания фаз органический слой отделяли и измеряли его оптическую плотность при комнатной температуре на КФК-2 при 490 нм (ℓ=0.5 см).
Анализ объекта. Навеску стали (в зависимости от концентрации вольфрама в ней) растворяли в HCl (1:1). Для разрушения карбидов добавляли несколько капель конц. HNO3. После растворения добавляли 60 мл горячей воды и 5 мл HCl (1:1) и кипятят в течение 5 мин. Полученный желтый осадок вольфрамовой кислоты отделяли фильтрованием через фильтровальную бумагу с “синей лентой”. Осадок промывают дистиллированной водой и растворяли в растворе 0.5 моль/л NaOH. После охлаждения переносили в колбу емк. 50 мл и разбавляют водой до метки.
О восстановлении вольфрама. Известно, что окрашенное соединение с дитиолом образует только W(V), до которого W(VI) восстанавливается самим реагентом [11,с. 286]. Для выяснения того, не меняется ли валентность вольфрама при взаимодействии с R были проведены две серии опытов: 1) проводили реакцию с R W(V), полученного восстановлением SnCI2 и KI в солянокислом растворе; 2) проводили ту же реакцию без применения дополнительных восстановителей. Продукты обеих реакций имели максимумы светопоглощения при 470 нм. Следовательно W(VI) при образовании комплекса с R восстанавливается до W(V) самим реагентом. Последний факт доказан также ЭПР исследованием.
Определение знака заряда комплексов. Опыты, проведенные с использованием КУ-2, АВ -17 и ЭДЭ-10П, показали, что комплекс влоьфрама с H2R является анионным. При встряхивании раствора комплекса с ионообменниками он сорбируется анионообменником АВ-17 и не сорбируется катионо-обменником. При введении в систему АФ наблюдается экстракция этого соединения в органическую фазу в виде разнолигандного комплекса (РЛК).
Опыты по электромиграции в U-образной трубке показали на анионный характер однороднолигандного комплекса. Электрофорез однороднолигандных комплексов показал, что соединение в водной фазе мигрирует к аноду, коэффициент электромиграции равен 73.8%.
Результаты исследований и их обсуждение
Выбор экстрагента. Для экстракции комплексов использованы разные неводные растворители: хлороформ, тетрахлорметан, хлорбензол, бензол, толуол, ксилол, изобутанол, изопентанол, дихлорэтан. Экстрагируемость комплексов оценивали коэффициентом распределения и степенью экстракции. Наилучшими экстрагентами оказались хлороформ, дихлорэтан и хлорбензол. Все дальнейшие исследования проводили с хлороформом.
Содержание вольфрама в органической фазе определяли фотометрически — толуол-3,4-дитиолом после реэкстракции, а в водной фазе – по разности [6,с.230]. Основность АФ практически не влияет на степень извлечения вольфрама. При однократной экстракции хлороформом извлекается 98.1-98.6% вольфрама в виде ионного ассоциата.
Влияние pH водной фазы. Вольфрам начинает взаимодействовать с R при рН ˃1.5. Для образования и экстракции РЛК оптимальным является pH 4.1- 5.6 (табл.1, рис.1). При повышении pH раствора ≥7.8 экстракция комплексов практически не наблюдается, что видимо, связано с понижением степени протонизации АФ.
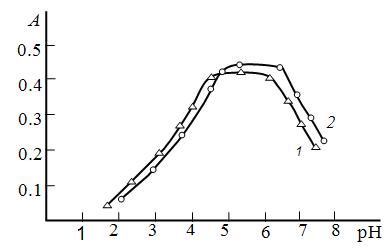
Рис.1. Зависимость оптической плотности РЛК вольфрама от рН водной фазы.
1.W(V) — R -АФ1, 2.W(V) — R -АФ2
= 1.09 ∙10-5 М; СR =(8.0-9.6)∙10—4 М; КФК-2; 440 нм; ℓ=0.5 cм.
Электронные спектры. Хлороформные экстракты РЛК W(V)- R -АФ имеют максимумы светопоглощения при 470-482 нм соответственно. Молярные коэффициенты поглощения колеблются в интервале (2.7-3.9)∙104 и выше, чем сообщалось в [5,с.71; 6, с.230; 13,с.1305; 15,с.283]. Как видно из табл.1, комплексы с участием AF1 и AF2 имеют высокие молярные коэффициенты поглощения. Их спектры представлены на рис 2.
Влияние концентрации лигандов и выдерживания. Для образования и экстракции РЛК W(V) с R и АФ необходимы следующие растворы: (9.2-9.6)∙10—4 М R, (8.8-9.3)∙10—4 М АФ.
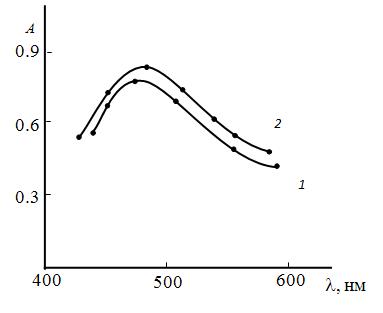
Рис. 2.Спектры поглощения комплексов вольфрама с ГБТФ и АФ.
1.W(V) — R -АФ1; 2.W(V) — R -АФ2
=1.09 ∙10-5 М; СR = (9.2-9.6)∙10—4 М; = (8.8-9.3)∙10—4 М, СФ-26, ℓ=1cм.
Таблица 1. Характеристика РЛК вольфрама с R и АФ.
| АФ | Состав
|
pHопт | lmax, nm | Dl, nm | e∙10–4 | lg b | lg Кек | Интервал подчинение закону Бера мкг/мл |
| АФ1 | 1:2:2 | 4.2-5.2 | 470 | 200 | 3.7 | 6.3 | 9.14 | 0.2-13.0 |
| АФ2 | 1:2:2 | 4.7-5.4 | 480 | 210 | 3.9 | 6.9 | 10.1 | 0.2-16.0 |
| АФ3 | 1:2:1 | 4.3-5.3 | 482 | 212 | 2.8 | 5.3 | 8.20 | 0.2-13.0 |
| АФ4 | 1:2:1 | 4.5-5.5 | 475 | 205 | 2.7 | 5.6 | 7.35 | 0.2-13.0 |
| АФ5 | 1:2:2 | 4.5-5.4 | 473 | 203 | 2.6 | 5.5 | 7.12 | 0.2-15.0 |
| АФ6 | 1:2:2 | 4.1-5.4 | 479 | 209 | 3.0 | 6.2 | 8.92 | 0.2-14.0 |
| АФ7 | 1:2:2 | 4.2-5.6 | 477 | 207 | 3.3 | 6.5 | 9.01 | 0.2-16.0 |
РЛК устойчивы в водных и органических растворителях и не разлагаются в течение трех суток, а после экстракции — больше месяца. Время контактирования фаз достигается в течение 15 минут.
Определение молярных соотношений реагирующих компонентов, элементный анализ и механизм реакции. Стехиометрические коэффициенты реакции устанавливали методами прямой линии Асмуса и сдвига равновесия [2,с.286]. Соотношение компонентов в РЛК W(V): R:АФ=1:2:2. Исключение составляют бис-аминофенолов (АФ3 и АФ4). Эти АФ входят в состав комплекса в дважды протонированном виде (H2АФ2+), стехиометрические коэффициенты 1:2:1 (W:R:АФ).
Учитывая что, при взаимодействии с R W(VI) восстанавливается до W(V) (W (V) при рН 3-7 в растворе находятся в виде [WО(ОН)2]+и [WO(ОН)]2+ [1]) реакции комплексообразования протекают следующим образом:
[WО(ОН)]2+ + 2H2R ⇄ [WO(ОН)(R)2]2– +4H+ (1)
[WO(ОН)(R)2]2– + 2HAФ1+ ⇄ [WO(ОН)(R)2](HАФ1+)2 (2’)
[WO(ОН)(R)2]2– + H2AФ32+ ⇄ [WO(ОН)(R)2](H2АФ32+) (2”)
Уравнение (2’) соответствует взаимодействию [WО(ОН)(R)2] с катионом АФH+ (АФ1, АФ2, АФ5, АФ6 и АФ7), а уравнение (2”) — АФH2+ (АФ3 и АФ4).
Для подтверждения соотношение компонентов в РЛК было выделено комплексы с АФ1 и АФ2, в твердом состоянии и проанализировано на азот, бром, вольфрам и серу. При этом получены следующие результаты:
| W | Br | S | N | ||
| [WO(ОН)(R)2](HАФ1)2 | Вычислено, % | 19.19 | 16.68 | 6.67 | 2.92 |
| Найдено, % | 19.43 | 16.37 | 6.63 | 2.76 | |
| [WO(ОН)(R)2](HАФ2)2 | Вычислено, % | 14.72 | 12.80 | 5.12 | 2.24 |
| Найдено, % | 14.62 | 12.74 | 5.09 | 2.11 | |
Вычисления константы равновесия и экстракции. На основании уравнения реакции (2’) можно вычислить константу равновесия реакции
lgКрав = lgD – 2lg [АФ1Н+]
а в случае АФ3 и АФ4 (уравнение 2”)
lgКрав = lgD – lg [АФ3Н2+].
Константы экстракции вычисляли по уравнению
lgКех = lgD — 2lg[R 2-] — 2lg[АФ1Н+]
а в случае АФ3 и АФ4
lgКех = lgD — 2lg[R 2-] — lg[АФ3Н2+]
Результаты вычисления константы равновесия и константы экстракции реакции приведены в табл.1.
Произведенные расчеты [1,с.2007] показали, что РЛК в органической фазе не полимеризуются и находятся в мономерной форме (γ= 0.91-1.20).
Закон Бера и пределы обнаружения. Соблюдение закона Бера (табл. 2) для хлороформных экстрактов комплексов наблюдается в интервале концентраций вольфрама 0.2-16 мкг/мл, что позволяет использовать их для определения вольфрама. Вычислены пределы фотометрического обнаружения вольфрама в виде РЛК (для АФ1 и АФ2 0.06 мкг/мл и 0.05 мкг/мл соответственно).
Влияниепосторонних ионов. Избирательность спектрофотометрического определения вольфрама(V) с R и АФ представлена в табл. 2. Установлено, что
Таблица 2. Влияние посторонних ионов на определение вольфрама с R и АФ (взято 30 мкг W(V), n = 5, р = 0,95).
| Ион | Мольный избыток иона | Маскирующий реагент |
Аминофенолы |
|||
| АФ1 | АФ2 | |||||
| Найдено W, мкг | sr102 | Найдено W, мкг | sr102 | |||
| Co(II) | 50 | 30.1 | 2.3 | 29.7 | 2.8 | |
| Ni(II) | 50 | 29.9 | 4.2 | 29.8 | 3.9 | |
| Fe(II) | 200 | 29.8 | 5.0 | 30.2 | 4.7 | |
| Cd(II) | 200 | 29.6 | 4.9 | 29.8 | 4.5 | |
| Al(III) | 180 | NaF | 30.2 | 1.5 | 30.0 | 2.2 |
| Fe(III) | 60 | Tиогликолевая кислота | 30.2 | 4.5 | 29.7 | 3.5 |
| Zr(IV) | 50 | 30.0 | 2.4 | 29.8 | 2.3 | |
| Cu(II) | 25 | Tиомочевина | 29.5 | 2.3 | 29.6 | 2.5 |
| Hg(II) | 40 | 29.2 | 4.2 | 30.3 | 3.9 | |
| Ti(IV) | 30 | 29.6 | 2.1 | 30.6 | 2.3 | |
| V(IV) | 20 | 29.6 | 1.5 | 29.6 | 1.6 | |
| Mo(VI) | 10 | ЭДТА | 30.4 | 2.3 | 30.0 | 2.5 |
| Cr(III) | 120 | 29.5 | 1.5 | 29.4 | 1.6 | |
| Nb(V) | 50 | 30.1 | 4.2 | 30.0 | 4.3 | |
| Ta(V) | 50 | Aскорбиновая кислота | 30.0 | 3.2 | 29.4 | 3.3 |
| 50 | 30.2 | 1.5 | 29.8 | 1.7 | ||
большие количества щелочных, щелочноземельных элементов, РЗЭ, F—, CI—, Br—, SO32-, SO42-, и С2O42- не мешают определению вольфрама. Мешающее влияние Fе (III) устраняли тиогликолевой кислотой (0,01 мол/л; 2 мл), Ti(IV)–аскорбиновой кислотой, Cu(II) –тиомочевиной, а Mo(VI) и Nb(V) –оксалат ионами. При использовании ЭДТА определению не мешают Ti(IV), V(IV), Nb(V), Ta(V), Mo(VI) и Fe(III).
В табл. 3 приведены данные, позволяющие сравнить аналитические характеристики методик определения вольфрама с некоторыми уже известными [3, с. 240; 10, с. 711; 15, с. 283; 12, с. 341] методиками а в табл. 4 показаны результаты анализа объекта — сталь 339 (W — 0183%).
Таблица 3. Сравнительные характеристики методик определения вольфрама
| Реагент(ы) | pH | Растворитель | l, нм | e×10-4 | Область подчинения закону Бера (мкг/мл) | Лит. |
| Толуол-3,4-дитиол | 1.5-2.0 | CH3Cl | 640 | 1.92 | — | [10,с.532] |
| 8-Меркаптохинолин | 0.5-3.0 | C4H9OH+
CH3Cl(1:1) |
412 | 0.367 | ≤4 | [3,с.150] |
| 8-Гидроксихинолин | 4.4 | CH3Cl | 363 | 0.64 | — | [3,с.143] |
| 4-нитропирокатехин + МТТ* | 1.2-3.6 | CH3Cl | 415 | 2.8 | 0.9-8.8 | [15,с.283] |
| 3,5-динитропирокатехин + ТТХ* | 0.25-0.4 М H2SO4 | CH3Cl | 400 | 2.12 | 0.5-7.4 | [15,с.283] |
| 2,3-дигидрокси-нафталин + ИНТ* | 0.1-1.1 М H2SO4 | CH3Cl | 420 | 0.938 | 0.7-7.4 | [15,с.283] |
| 3-гидрокси-2-(2’-тиенил)-4-оксо-4Н-1-бензопиран | 0.2 M HCl | C2H4Cl2 | 415 | 6.45 | 0-2.8 | [15,с.280] |
| R + АФ1 | 2.0-5.8 | CH3Cl | 470 | 3.7 | 0.2-13.0 | |
| R + АФ2 | 2.2-5.9 | CH3Cl | 480 | 3.9 | 0.2-16.0 | |
| MTT* -3-(4,5-диметил-2-тиазол)-2,5-дифенил-2H-тетразолиум; TTХ*-2,3,5-трифенил-2H-тетразолиум; ИНT*-3-(2-нафтил)-2,5-дифенил-2H-тетразолиум | ||||||
Таблица 4. Правильность и воспроизводимость определений вольфрама в стали (сталь 339,W-0,183%) (n=5, р=0,95).
| Метод | Sr, % | |
| R +AФ1 | 0,180±0.011 | 5 |
| R +АФ2 | 0,182±0.007 | 3 |
| Толуол-3,4-дитиол [2] | 0.185±0.009 | 4 |
СПИСОК ЛИТЕРАТУРА
- 1.Ахмедли М. К., Клыгин А. Е., Иванова Л. И., Баширов Э. А. О химизме взаимодействия ионов галлия с некоторыми сульфофталинами // Журнал неорганической химии, 1974, Т. 19, № 8, с. 2007-2011
- 2.Булатов М.И., Калинкин И.П., Практическое руководство по фотоколориметрическим и спектрофотометрическим методам анализа. 1986, M.-Л.: Химия — с.286
- Бусев А.И., Иванов В.М., Соколова Т.А. Аналитическая химия вольфрама. Наука.: Москва,1976 — с.240
- 4.Гавазов K. Б., Димитров A. Н., Лекова В. Д. Применение тетразолиевых солей в неорганическом анализеусп //Усп. Хим. 2007, 76, 187-198.
- Залов А. З. Экстракционно-фотометрическое определение марганца(II) о-гидрокситиофенолом и аминофенолами //Вестник СПбГУ, 2015, Сер. 4. Т. 2 (60). Вып. 1, с.71-81.
- 6.Залов А. З., Вердизаде Н. А. Экстракционно-спектрофотометрическое опре деле ние вольфрама с 2- гидрокси-5-хлортиофенолом и гидрофобными аминами //Журн. аналит. химии. 2013, т.68, №3, с.230-236
- 7.Коростелев, П.Т., Приготовление растворов для химико-аналитических работ. 1961, Москва: Изд-во АН СССР.
- 8.Кулиев А. М., Алиев Ш. Р., Мамедов Ф. Н., Мовсумзаде М. Журн. орган. химии 1976, Т.12, 426.
- 9.Мамедов Ф.Н., Султанова Н.Р. Конденсация тиофенола с основаниями Манниха. // Докл. АН. Аз. ССР.1979, Т.31, №6, с.32
- Марченко З., Бальцежак М. Методы спектрофотометрии в УФ и видимой областях в неорганическом анализе. БИНОМ. Лаборатория знаний.: Москва, 2007. — с.711
- Умланд Ф., Янсен А., Тириг Д., Вюнш Г. Комплексные соединения в аналитической химии. Теория и практика применения. Мир: Москва. 1975 — с.531
- 12.Agnihotri N., Mehta R.J. Extractive-spectrophotometric determination of tungsten(VI) using 3-hydroxy-2-(2′-thienyl)-4-oxo-4H-1- benzopyran.// Annali di Chmica.2004.V.94. № 4.p.341-345.
- 13.Gavazov K. B., Lekova V. D., Dimitrov A. N., 13th International Metallurgy & Materials Congress, Congress E-book, Istanbul, 2006, pp. 1305-1312.
- 14.Gavazov K.B. Nitrodervatives of catechol: from synthesis to application.// Acta Chim. Slov.2012.V.59. P.1-17.
- 15.Lekova V, Gavazov K., Dimitrov A. А Ternary Complex of Tungsten(VI) with 4-Nitrocatechol and Thiazolyl Blue and Its Application for Extraction-spectrophotometric Determination of Tungsten. // Chem. Pap. 2006, 60, 283-287.[schema type=»book» name=»КОМПЛЕКСООБРАЗОВАНИЕ И ЭКСТРАКЦИЯ ВОЛЬФРАМА С 2- ГИДРОКСИ — 5 — БРОМТИОФЕНОЛОМ И АМИНОФЕНОЛАМИ» author=»ЗАЛОВ АЛИ ЗАЛ оглы, ГАДЖЫЕВА АФЕТ БАХРАМ кызы, СУЛЕЙМАНОВА ГЕЙСЕР СУЛЕЙМАН кызы» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-04-04″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_30.04.2015_4(13)» ebook=»yes» ]

