Арабиногалактан (АГ) использован в качестве сорбента в реакция взаимодействия с солями металлов в органических и водноорганических средах. Величины сорбции ионов кальция, магния, бария, меди, кобальта, никеля, цинка, свинца, олова, алюминия, железа составляли 0,4-1,7 ммоль/г АГ. Полученные биоминеральные композиты, кроме ферроарабиногалактана, являются водорастворимыми. Определены условия получения малорастворимых в воде биоминеральных полимеров на основе АГ и хлорид титана (IV) с содержанием металла более 20%.
АГ хорошо известен, как вещество с уникальными функциональными свойствами [6, с 27-37], что позволяет его рекомендовать в широкой области науки и техники.
Модифицирование АГ расширяет возможности применения его новых форм с более высокой эффективностью.
К таким реакциям модифицирования относятся реакции АГ с ионами металлов. Методика получения комплексных соединений ряда переходных металлов включает смешение растворов полисахарида, едкого натра и соответствующих солей металла [7, с 215]. Таким образом были получены комплексные соединения меди, никеля, кобальта и железа с АГ лиственницы сибирской. Предполагают, что в области рН >7 ионы металлов связываются с кислородными атомами гидроксогрупп с образованием прочных комплексов.
Методика получения ферроарабиногалактана также включает соасождение солей железа (II и III) в концентрированном (50%) растворе АГ (II, III). Метод можно отнести к золь-гель методу получения наноразмерных гидроксидов железа путем гидролиза соответствующих солей с параллельной адсорбцией АГ на высокоразвитой поверхности коллоидных частиц. В данном случае создаются условия при избыточной концентрации АГ, для инконденсироания гидратированных оксидов железа (II) и железа (III) молекулами полисахарида с одновременной стабилизацией агрегативной устойчивости этих коллоидных частиц за счет адсорбции.
Высокие значения рН осаждения солей железа гарантирует полное осаждение даже ионов железа (II) (константы гидролиза рК1=6,90; рК2=8,25
[ 9, с 165]. Для ионов железа (III) значение рН начала осаждения находится в кислой области (рК1=1,98; рК2=2,31; рК3=2,49 [ 9, с 166]. Полученные совместно осажденные гидроксиды разновалентных ионов железа в среде АГ существует в аморфнокристаллическом состоянии. Методика является универсальной т. к. условия осаждения позволяют выделить в виде гидроксидов принципиально большое количество ионов металлов в среде АГ, с необходимостью нейтрализовать избыток щелочи.
Полифункциональную молекулу АГ лиственницы сибирской с тремя незаменимыми гидроксильными группами боковых цепей можно рассматривать как слабокислотный катионит. В данной работе определяли условия получения биополимеров на основе АГ.
Синтез биополимеров на основе АГ и солей металлов проводили методом сорбции. В качестве сорбента использован очищенный порошкообразный препарат АГ выделенный из древесины лиственницы сибирской.
Сорбцию проводили в растворителях характеризующихся низкими значениями диэлектрической проницаемости. Использовали амфипротные растворители с дифференцирующими свойствами, что обеспечивает усиление диссоциации функциональных групп полиуглевода, т. е. увеличивает активность его, как сорбента, с параллельным изменением кислотно-основных свойств молекул растворенного вещества. Дополнительно в таких растворителях наблюдается ассоциация молекул растворенного вещества, возможно с образованием водородных связей, что может отражаться на протекании реакции сорбции металлов на АГ.
В работе использовали соли хлоридов металлов при различных концентрациях, которые определяли комплексонометрическим и фотометрическим методами. [2, с 346]
При исследовании сорбции тетрахлорида титана на АГ раствор титана (IV) в органическом растворителе приготавливали на холоду с осторожностью путем медленного добавления раствора соли титана (IV) в выбранный растворитель с необходимой диэлектрической проницаемостью 2,2 – 24,3. При необходимости диэлектрическую проницаемость среды увеличивали введением в систему воды в количестве 4-75%. В случае образования мутных растворов их фильтровали, что ограничивало верхний предел концентрации соли титана (IV).
При растворении TiCl4 в бензоле, гексане, диметилформамиде образовывались осадки светлого цвета и такие растворители в дальнейшем не исследовались. Взаимодействие солей металлов с АГ из растворов органических растворителей осуществляли в статических условиях при гидромодуле 5-200 за время 1-6 сут.
Изотермы сорбции титана(IV) на образцах АГ из растворов бутанола, этанола, бутилацетата, ацетона и диоксана снятые при гидромодуле 50 за время 1 сутки (рис.1), показывают что АГ поглощает сорбат в широком диапазоне концентраций.
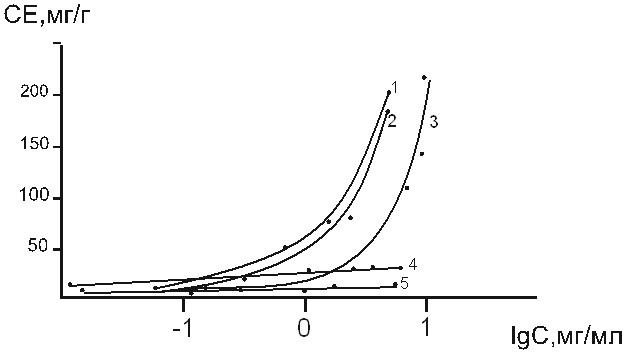
Рисунок 1. Изотермы сорбции TiCl4 на АГ из растворов: бутанола -1, этанола -2, бутилацитата -3, диоксана -5.
При этом сорбция из растворов с низкой концентрацией хлорида титана (IV) для всех изученных растворителей протекает приблизительно одинаково, а при увеличении концентрации хлорида титана (IV) величины сорбции титана (IV) резко отличаются в зависимости от природы растворителя. Такое различие может быть связано с комплексом различных причин, относящихся к свойствам макромолекул АГ, а также поведением кислоты-Льюиса – хлорида титана(IV) в различных растворителях. Так, например, сорбция раствора бутилацетата (БА) протекает при реализации координационных связей, т.к. растворение хлорида титана (IV) в безводном БА сопровождается образованием сольватов с их последующей диссоциацией по схеме аналогичной с хлоридом олова (IV) [3, с 1471-1473]:
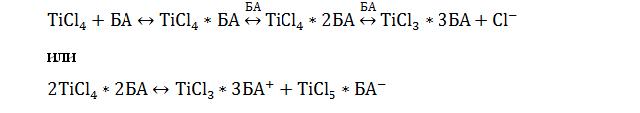
В растворе, при наличии ионных форм металла, возможна их адсорбция на открытых функциональных группах АГ.
В этом случае при увеличении концентрации соли титана увеличивается и степень ассоциации, что приводит к увеличению величины сорбции. Аналогичная картина может наблюдаться для спиртов, где образование дополнительной водородной связи может привести также к увеличению кислотных свойств АГ, что повышает сорбционную емкость. Максимальный выход целевого продукта составлял 95%.
В растворе ацетона акцепторные свойства более выражены по сравнению с донорными, что может снизить кислотные свойства сорбента с параллельным уменьшением сорбционной емкости. Приоритетным фактором, обуславливающим сорбционную способность АГ, может служить диэлектрическая проницаемость среды, которая влияет на степень ассоциации ионов титана(IV), а также на набухаемость и растворимость молекул АГ. Последние факторы связаны с доступностью функциональных групп полиуглевода в реакции с хлоридом титана(IV).
Образование полиядерных соединений титана(IV) с увеличением диэлектрической проницаемости раствора может служить в этом случае фактором увеличения сорбционной емкости АГ. Так, например, для этанола (ε=24,3) величина сорбции составила 170 мг/г, т.е. 17% от массы АГ, что значительно превышает содержание функциональных групп. В единицах количества вещества сорбция, равная 170 мг/г, составляет 3,7 ммоль титана (IV)/г АГ.
Величина сорбции титана(IV) в реакции с АГ в среде ацетона в 10 раз меньше, чем в растворе этанола.
Кинетику взаимодействия ионов титана (IV) с АГ изучали при гидромодуле реакции равном 50, который соответствовал объему растворителя, равному 250 см3 и 5 г АГ. Концентрация ионов титана(IV) устанавливалась максимально возможной для каждого растворителя и изменялась от 1 до 16 мг/дм3.
Сорбцию проводили в условиях постоянного перемешивания раствора магнитной мешалкой. Считали, что гидромодуль реакции практически на изменяется в процессе отбора проб для фотометрического определения содержания ионов титана, объем которых составлял 0.5 см3.
Время установления равновесного состояния системы для разных растворителей составляет 1 час при различных исходных концентрациях ионов титана(IV). Статическая емкость (СЕ) АГ по ионам титана(IV) достигнутая в равновесных условиях составляет для этанола, бутанола и ацетона 160; 80 и 20 мг/г сорбента соответственно.
Несмотря на то, что константы автопротолиза для указанных растворителей имеют близкие значения, соответственно указанным растворителям: pKs=19.14; pKs=20.10; pKs=20.3, величины сорбции ионов титана(IV) изменяются значительно (рис.2).
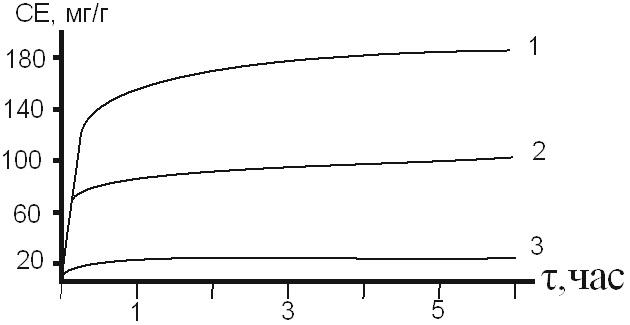
Рисунок 2. Кинетика поглощения TiCl4 арабиногалактаном из растворов этанола-1, бутанола-2, ацетона-3.
Это может быть связано не только с известным различием в донорно-акцепторных свойствах растворителей, но и заданной концентрацией хлорида титана (IV), обусловленной его растворимостью при приготовлении растворов.
В органическом растворителе сольватированные формы титана(IV) адсорбируются на поверхности АГ при участии, активированных растворителем, функциональных групп.
Диэлектрическая проницаемость растворителя является дополнительным фактором, влияющим на сорбционный процесс, который оценивали по сорбции титана(IV) из водно-органических растворов.
Сорбцию из водно-органических растворов этанола, диоксана и ацетона проводили при концентрациях ионов титана(IV) равных 2.2; 4.0 и 1.4 мг/см3 соответственно указанным растворителям за время 1 сутки при гидромодуле 50.
Изменение условий взаимодействия ионов титана (IV) с АГ за счет варьирования гидрофильности среды приводит к увеличению сорбции ионов титана(IV) (рис.3).
Рисунок 3. Влияние диэлектрической проницаемости среды на поглощение TiCl4 АГ из водно-органических растворов этанола-1, диоксана-2, ацетона-3.
Для систем, содержащих органический растворитель и воду (этанол, ацетон, диоксан — вода) наблюдается экстремальная зависимость поглощения ионов титана(IV) АГ при значениях диэлектрической проницаемости среды от 20 до 50, что соответствует 30-60% содержанию воды в реакционной системе. Величина поглощения ионов титана достигает 20% и более по твердой фазе, что может служить косвенным подтверждением процесса гомогенного осаждения легкогидролизующейся соли на поверхности АГ.
Экстремальная зависимость величины поглощения ионов титана(IV) от диэлектрической проницаемости среды, вероятно, связана с одной стороны с ассоциацией сорбируемых ионов, увеличивающейся при увеличении содержания воды (образование полиядерных комплексов), а с другой стороны – увеличивающейся тенденцией к растворению АГ в водной среде. Исходный АГ растворим как в воде, так и водно-органических средах при содержании органического растворителя до 20%. Стабилизация гидролитической устойчивости АГ происходит по мере накопления ионов титана(IV) в составе твердой фазы АГ. АГ, модифицированный ионами титана(IV), при содержании ионов титана(IV) 0.1% малорастворим в воде и дает устойчивую дисперсию 20-100 г/см3. Выход целевого продукта составлял 72-95%.
Методику сорбции на АГ соли титана(IV) из водно-органических растворов повторили для ряда других металлов.
В работе использовали соли хлоридов металлов марки ч.д.а., которые растворили в водно-этанольных растворах, содержащих 70% этанола. Концентрации солей кальция, магния, меди, кобальта, никеля, марганца, олова, свинца, цинка, алюминия, железа(III) определяли комплексонометрическим методом [5, с 112]. Сорбцию ионов металлов проводили в статических условиях. Навески АГ составляли 5.0 г, объем 0.1М растворов соответствующих солей металлов составлял 100 см3, время взаимодействия 1 сутки. После сорбции АГ промывали раствором этанола, и адсорбент сушили на воздухе. Величины сорбции ионов металлов из 70% раствора этанола составляли 0.4-1.7ммоль/г АГ (табл.1)
Таблица 1.
Составы соединений арабиногалактана с ионами металлов.
| Ион металла | Ca2+ | Mg2+ | Ba2+ | Cu2+ | Co2+ | Ni2+ | Sn2+ | Pb2+ | Zn2+ | Al3+ | Fe3+ |
| СЕ, ммоль/г | 1.72 | 0.60 | 0.48 | 0.52 | 0.74 | 0.36 | 0.82 | 0.42 | 0.64 | 1.34 | 1.26 |
Полученные металл-производные АГ, за исключением ферроарабиногалактана, растворимы в воде.
Малая растворимость Ti-формы АГ позволяет приготавливать водные дисперсии препарата различной концентрации и использовать в различных технологических процессах в качестве связующего или сорбента.
Связующее. Добавление модифицированного АГ, содержащего 10% ионов титана(IV) в фазе олигосахарида к бумажной массе, состоящей из 70% сульфатной беленой целлюлозы и 30% каолина, приводит к увеличению прочностных характеристик отливок бумаги по сравнению с контрольными образцами. Так при расходе модифицированного АГ 0.25-2.5% от массы волокна разрывная длина бумаги увеличивается на 20-40%, сопротивление продавливанию 50-60%, сопротивление излому в 4-2 раз.[10, с 125-126]
Сорбент. Оценка сорбционных свойств титановой формы АГ характеризует это вещество, как слабокислотный катионит. При содержании в твердой фазе титана(IV) от 170 до 14 мг/г величина сорбции, определенная по 0.022М раствору Cu(BF4)2, составляла 0.6-0.4 ммоль/г в сравнении с DОWEX 50 W*16, где в этих условиях CОE=1.3 ммоль/г.
Выводы. Предложен способ получения биоминеральных композитов путем сорбции соединений металлов из неводных растворителей на АГ.
Определены условия получения малорастворимого в воде титаноарабиногалактана с регулируемым составом путем сорбции из органических и водоорганических растворов с выходом 95%.
Проведена оценка функционального применения нового биоминерального полимера в качестве связующего и сорбента.
Список литературы.
- Александрова Г.П., Красильникова Н.М., Грищенко Л.А. Медведева С.А., Четверикова Т.Л. Синтез и антианемическая активность наноразмерного биокомпозита ферроарабиногалактана:Журнал Химия растительного сырья. 2010. №3. с 37-42.
- Булатов М.И., Калинкин И.П. Практическое руководство по фотокалориметрическим и спектрофотометрическим методам анализа: Ленинград. Химия. 1968. 384 с.
- Бучихин Е.П., Чекмарев А.М., Кузнецов А.Ю. Взаимодействие тетрахлорида олова с о-основаниями в бутилацетате:Журнал общая химия. 2002. т.77 с1471-1473.
- Дятлова Н.М., Темкина В.Я., Колпакова П.Д. Комплексоны. М.: Химия. 1970. 416 с.
- Комиссаренков А.А., Тамм Л.А. Реакционная способность арабиногалактана лиственницы по отношению к хлоридам металлов: Тез.докл.всесоюз.научно-тех.конф. «Химия и использование экстрактивных веществ дерева». Горький. 1990 120 с.
- Медведева Е.Н., Бабкин В.А., Остроухова Л.А. арабиногалактан лиственницы – свойства и перспективы использования: Журнал Химия растительного сырья. 2003, №1. с 27-37.
- Медведева С.А., Александрова Г.П. Стратегия модификации и биопотенциал природного полисахарида арабиногалактана: Журнал Панорама современной химии России. Синтез и модификация полимеров: сб.обзорник статей. М., 2003. с 328-352.
- Медведева С.А., Александрова Г.П., Грищенко Л.А., Тюкавкина Н.А. Синтез железо(2,3) содержащих производных арабиногалактана: Журнал общей химии. 2002. №9. с 1569-1573.
- Назаренко В.А., Антонович В.П. Невская Е.М. Гидролиз ионов в разбавленных растворах. М.: атомиздат. 1929. 192с.
- Тамм Л.А., Комиссаренков А.А., Барам А.А. Дробосюк В.М. Применение органоминеральной композиции на основе арабиногалактана в составе бумажной массы:Тез.докл всесоюз.научно-тех.конф. «Химия и использование экстрактивных веществ дерева». Горький. 1990 с125-126.[schema type=»book» name=»ПОЛУЧЕНИЕ БИОМИНЕРАЛЬНЫХ КОМПОЗИТОВ НА ОСНОВЕ АРАБИННОГАЛАКТАНА» author=»Комиссаренков Алексей Алексеевич, Тамм Леонид Акселевич, Федорова Олеся Вячеславовна» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-05-02″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_ 28.03.2015_03(12)» ebook=»yes» ]

