Для определения титана в различных объектах разработаны многиефото-метрические методы. Наибольшее распространение получили методы с приме-нениемтайрона,хромотроповой кислоты и диантипирилметана. К наиболее чувствительным методам относится роданидный метод(с экстракцией) и мето-ды с применением флуоронов [11, с. 497].
Реагенты, содержащие гидрокси — и карбокси-, или две гидрокси-группы в орто положении друг к другу, взаимодействуют с титаном преимущественно в слабокислых растворах с образованием окрашенных комплексных соединений [5, с.137].
Изучено комплексообразование титана (IV) с 4-нитрокатехина и солей тет-разолия. Ионные-ассоциаты были применены к экстракционно-спектрофото-метрическому определению титана в алюминиевых сплавах [17, с. 66-71].
Исследовано комплексообразование титана с 2,3,4-тригидрокси-4’-фтора-зобензолом в присутствии и отсутствие 1, 10-фенантролина [1, с.20-23.].
В настоящее время в аналитической химии все большее применение на-ходят органические реактивы, содержащие тионную (=С=S) и тиольную (=С-Н) группы атомов. Они отличаются значительной химической активностью и реагируют с большим числом ионов, образуя окрашенные или бесцветные со-единения различного состава. Высокая чувствительность реакций позволяет определять малые количества с достаточной степенью точности, причем в неко-торых случаях возможно избирательное определение одного элемента в присут-ствии других без предварительного разделения[16, с.641-655].
Для определения титана использован 2-гидрокси-5-хлортиофенол, 2-гид-рокси-5-бромтиофенол [6,с.97]и 2,6-дитиол-4-трет-бутилфенол [7, с.174; 8,с.175].
Настоящая работа посвящена спектрофотометрическому исследованиюразнолигандных комплексов (РЛК) титана с 2,6-дити-ол-4-метилфенолом (ДТМФ)и аминофенолами (АФ), а также изучению их спектрофотометричес-ких характеристик.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты и растворы.Исходные растворы (2,08•10-2 М) Тi (IV) готовили следующим образом: 0,835 г чистого ТiО2, прокаленного при температуре 9000 С сплавляли с 8 г К2S2О7 в кварцевом тигле. Прозрачный плав охлаждали и растворяли в 150 мл горячей Н2SО4 (1:2). Раствор по охлаждении разбавляли серной кислотой(1:5) в мерной колбе емкостью 500 мл[11, с. 498]. Концентра-цию раствора титана устанавливали гравиметрически — осаждением титана в виде гидроокиси титана и взвешиванием TiO2[10, с. 275]. Рабочие растворы с концентрацией 0,1 мг/мл получали разбавлением основного раствора 0,5 М серной кислотой. В работе использовали 0,01М растворы ДТМФ и АФ. Ами-нофенолыочищали перегонкой под вакуумом. В качестве экстрагентапри-менен очищенный хлороформ.ДТМФ очищали переосаждением из этанольных растворов прибавлением воды и затем перегонкой. постоянную ионную силу, равную µ=0,1 поддерживали введением рассчитанного количества KCl. Для создания необходимой кислотности растворов применяли 0,1М раствор HCI и ацетатный буфер.
Аппаратура. Оптическую плотность органической фазы измеряли на КФК-2 и СФ-26. Равновесное значение рН водной фазы измеряли на приборе И-120.2. со стеклянным электродом. ИК-спектры снимали на спектрофотометрефирмы “Bruker”.
Методика.В градуированные пробирки с притертыми пробками в ука-занной последовательности вводили 0,1-0,8 мл, с интервалом 0,1 мл исходного раствора титана, 2,4мл 0,01М раствора ДТМФ и 2,2 мл АФ. Необходимоезна-чение рН устанавливали добавлением 2 мл 1М раствора HCl, или же 5 мл аце-татного буфера. Объем органической фазы доводили до 5 мл хлороформом, а водной фазы-до 20 мл дистиллированной водой. После полного расслаивания фаз, органический слой отделяли и измеряли его оптическую плотность при комнатной температуре на КФК-2 при 440 нм (l=0,5 см).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
ДТМФ с титаном образует окрашенный комплекс, нерастворимый в не-полярных органических растворителях. Опыты по электромиграции в U-образ-ной трубке и по анионному обмену на анионообменнике ЭДЭ-10 П показали анионный характер однороднолигандного комплекса. При введении в систему аминофенолов наблюдается экстракция анионного комплекса в органическую фазу в виде РЛК. Из аминофеноловиспользован 2-(N,N-диметиламиноме-тил)-4-метилфенол (АФ1), 2-(N,N–диметиламинометил)-4-хлорфенол (АФ2) и 2-(N,N-диметиламинометил)-4-бромфенол (АФ3). На основании полученных данных разработаны новые высокочувствительные методики фотометричес-кого определения микроколичеств Ti в разных объектах.
Константы диссоциации.ДТМФ представляет собой трехосновную сла-бую кислоту (H3R) и в зависимости от рН среды может быть в молекулярной и анионных формах.В сильнокислой среде (до рН 3) реагент существует только в молекулярной форме H3R (рК1=6,82), а затем медленно диссоциирует (рК2=8,72, рК3=11,15).
Выбор экстрагента.Экстрагируемость комплексов оценивали коэффици-ентом распределения и степенью экстракции. Наилучшимиэкстрагентами ока-зались хлороформ, дихлорэтан и четыреххлористый углерод. При однократной экстракции хлороформом извлекается 97,6-98,0 % титана в виде РЛК. Даль-нейшие исследования проводили с хлороформом. Существенное влияние на ин-тенсивность окраски экстрактов оказывает чистота применяемого хлороформа. Присутствие в нем спирта снижает поглощение экстрактов.Падение коэффи-циента распределения смешанных комплексных соединений при использова-нии спирта можно объяснить, вероятно, сильным взаимодействием ДТМФ и АФ с растворителем.Содержание титана в органической фазе определяли фо-тометрически-тайроном после реэкстракции, а в водной -по разности.
Влияние pH водной фазы.Для образования и экстракции ионных ассоци-атов оптимальным является рН=1,7-3,4(рис.1).При рН≈1 и ниже оптическая плот-ностьобразующихся комплексов заметно снижается, что очевидно связа-но с уменьшением концентрации ионизированной формы и вероятнее всего в растворе он находится в недиссоциированном виде. При рН 5,5экстракция ас-социатов практически не наблюдается, что видимо связано с увеличением кон-центрации в водном растворе неэкстрагирующегося комплекса [TiO(ДТМФ)]4-, так как диссоциация ДТМФ по второй сульфгидрильной группе (рК2=8,72) продолжает возрастать. Зависимость оптической плотности от рН представлена на рис.1. Наличие одного максимума оптической плотности в указанных пре-делах рН подтверждает предположение об образовании одного ком-плексного соединения.
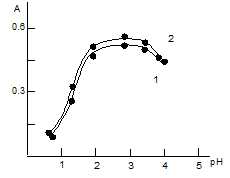
Рис. 1. Зависимость степени извлечения титана в виде РЛК от pH водной фазы.
- Ti (IV)-ДТМФ-АФ1, 2. Ti (IV)-ДТМФ-АФ2, CTi =4,16·10-5М, СДТМФ=0,96·10-3 М, САм=0,88·10-3М, КФК-2, l=440 нм, l=0,5 см.
Влияние концентрации лигандов и времени выдерживания.При экстрак-ции и спектрофотометрическом определении главным фактором является опти-мизация концентраций реагентов. Оптимальным условием образования и экс-тракции этих соединений является 0,96×10-3 моль/л и 0,88×10-3 моль/л концен-трация ДТМФ и АФ соответственно.
РЛК титана с ДТМФ и АФ устойчивы в водных и органических раст-ворителях и не разлагаются в течение трех суток, а после экстракции больше месяца. Максимальная оптическая плотность достигается в течение20 минут. При слабом нагревании (до 300 С) окраска развивается мгновенно.
Электронные спектры.Максимальный аналитический сигнал при комп-лексообразовании титана с ДТМФ и АФ наблюдается при 430-435нм (рис.2). ДТМФ максимально поглощает при 276 нм. Батохромный сдвиг составляет 154-159нм. Контрастность реакций высока: исходные реагенты почти бес-цветны, а комплексы-желтого цвета. Молярные коэффициенты поглощения составляютe= (2,55 -2,74)× 104.
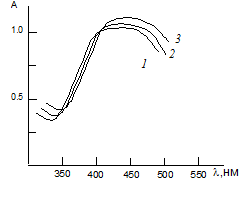
Рис.2. Светопоглощение РЛК титана с ДТМФ иАФ
Ti(IV)-ДТМФ-АФ1(1), Ti(IV)-ДТМФ-АФ2(2) и Ti(IV)-ДТМФ-АФ3 (3)
CTi=4,16·10-5 М, СДТМФ=0,96·10-3 М, САФ=0,88·10-3М; СФ-26, l=1 см.
Состав компонентов и механизм комплексообразования.Стехиометрию исследуемых комплексов определяли методами сдвига равновесия,относи-тельного выхода и прямой линии Асмуса[4, с. 250]. Приведенные на рис.3 дан-ные показывают, что в составе РЛК на один моль металла приходятся по два моля ДТМФ и АФ. Методом Назаренко было установлена, что комплексообра-зующей формой титана является TiO2+[12,13]. При этом число протонов, вы-тесняемых им из одной молекулы ДТМФ, оказалось равным 1.
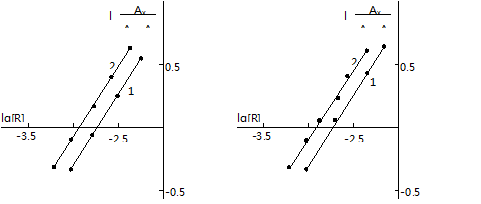
Рис.3. Определение соотношения компонентов методом сдвига равновесия для — Ti (IV)-ДТМФ- АФ1 (а) и Ti (IV)-ДТМФ- АФ2 (б)
1- Ti (IV):ДТМФ; 2- ДТМФ:АФ
CTi=4,16·10-5 М, СФ-26, l=440 нм, l=1 см.
Исчезновение ярко выраженной полосы поглощения в области 3200-3600см-1 с максимумом при 3460см-1, наблюдаемое в спектре ДТМФ, говорит о том, что –ОH группа участвует в образовании комплекса. Наблюдаемое умень-шение интенсивности полосы поглощения в области 2580см-1 показывает, что одна из –SН групп принимает участие в образовании координационной связи в ионизированном состоянии. Обнаружение полос поглощения при 1380 см-1 указывает на наличие протонированногоаминофенола [3, с.138,197; 14, с. 255].
Произведенные расчеты показали, что РЛК в органической фазе не поли-меризуются и находятся в мономерной форме(¡=1,07-1, с.12)[2].
Механизм образования РЛК можно представить следующим образом. Ионы титана при взаимодействии с двумя молекулами ДТМФ образуют двух-зарядный анионный комплекс, который экстрагируется с двумя молекулами протонированного АФ. Титан относится к «жестким» металлам и с кислород-содержащимилигандами образует устойчивые хелаты и другие лиганды не могут координироваться к иону металла.При образовании лигандомвыра-женной ковалентной связи с атомом металла орбитали металла становятся ан-тисвязывающими и их энергия повышается, взаимодействие этих орбиталей с орбиталями других лигандов становится менее эффективно[15, с. 37].
При рН≤4 аминофенолы находятся иссключительно в протонированном виде. С другой стороны смешанные комплексные соединения Ti (IV)-ДТМФ-АФпо положению λмакс близки к однороднолигандномудитиолфенолятному комплексу. Очевидно, окраска как смешанных, так и однороднолигандных комплексов обусловлена одинаковыми электронными переходами. А именно переносом электронов от дитиолфенолят иона к иону металла, и эти комплек-сы являются комплексами с переносом заряда.Близкие значения максимумов светопоглощения позволяет сделать вывод о том, что образующиеся соедине-ния являются ионными ассоциатами, у которых внешнесферный лиганд влияет на свойства внутрисферного комплекса, обусловленные электростатическим взаимодействием, возможностью образования водородных связей.Состав экс-трагируемых комплексов можно представить формулой .
При электролизе растворов разнолигандных комплексов не наблюдалось их передвижения ни к аноду, ни к катоду даже после длительного пропускания тока, т. е. они электрически нейтральны. Опыты вели обычным способом, в U-образной трубке с двумя кранами, при напряжении 180-200 в и в силе тока 0,5-0,8 ма. Электролиз проводили на протяжении 3 час.
Экстракты ионных ассоциатов вольфрама подчиняются основному закону свето-поглощения при концентрациях 0,05 – 2,4 мкг/мл.
Методом пересечения кривых [4, с. 266] определены состав разнолиганд-ных комплексов и вычислены их константы устойчивости.Уравнений граду-ировочных графиков рассчитывали методом наименьших квадратов. На основа-нии уравнений градуировочных графиков рассчитывали предел фотометричес-кого обнаружения и предел количественного определения титана в виде ион-ныхассоциатов [9, с. 249].
В табл. 1. Приведены основные спектрофотометрические характеристики методики определения титана.
Таблица 1. Основные спектрофотометрические и аналитические характерис-тики РЛК Тi (IV) c ДТМФ и АФ1.
| Параметр | AФ1 | АФ2 | АФ3 |
| рНопт | 1,7-3,2 | 1,7-3,3 | 1,8-3,4 |
| lмакс, нм | 430 | 430 | 435 |
| e·10-4 | 2,55 | 2,62 | 2,74 |
| Степень экстракции,% | 98,0 | 97,8 | 97,6 |
| Область подчинения
закону Бера, мкг/мл |
0,05-2,0 | 0,05-2,0 | 0,05-2,4 |
| Уравнение градуировочных графиков | 0,014 + 0,247x | 0,016 + 0,0258x | 0,014 + 0,0272x |
| Коэффициент корреляции | 0,9875 | 0,9865 | 0,9862 |
| Предел обнаружения, нг/мл | 18 | 17 | 16 |
| Предел количественногоопре-деления, нг/мл | 59 | 54 | 51 |
| Чувствительность, нг/мл | 1,88 | 1,83 | 1,75 |
| Констант устойчивости | 6,7 | 6,5 | 6,4 |
| Констант равновесий | 6,54 | 6,35 | 6,25 |
| Констант экстракции | 11,5 | 11,1 | 10,8 |
Влияние посторонних ионов.Для оценки применимости экстрактов РЛК для разделения и определения титана изучено мешающее влияние посторонних ионов (табл.2) Установлено, что большие количества щелочных, щелочнозе-мельных элементов, РЗЭ, CI—, не мешают определению титана. Не мешают также небольшие количества тартрат-, хлорид-, сульфат- и молибдат- ионов. Мещают нитрит-, нитрат-, фторид- , оксалат- и цитрат ионы. Мешающее влияние Fе (III) устраняли тиогликолевой кислотой, V (IV)– аскор-биновой кислотой, Cu(II) – тиомочевиной, а Mo(VI) и Nb(V)-ортофосфат ионом. Большие количества Fe(III) можно маскировать ортофосфорной кис-лотой. Ортофосфорная кислота несколько снижает интенсивность окраски ком-плексов титана вследствие комплексообразование с ним.
Таблица 2. Влияние посторонних ионов на определение титана (IV) в виде РЛК
с ДТМФ и АФ1(введено 50,0 мкг Тi (IV)).
| Ион | Мольный избыток иона | Маскируюший реагент | Найдено Ti, мкг | Sr |
| Co(II) | 210 | 49,8 | 0,04 | |
| Ni(II) | 210 | 50,2 | 0,03 | |
| Al(III) | 220 | 49,8 | 0,05 | |
| Fe(II) | 300 | 49,6 | 0,04 | |
| Mn(II) | 200 | 50,4 | 0,05 | |
| Fe(III) | 80 | тиогликолевая кислота | 50,2 | 0,04 |
| Cd(II) | 210 | 30,2 | 0,03 | |
| Zr(IV) | 70 | Ортофосфат натрия | 30,5 | 0,04 |
| Cu(II) | 70 | тиомочевина | 50,8 | 0,04 |
| V(IV) | 80 | цианид калия | 49,8 | 0,05 |
| W(VI) | 40 | Ортофосфат натрия | 49,8 | 0,04 |
| Mo(VI) | 25 | Ортофосфат натрия | 50,2 | 0,04 |
| Cr(III) | 300 | 50,2 | 0,02 | |
| Nb(V) | 70 | 50,2 | 0,05 | |
| Ta(V) | 70 | — | 50,4 | 0,05 |
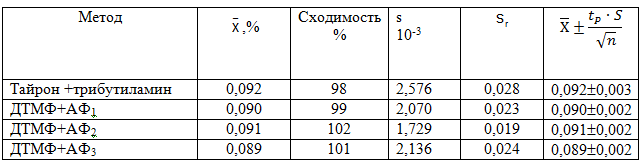
В табл. 3 приведены данные, позволяющие сравнить аналитические харак-теристики методик определения титана (IV) с уже известными методиками. По основным спектрофотометрическим характеристикам предложенные методики превосходят существующие. Изучение спектрофотометрических параметров комплексов позволяет сделать вывод о применимости данных реагентов для фотометрического определения титана.
Определение титана в металлическом алюминии. Металлический aлюми-ний содержит (%) : Тi -2,4•10-2, Zr – 1,5•10-2, Cu – 2,9•10-2, Pb – 3,7•10-2, As – 4,9•10-3, Si – 0,19, Fe – 0,31, Zn – 6,5•10-2, Ni – 9,1•10-3, Mg -2,2•10-3, Mn -1,3•10-2.
Навеску металлического алюминия (1 г) растворяли при нагревании в 20 мл HCl (1:1). Раствор переносили в мерную колбу емкостью 25 мл и доводили объем до метки дистиллированной водой. Аликвотную часть (1 мл) помещали в делительную воронку и определяли титан по разработанным методикам. Ре-зультаты определения представлены в табл.4
Таблица 3. Сравнительные характеристики методик определения титана (IV).
| Реагент | pH | растворитель | l, нм | e×10-4 | Область подчинения закону Бера (мкг/мл) | Отношение
Ме:R:Аm |
| Диантипирилметан | 0,4-4н HCl | Вода | 380 | 1,8 | 0,01-1,0 | |
| Тайрон | 4,3 – 9,6 | 410 | 1,0 | 0,3 – 3,0 | ||
| Хромотроповая кислота | 3,5 | 470 | 1,2 | 0,1-4,0 | 1:2 | |
| Дихлорхромотроповая кислота | 2,0 | 490 | 1,12 | 0,1-5,0 | ||
| Тайрон+трибутиламин | 4,0-5,5 | хлороформ | 380 | 1,8 | — |
1:3:5 |
| Хромотроповая кислота+трибутиламин | 4,5-5,0 | хлороформ | 425 | 2,7 | — |
1:2:4 |
| ДТМФ + АФ3 | 1,8-3,4 | хлороформ
|
435 | 2,74 | 0,05-2,4 | 1:2:2 |
| ДТМФ+АФ2 | 1,7-3,3 | хлороформ
|
430 | 2,62 | 0,05-2,0 | 1:2:2 |
Таблица 4. Результаты определения титана в металлическом алюминии(n=6, P=0,95)
| Метод | ,%
10-2 |
Сходимость % |
S
10-3 |
10-2 | |
| Тайрон+трибутиламин | 2,37 | 97 | 1.4 | 0,06 | (2,37±0,13) |
| Хромотроповая кислота+трибутиламин | 2,38 | 98 | 1.2 | 0,05 | (2,38±0,13) |
| ДТМФ+АФ1 | 2,45 | 102 | 1.0 | 0,04 | (2,45±0,08) |
| ДТМФ+АФ2 | 2,44 | 99 | 1.0 | 0,04 | (2,44±0,10) |
| ДТМФ+АФ3 | 2,38 | 101 | 1.1 | 0,05 | (2,38±0,10) |
Определение титана в сточной и морской водах. Для анализа были взяты четыри разных образца воды: два образца сточной(Азернефтяг НПЗ) и два морской (Г. Баку, Каспийское море) воды. Пробы сточной (0,5 и 1 л) и морской (1,5 и 2 л) вод испаряют, полученный твердый остаток растворяют в воде, обрабатывают 2 мл HNO3, нагревают при 60-70оС до полной отгонки HNO3,.После этого смесь фильтруют и переводят в колбы вместимостью 25; 50; 100 и 200мл соответственно. При определении титана фотометрическим методом Аликвотную часть (15 мл) помещали в делительную воронку, создавали оптимальный рН (рН=3), прибавляли 2,5 мл 0,01 М раствора ДТМФ и 1,0-1,2 мл АФ и определяли титан по разработанным методикам. Результаты опре-деления представлены в табл 5. Правильность определения установлена мето-дом добавок.
Таблица 5. Результаты определения титана с ДТМФи АФ2 в сточной и морской водах(n=6; P=0,95).
| Образец | Фотометрический метод | Метод добавок | ||||||
| ,%
10-6 |
S
10—7
|
10-6 | ,%
10-6 |
S
10—7 |
10-6 | |||
|
Сточная вода |
||||||||
| 1 | 3,25 | 1,46 | 0,045 | (3,25±0,18) | 3,33 | 1,83 | 0,055 | (3,33±0,15) |
| 2 | 3,30 | 1,68 | 0,051 | (3,30±0,18 | 3,36 | 1,58 | 0,047 | (3,36±0,16) |
|
Морская вода |
||||||||
| 1 | 3,35 | 1,54 | 0,046 | (3,35±0,16) | 3,44 | 0,10 | 0,030 | (3,44±0,10) |
| 2 | 3,35 | 1,30 | 0,038 | (3,35±0,15) | 3,46 | 0,12 | 0,035 | (3,42±0,09) |
Как видно из таблицы, результаты определения титана в сточной и мор-ской водахсвидетельствуют о достаточной надежности предлагаемых мето-дик.
Определение титана в стали. Навеску образца (1 г) переносили в стакан емкостью 100 мл и растворяли в 20 мл серной кислоты (1:4). Добавляли3 мл пергидроля, разбавляли дистиллированной водой до 40 мл и кипятили 25 минут. Содержимое стакана переносили в мерную колбу емкостью 50 мл и доводили дистиллированной водой до метки. Аликвотную часть (1 мл)поме-щали в делительную воронку, добавляли 1 мл 10%-ного раствора тиосульфата натрия и определяли титан по разработанным методикам. Результаты опре-деления представлены в табл.6.
Таблица 6. Результаты определения титана в стали с 127а (состав, %:Тi -0,09; Mn -1,58; Cr -1,72; Ni — 0,12). n=6; P=0,95
Cписоклитературы:
- Алиева Р. А., Назарова Р. З., Чырагов Ф. М. Фотометрическое определение титана с 2,3,4-тригидрокси-4’-фторазобензолом. Заводская лаборатория. Диагностика материалов. № 3.2009.т.75. с.20-23.
- Ахмедли М. К., Клыгин А.Е., Иванова Л.И., Баширов Э.А. // Журн. неорган. химии. 1974. Т. 19. №8. С. 2007.
- Беллами Л. Инфракрасные спектры сложных молекул. М.:1963.444с.
- Булатов М. И., Калинкин И. П. Практическое руководство по фотоколориметрическим и спектрофотометрическим методам анализа. Л.: Химия, 1986. -432c.
- Бусев А. И.,Типцова В.Г.,Иванов В.М. Практическое руководство по аналитической химии редких элементов. М.: Химия.1978. — 410с.
- Вердизаде Н. А., Залов, Кулиев К.А., Абаскулиева У.Б., Ибрагимов Г. И. Новый вариант окситиофенолятного определения титана // Всероссийская конференция «Химический анализ», Тезисы докладов. М.: ИОНХ.2008.С.97.
- Вердизаде Н. А.,Магеррамов А.М.,Залов А.З., Абаскулиева У.Б.,Ибрагимов Г.И. / Тез.докл. межд. конференции «Экстракция органических соединений». Воронеж, 2010. С.174.
- Вердизаде Н.А., Магеррамов А.М., Кулиев К.А., Абаскулиева У.Б., Искен-деров М.Г Экстракция титана (IV) в виде РЛК с 2,6-дитиол-4-третбутилфенолом и пиридином. / Тез.докл. межд. конференции «Экстракция органических соединений». Воронеж, 2010. С.175.
- Дорохова Е. Н., Прохорова Г. В.Аналитическая химия (физико-химические методы анализа). М.: Высшая школа, 1991. С. 250.
- Коростелев П. Т. Приготовление растворов для химико-аналитических работ. М.: Изд-во АН СССР, 1964. 401с.
- Марченко З., Бальцежак М. К. Методы спектрофотометрии в УФ и видимой областях в неорганическом анализе. М.:Бином.Лаборатория знаний. 2007.711с.
- Назаренко В.А. Взаимодействие ионов многовалентных элементов с органическими реагентами // Тр. комис.по аналит. химии АН СССР. М.:Наука, 1969.Т.17. С.22.
- Назаренко В.А., Бирюк Е.А. Исследование химизма реакций ионов многовалентных элементов с органическими реагентами // Журн. аналит. химии.1967.Т.12. №2. С. 463.
- Нокомато К. ИК-спектры и спектры КР неорганических и координационных соединений.М.: Мир, 1991.-
- Пилипенко А. Т., Тананайко М. М. Разнолигандные и разнометальные комплексы и их применение в аналитической химии. М.: Химия, 1983. — 221 с.
- Сонгина О. А., Бессарабова И. М.. Применение органических серусодержащихсоедине-ний в амперометрическом титровании(обзор).Заводская лаб. 1973. Т. 39. №6.С.641-655./.
- Kostova S., Dimitrov ,and Alexandrov A. Complexation Of Titanium (IV) With 4-Nitroca-techol And Tetrazolium Salts Tetrazolviolet And Iodonitrotetrazolium Chloride Chem. Papers 54 (2) 66-71 (2000).[schema type=»book» name=»СПЕКТРОСКОПИЧЕСКОЕ ИССЛЕДОВАНИЕ КОМПЛЕКСООБРАЗОВАНИЯ ТИТАНАС 2,6-ДИТИОЛ-4-МЕТИЛФЕНОЛОМ И АМИНОФЕНОЛАМИ» description=»2,6-дитиол-4-метилфенол(ДТМФ) образует с титаном(IV) окрашенный комплекс, нераство-римый в не-полярных органических растворителях. Опыты по электромиграции в U-образной трубке и анионному обмену на анионите ЭДЭ-10 П показали на анионный характер однороднолигандного комплекса. При введении в систему аминофенолов (АФ)наблюдается экстракция этого соединения в органическую фазу в ви-деразнолигандного комплекса. Из амиинофенолов использованы Из аминофенолов использован 2-(N,N–диметиламинометил)-4-метилфенол (АФ1), 2-(N,N–диметиламинометил)-4-хлорфенол (АФ2) и 2-(N, N-диметила-минометил)-4-бромфенол (АФ3). Максимальная степень экстракции разнолигандныхком-плексов наблюдается при pH=1,3-3,2. Максимальноесветопоглощение комплексов наблю-дается при 430-435 нм. Молярные коэффициенты поглощения cоставляют(2,55-2,74) •104. » author=»Кулиев Керим Аваз оглы, Абаскулиева Ульвия Балабек кызы, Мамедова Рена Алмаз кызы» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-02-18″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_29.08.2015_08(17)» ebook=»yes» ]

