Бериллий в природных водах может появляться как в результате разрушения минералов бериллия, так и в результате техногенных выбросов. Соединения бериллия обладают высокой токсичностью (элемент 1 категории опасности – ПДК в воде составляет 0,0002 мг/л). Разработка химических методов определения бериллия в воде на уровне ПДК и ниже очень важна для решения экологических задач.
Известные методики фотометрического определения следовых содержаний бериллия, в том числе в природных водах, предполагают предварительную сорбцию его. ГОСТ 18294-2004 [2] предлагает методику определения бериллия от 0,1 до 50 мкг/ дм3 в питьевых, поверхностных и подземных источниках питьевого водоснабжения с использованием флуорометрии, основанный на предварительной сорбции его на силикагеле при рН = 6 в присутствии ЭДТА (в статических условиях) и измерении флуоресценции его комплекса с морином. В литературе имеется ряд исследований, дающих положительные результаты отделения и концентрирования малых количеств бериллия с последующим определением его в объектах различного состава [3,4,7]. Однако, присутствие в анализируемых растворах природных вод фторид-ионов (нередко в преобладающем избытке по сравнению с содержанием бериллия) создаёт проблемы, приводящие к потерям бериллия на стадии его отделения. Аналогичные проблемы как при отделении бериллия, так и при его определении может создавать наличие в анализируемых объектах органических веществ (гуминовых и фульвокислот), если их предварительно не удалить, что не учитывается в методике ГОСТа 18294-2004. Кроме того, имеются указания [1], что использование для флуоресцентного определения реагента морин, приводит к плохой воспроизводимости результатов из-за неустойчивости щелочных растворов реагента и комплекса и существенным погрешностям измерения. Заслуживают внимание методики фотометрического определения бериллия с использованием реагентов: эриохромцианина R, а также хромазурола S (ХАS) [3] в присутствии бромида цетилпиридиния (ЦП) [4]. Последняя позволяет определять бериллий в присутствии ряда сопутствующих элементов, в том числе макроколичеств алюминия, и использует недорогую и доступную отечественную аппаратуру.
Цель настоящей работы – разработка сорбционно-фотометрического метода определения бериллия в природных водах c помощью реагента ХАS и ЦП после предварительного удаления фторид-ионов, органических веществ, отделения бериллия сорбцией на силикагеле и обладающей необходимыми метрологическими характеристиками.
Растворы и реагенты. Раствор бериллия готовили из ГСО 7759-2000 (0,1 мкг/мл) соответствующим разбавлением. ЭДТА (0,2 М раствор) готовили из фиксанала. Растворы ХАS ( 0.04%-е) готовили из препарата «ч.д.а.» ТУ 6-09-05-1175-82 в 50%-ном этаноле. Использовали свежеприготовленные растворы ЦП (ТУ 6-09-70-77) и 0,5%-ный раствор желатина (ГОСТ 11293-78). Растворы солей и кислот готовили из препаратов не ниже «ч.д.а.». Кислотность создавали 1М НСI и NH3, 2М СН3СООNa. Использовали 40%-ный раствор тартрата калия-натрия (сегнетова соль) «ч.д.а.» и 5%-ный раствор цитрата аммония «ч.д.а.»
Силикагель готовили из кремниевой кислоты «ч.д.а.» (ГОСТ 4214-70). Порции препарата растирали до пудрообразного состояния и промывали водой с добавлением нескольких капель раствора аммиака и разбавленным раствором ацетата натрия. Промытый силикагель фильтровали на воронку Бюхнера, промывали несколько раз водой и высушивали на воздухе. Сорбционная ёмкость силикагеля по бериллию составляла не менее 50 мкг/г сорбента.
Хроматографические колонки имели внутренний диаметр 8 мм, высота слоя сорбента 25-30 мм, масса силикагеля 0,5 г. Скорость пропускания раствора не более 2,5 мл/мин. Кислотность растворов контролировали стеклянным электродом (потенциометр «рН-340»). Оптическую плотность измеряли на спектрофотометре «СФ-26» в стеклянных кюветах с толщиной слоя 3-5 см.
Результаты и их обсуждение.
Оптимальные условия образования комплекса. Для количественного образования комплекса в системе Ве-ХАS-ЦП. рНопт = 5,0 — 5,2 (ацетатный буферный раствор) достаточно 6-кратного избытка ХАS и 10-кратного избытка ЦП. Комплекс имеет максимум светопоглощения при 620 нм; соотношение компонентов Ве:ХАS:ЦП = 1:2:5; εотн= 7,28 104. Нижняя граница определяемого содержания бериллия 0,002 мкг/мл. Для гомогенизирования растворов вводили раствор желатина. Закон Бера выполняется при содержании бериллия в диапазоне 0,002 – 0,04 мкг/мл. Комплекс количественно образуется за 30-35 мин и устойчив не менее 2 часов.
Селективность реакции изучали в присутствии ионов алюминия, железа, кальция, магния, молибдена, вольфрама, титана, урана и других элементов, наиболее часто сопутствующих бериллию в природных объектах [4]. Исследовано влияние ЭДТА, тартрат-, цитрат-, фторид-ионов, как маскирующих веществ для устранения влияния сопутствующих элементов. Установлено отсутствие мешающего влияния большинства сопутствующих элементов в присутствии ЭДТА и цитрат-ионов. В оптимальных условиях не мешают до 15 мг алюминия, до 0,6 мг титана, до 0,5 мг циркония, висмута, олова, до 50 мкг молибдена (VI), вольфрама(VI), ванадия (V), до 40 мкг тория, до 20 мкг урана (VI) можно замаскировать добавлением 5%-ного раствора цитрата аммония.
Концентрирование бериллия на силикагеле. Условия концентрирования бериллия на силикагеле изучены в динамических условиях. Количественная сорбция 1,4 мкг Ве при пропускании его через колонку с силикагелем (динамические условия) из растворов 0,01М по ЭДТА и 1%-ных по тартрат-иону (сегнетова соль) имеет место при рН 5,5 – 8,0 (см. рис.а), а в присутствии фторид-ионов, рН количественной сорбции смещается до 8,5 -10 (рис. б). Вместе с бериллием на силикагеле сорбируются уран(VI), торий и частично титан и цирконий (1-2% и 10-20 % соответственно от их содержания в анализируемом растворе). [ 7 ].
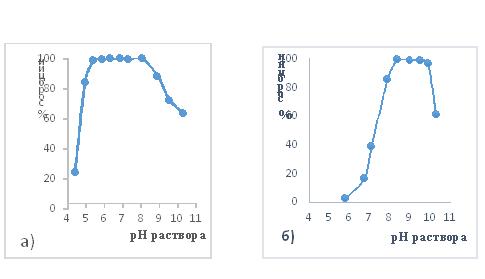
Рис. Сорбция бериллия на силикагеле в динамических условиях: а) из раствора 0,01 М по ЭДТА и 1%-ному по сегнетовой соли; б) из раствора 0,01 М по ЭДТА и 0,01М по NaF; Общий объём раствора 100 мл; содержание бериллия 1,4 мкг; скорость пропускания – 2,5 мл/мин; масса силикагеля в колонке – 0,5г.
Разработанная методика определения бериллия в природных водах предусматривает упаривание анализируемого раствора с полным мокрым сжиганием органических веществ и удаления фторид-ионов, сорбцию бериллия в динамических условиях, используя хроматографическую колонку с массой силикагеля 0,5 г и скоростью пропускания раствора, не более 2,5 мл/мин. Элюирование бериллия с колонки проводили промыванием её 5 мл раствора соляной кислоты (1:1) с последующим отмыванием водой до нейтральной реакции..
Методика определения. Пробу воды 400-500 мл*, предварительно подкисленную до рН 1,8-2,0 конц. соляной кислотой, отбирают в стакан, емкостью 500 мл, приливают несколько капель конц Н2О2, 10 -12 капель Н2SO4(1:1) кипятят и упаривают до паров SO3. Если остаток солей имеет желтый или коричневый цвет, то добавляют по каплям конц. HNO3 и снова упаривают до густых паров SO3 .Окисление органических веществ повторяют до полного удаления окраски солей. Соли растворяют в воде с добавлением 3-4 мл НCI (1:1), доводя объём раствора до 30 — 40 мл. Выпавший осадок кремниевой кислоты фильтруют через фильтр «белая лента», промывая его небольшими порциями воды, помещают фильтр с осадком в платиновый тигель, сжигают и прокаливают в муфеле при 900▫С. Остаток в тигле обрабатывают HF + H2SO4, упаривают досуха и сплавляют соли с небольшим количеством Na2S2O7. Плав растворяют и присоединяют к основному раствору. В полученный прозрачный раствор, имеющий объём 50-100 мл добавляют 5 мл 0,2М раствора ЭДТА, 2,5 мл 40%-ного раствора сегнетовой соли и по каплям при перемешивании раствор аммиака до рН 7,5-8.0 по рН-метру. Раствор пропускают через подготовленную колонку, заполненную 0,5 г силикагеля, предварительно промытую аммиачной водой с рН 8-8,5. Скорость пропускания раствора не должна превышать 2,5 мл/мин. Стакан с анализируемым раствором обмывают 5-10 мл воды с рН 8-8,5 и промывают им колонку.
Для элюирования бериллия колонку промывают 5 мл HCI (1:1), собирая элюат в стакан ёмкостью 50 мл. Колонку промывают водой до нейтральной реакции по индикаторной бумаге, объединяя элюат и промывные воды,
________
*Если в подкисленной воде имеется осадок, то пробу отбирают вместе с осадком.
добавляют 2 мл 0,1 М ЭДТА и раствор NH3 до рН около 3,7, кипятят полученный раствор 1-2 мин. После охлаждения вводят 2,0 мл 5%-ного цитрата аммония, 1,0 мл раствора желатина, по 1,0 мл 0,02%-ного ХАS и 0,02%-ного ЦП, перемешивая после добавления каждого реагента. Устанавливают рН 5,2 добавлением по каплям 2М раствора ацетата натрия. Количественно переносят раствор в мерную колбу ёмкостью 25 мл, разбавляя до метки водой и перемешивая и через 35-40 мин измеряют оптическую плотность при 620 нм в кювете 3,0 см относительно воды.
Для определения аналитического сигнала холостого опыта (содержания бериллия в реактивах) проводили через методику анализа серии холостых опытов (n=8), начиная с упаривания пробы и сжигания органических веществ. По полученным значениям сигнала холостого опыта рассчитывали среднее его значение, которое вносили как поправку к найденному содержанию бериллия.
Построение градуировочного графика. В стаканы, ёмкостью 50 мл отбирают 0;.0,5; 1,0; 2,0; 3,0; 4,0; 5,0 мл стандартного раствора бериллия, содержащего 0,1 мкг/мл, по 10 мл дистиллированной воды, по 2 мл 0,1М ЭДТА, создают рН 3,7-4,5, кипятят 1-2 мин, добавляют по 1,5 мл цитрата аммония и далее все реагенты, как указано в методике определения. Оптическую плотность полученных растворов измеряют в условиях методики и по её значениям строят градуировочный график.
Методика позволяет проводить разбраковку анализируемых проб по содержанию бериллия. Если предполагается высокое его содержание (0.5-1,0 мкг/л и более), то достаточно провести анализ из аликвотной части воды, объёмом 25-50 мл, обрабатывая её аналогично методике, но без операции сорбции бериллия на силикагеле.
Контроль правильности результатов анализа проводили методом добавок. Для этого к растворам анализируемых проб, вытекающим из колонок, после сорбции из них бериллия добавляли различные количества стандартного раствора бериллия и в полученных пробах проводили сорбционно-фотометрическое определение добавки бериллия по описанной методике. Полученные результаты по правильности и воспроизводимости вполне удовлетворяют требованиям ГОСТа. (см.табл.)
Таблица
Контроль правильности результатов анализа бериллия
| Введено
Ве, мкг/л |
Найдено Ве, мкг/л
|
Число определений,
n |
Относительное. стандарт.откл.,%отн. σ∑,r σД,r(∆)
Факт. Норматив |
Норма погрешности
(Р=0,95; n=2) ±δ,% [ 2 ]
|
| 1.15 | 1,16 | 6 | 2,4 12,8 | 25 |
| 0,72 | 0,74 | 8 | 4,3 12,8 | 25 |
| 0,108 | 0,103 | 6 | 9,9 25,5 | 50 |
| 0,072 | 0,052 | 6 | 17 25,5 | 50 |
Список литературы
1.Гладилович Д.Н., Столяров К.П.// Завод. лаб.,1981, 47, №5, С .3-6.
2.ГОСТ 18294-2004. Вода питьевая. Метод определения бериллия.
3.Новосёлова А.В., Бацанова Л.Р. Аналитическая химия бериллия. М., 1966.
4.Рудомёткина Т.Ф., Иванов В.М. // Вестн. Моск. ун-та. Сер.2. Химия. 2014. 55. №6, С.321.
5.Саввин С.Б., Данилин Е.С., Малютина Т.М. // Ж. аналит. химии, 1980. 35. С.457.
6.Саввин С.Б., Чернова Р.К., Кудрявцева Л.М. // Ж.аналит.химии.1976. 31.С.269.
- ulcek Z., Michal J., Doleẑal J. // Coll. Czechosl. Chem. Comm. 1961, 26, P.246.[schema type=»book» name=»РАЗРАБОТКА МЕТОДИКИ ОПРЕДЕЛЕНИЯ БЕРИЛЛИЯ В В ПРИРОДНЫХ ВОДАХ» description=»Разработана методика сорбционно-фотометрического определения 0,05-50 мкг/л бериллия в природных водах в форме смешаннолигандного комплекса с хромазуролом S и бромидом N-цетилпиридиния, обладающего высоким молярным коэффициентом поглощения. Для концентрирования бериллия используют его сорбцию на силикагеле. Для маскирования сопутствующих элементов в процессе сорбции вводят растворы ЭДТА и тартрат-ионы. При определении бериллия сопутствующие ионы связывают добавлением ЭДТА и цитрат-ионов.» author=»Рудомёткина Татьяна Фёдоровна» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-03-11″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_30.05.2015_05(14)» ebook=»yes» ]

