В настоящее время широко используются хемилюминесцентные (ХЛ) методы определения антиоксидантной активности (АОА) различных биологических субстратов: плазмы крови, всевозможных напитков, экстрактов растений и пр. [1, 5, 11-12]. Они достаточно чувствительны, оперативны и позволяют непосредственно контролировать кинетику ингибирования окисления антиоксидантами. Основными компонентами любой ХЛ модели являются: система генерации свободных радикалов и субстрат или молекула-мишень, при окислении которой возникает хемилюминесценция. Выбор модельной системы оказывает существенное влияние на получаемые результаты исследований АОА различных объектов. Большое количество ХЛ методов, широко используемых в органической химии, основано на инициированном окислении различных углеводородов, в результате рекомбинации перекисных радикалов которых образуются возбужденные молекулы соединений, испускающие свет. В таких системах для усиления свечения используются разные активаторы-люминофоры, а эффективное окисление протекает при температурах 50-800С [2, 4, 13]. В других методах, применяемых, главным образом, для медико-биологических исследований, в качестве хемилюминогенного субстрата окисления используется, в основном, люминол [3, 6-7, 9-10, 14-15]. Способ генерации радикалов в таких, относительно простых тест-системах, осуществляется по разным принципам: химическому (например, при взаимодействии гем-содержащих производных с перекисью водорода) или физико-химическому (при термоинициированном распаде азо-соединений). Чтобы выбрать наиболее адекватную и удобную модель окисления люминола для определения АОА сложных биологических субстанций, таких как сыворотка крови и другие биологические жидкости, экстракты растений, лекарственные препараты и пр., целесообразно сравнить антиоксидантные свойства и стехиометрию индивидуальных соединений, содержащихся в этих субстанциях, используя разные системы генерации свободных радикалов.
В настоящей работе на двух ХЛ моделях свободнорадикального окисления люминола проведены исследования антиоксидантной активности (АОА) и стехиометрии некоторых биологически значимых АО и влияния на эти параметры способа инициирования свободных радикалов. В качестве объектов исследования были выбраны водорастворимые соединения: мочевая кислота (МК), глутатион, аскорбиновая кислота (АК), мексидол (м), фенозан калия (ф), а также тролокс (водорастворимый аналог витамина Е), как часто используемый в различных методах в качестве стандарта.
Измерения АОА этих соединений были выполнены на двух ХЛ приборах: в первом окисление люминола инициировалось смесью «гемоглобин (Hb)-H2O2», во втором – водорастворимым азоинициатором (АБАП).
Первая модель окисления (Hb — H2O2 – люминол), хотя и не до конца изучена, привлекает внимание «физиологичностью» процесса, поскольку кровь содержит Hb и H2O2, и их взаимодействие может происходить in vivo [14]. Взаимодействие H2O2 с MetHb (в лабораторной практике используется окисленная форма гемоглобина — метгемоглобин (MetHb) – Hb-Fe3+), с одной стороны, сопровождается разрушением гема и выходом из него ионов железа, которые участвуют в образовании ОН·, а с другой стороны, приводит к возникновению радикалов феррилHb (Hb·+-Fe4+=O). Указанные радикалы-инициаторы вызывают одноэлектронное окисление люминола. В процессе его окисления образуется L·—-радикал, О2·—, эндопероксид люминола LO22— и 3-аминофталат дианион в возбужденном состоянии (АР2—)*, при переходе которого в основное состояние высвечивается квант света hν с длиной волны 425 нм. Преимущество модели: все реагенты доступны и не токсичны. Ограничения: нестабильность H2O2 и необходимость контроля ее концентрации. ХЛ для этой модельной системы регистрировали на приборе «Lum-5773» [www.chemilum.ru] при температуре T=37,0±0,5°С согласно методике [14]. В ячейку прибора добавляли 50мкл MetHb (15мкМ), 150мкл люминола (1мМ), 10мкл H2O2 (12мМ), 2,4мл фосфатного буфера (рН=7,4) и разные дозы исследуемых АО (от 0,1 до 60 мкл) с концентрацией 1мМ, растворенные в буфере или дистиллированной воде. Это: тролокс (6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновая кислота), АК, МК, глутатион восстановленный, фенозан калия (3-3,5-ди-трет-бутил-4-гидроксифенил пропионата калия, синтезирован в ИБХФ РАН) и мексидол сукцинат (2-Этил-6-метил-3-гидроксипиридина сукцинат, ИБХФ РАН).
Во второй модели (термо-ХЛ) инициирование свободных радикалов происходило при термическом распаде водорастворимого азо-соединения 2.2’-азо-бис (2-амидинопропан) дигидрохлорида (АБАП). Количество пероксидных радикалов, образующихся при термическом распаде АБАП равно: N = к[АБАП] t, где к – константа скорости генерации радикалов, t — продолжительность реакции. В водной среде при рН=7,4 и Т=370С, k=1,36∙10-6 c-1. Для антиоксиданта с концентрацией [АО] время ингибирования генерации пероксидных радикалов tinh = n[АО]/k[АБАП], где n – соответствующий стехиометрический коэффициент [9, 15]. Возникшие радикалы детектировались в реакции окисления люминола, сопровождающейся ХЛ. Преимуществом модели термо-ХЛ (ТХЛ) является постоянство скорости инициирования радикалов при стабильной температуре [10]. Регистрация ТХЛ осуществлялась на приборе minilum® [www.minilum.de] при Т=37±0,01°C с применением соответствующих наборов реактивов с общим объемом в ХЛ ячейке 1,5 мл. Для измерений использовались те же индивидуальные АО, как и для первой модели. В обеих ХЛ системах основным измеряемым параметром, характеризующим АОА изучаемых соединений, являлся период индукции t. Он определялся как время от момента инициирования окисления до точки пересечения с временной осью касательной, приложенной к ХЛ кривой в точке её перегиба, соответствующей максимуму первой производной. Для соединений, снижающих интенсивность ХЛ без выраженного периода индукции, параметром АОА являлась степень угнетения интенсивности ХЛ по сравнению с холостой пробой в точке ее максимума (I0/I). Ошибка измерений этих параметров для первого прибора с учетом повторяемости результатов составила не более 15%, для второго — 5%.
На рис. 1 приведены кинетические ХЛ кривые, полученные на обеих моделях окисления для тролокса, АК, МК, и глутатиона, а на рис. 2 – для фенозана калия (ф) и мексидола (м). Видно, что первые 4 АО не подавляют максимальную амплитуду ХЛ и имеют значительный период индукции для обеих моделей (рис.1а,б). Мексидол и фенозан демонстрируют уменьшение амплитуды (рис. 2)
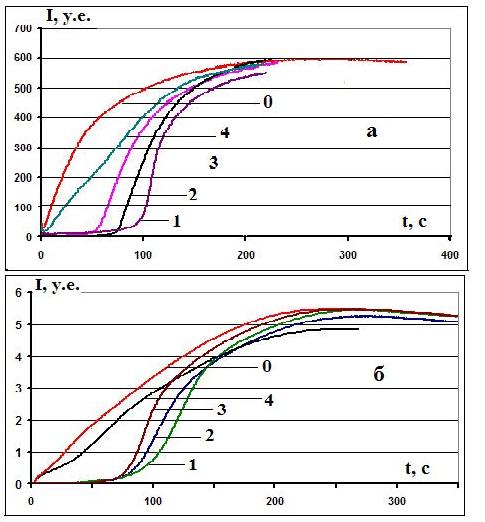 |
Рисунок 1. Характерные кинетические кривые развития ХЛ (зависимость интенсивности I от времени t) для двух моделей окисления люминола с различными инициаторами: «Hb— H2O2» (а) и «АБАП» (б). Здесь: кривая 0 –
холостая проба, 1 – МК, 2 – тролокс, 3 – АК, 4 – глутатион. Концентрация всех веществ, вводимых в ХЛ-ячейку, 1мМ, объем 1мкл.
 |
Рисунок 2. Кинетические кривые ХЛ для двух моделей окисления люминола с инициатором «Hb— H2O2» (а) и «АБАП» (б). Здесь: кривая 0 – холостая проба, ф – фенозан, м – мексидол, рядом с буквами – вводимый в ячейку объем АО в мкл. Концентрация обоих АО 1мМ.
Период индукции ХЛ в присутствии АО можно рассматривать как время, необходимое для их инактивации в процессе взаимодействия с образующимися в системах радикалами-инициаторами. Тролокс, АК и МК ведут себя как сильные АО, а их ХЛ кривые похожи для обеих систем, глутатион же, являясь слабым АО, не подавляет свечение полностью и не имеет выраженного периода индукции. В случае мексидола и фенозана у двух ХЛ моделей имеются отличия: ингибирование фенозаном окисления люминола, инициированное в системе с АБАП, значительно сильнее, а для мексидола тушение ХЛ примерно одинаково для обеих систем.
На рис. 3 представлены зависимости периода индукции t от концентрации АО для обеих ХЛ моделей. В исследуемом диапазоне концентраций эта зависимость линейна t=k[AO], и k определяет антирадикальную активность АО.
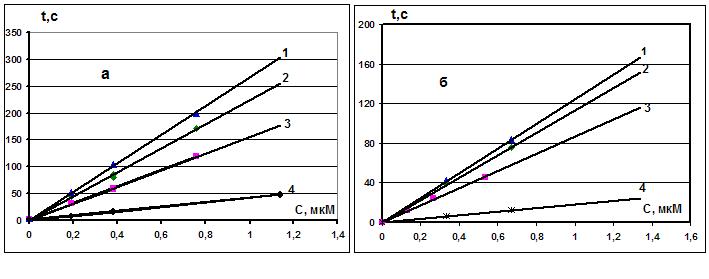 |
Рисунок 3. Зависимость периода индукции (t) от концентрации АО в ХЛ-ячейке для двух ХЛ окислительных систем с «Hb-H2O2» (а) и «АБАП» (б). Прямые 1 – МК, 2 – тролокс, 3 – АК, 4 – глутатион.
Для мексидола и фенозана были построены концентрационные зависимости степени угнетения максимальной интенсивности ХЛ (I0/I) по сравнению с холостой пробой I0 и вычислен коэффициент уменьшения амплитуды ХЛ К=(I0/I-1)/[AO]. В таблице представлены значения k и К для всех исследованных АО, а также их стехиометрические коэффициенты ингибирования n (число радикалов, перехваченных АО) для двух ХЛ моделей. Для тролокса был принят n=2 для обеих моделей [3, 7, 15].
Таблица
Антирадикальная активность (k), коэффициент ингибирования амплитуды ХЛ (К) и стехиометрические коэффициенты (n) для двух окислительных моделей с «Hb-H2O2» и «АБАП» инициаторами.
|
АО |
k, с∙М-1 |
К, М-1 |
n |
|||
| Hb-H2O2 | АБАП | Hb-H2O2 | АБАП | Hb-H2O2 | АБАП | |
| Тролокс | 2,23∙108 | 1,13∙108 | — | — | 2,0 | 2,0 |
| МК | 2,65∙108 | 1,25∙108 | — | — | 2,37±0,16 | 2,22±0,11 |
| АК | 1,55∙108 | 0,87∙108 | — | — | 1,39±0,14 | 1,54±0,08 |
| Глутатион | 4,21∙107 | 1,82∙107 | — | — | 0,38±0,06 | 0,33±0,04 |
| Мексидол | — | — | 8,5∙104 | 3,4∙104 | — | — |
| Фенозан | — | — | 5,2∙104 | 7,7∙105 | — | — |
Самая высокая степень ингибирования окисления люминола (К) оказалась у фенозана в модели с АБАП, значительно (~ в 20 раз) превышая К для мексидола. Для первой модели разница К для этих двух АО не такая значительная (~1,5). Что касается стехиометрического коэффициента n, для МК, АК и глутатиона в пределах ошибки эксперимента он практически одинаков для обеих окислительных систем. Стехиометрические коэффициенты для тролокса, МК, АК, определялась многими авторами [3, 7, 15]. Наиболее близкие к нашим значениям величины n получены в работе [15] для модели с АБАП-инициатором. В этой же работе было измерено также n=0,44 для соединений SH-групп, однако кинетика ХЛ исследована не была. Как уже было отмечено ранее, кинетические ХЛ кривые для глутатиона в обоих методах (рис. 1) резко отличаются от ХЛ кривых для других АО, не имея хорошо выраженного периода индукции. Это свидетельствует о том, что глутатион взаимодействует с образующимися в процессе окисления промежуточными интермедиатами, меняя скорость и кинетику окисления. Как показано в работе [8], некоторые тиильные соединения, включая глутатион, могут восстанавливать образующиеся при окислении гидропероксиды (LOOH), и это восстановление может проходить через радикальные стадии RSH+LOOH → RS·+RO·+H2O, образуя дополнительный источник радикалов и меняя процесс ингибирования. Для первой нашей модели этим гидропероксидом, вероятно, служит H2O2, а для второй – генерируемые азоинициатором пероксидные радикалы. Поэтому период индукции и, соответственно, n для глутатиона имеют относительно низкие значения для обеих ХЛ систем.
Для тролокса, МК и АК небольшой разброс стехиометрических коэффициентов связан, вероятно, со сходством структуры молекул и мало различающейся энергией связи атома водорода в ОН-группах.
Мексидол и фенозан калия являются, как и большинство монофенолов, слабыми ингибиторами. Как и в моделях цепного окисления углеводородов, при генерации свободных радикалов в системе с АБАП экранирование OH-группы (фенозан) приводит к существенному повышению эффективности АО по сравнению с неэкранированным фенолом. Трет-бутильные заместители в орто-положении, с одной стороны, препятствуют участию образующегося феноксильного радикала в дальнейшем инициировании свободнорадикальных реакций, а с другой стороны, повышают электронную плотность на OH-группе, снижая энергию ее диссоциации. При инициировании окисления люминола системой «Hb-H2O2» отсутствие такого эффекта, возможно, свидетельствует о том, что с радикалами, образующимися в этой системе (О2·—, ОН·, феррилрадикал), неэкранированный фенол реагирует с больше скоростью, нежели экранированный.
Таким образом, для ряда сильных АО (тролокс, аскорбиновая и мочевая кислоты) значения АОА и стехиометрических коэффициентов ингибирования оказались не зависящими от способа генерации радикалов в модельных системах, основанных на ХЛ люминола, и близкими по значению к данным, полученным с помощью других методов. Синтетические АО-монофенолы (мексидол, фенозан), как и большинство подобных соединений, не подавляют свечение полностью, а только снижают его интенсивность; при этом соотношение ингибирующей активности этих соединений находится в сильной зависимости от выбранной системы генерации радикалов. Данные по кинетике хемилюминесценции и коэффициентах ингибирования исследованных АО, полученные в настоящей работе на двух ХЛ моделях с разными моделями инициирования окисления, помогут в интерпретации результатов измерения АОА различных биологических субстанций в медико-биологических исследованиях.
Список литературы:
- Bartosz G. Non-enzymatic antioxidant capacity: limitations of use in biomedicine.//Free Radical Research. 2010. V. 44. pp. 711-720.
- Бурлакова Е.Б., Сторожок Н.М., Храпова Н.Г. Изучение суммарной активности природных антиоксидантов хемилюминесцентным методом // Биофизика. — 1988. — Т. 33, № 4. — c. 584-588.
- Bastos E.L., Romoff P., Eckert C.R., Baader W.J. Evaluation of Antiradical Capacity by H2O2-Hemin-Induced Luminol Chemiluminescence // J. Agric. Food Chem. 2003. V. 57. pp. 7481-7488.
- Беляков В.А., Васильев Р.Ф., Федорова Г.Ф. Кинетика окси-хемилюминесценции и ее использование для анализа антиоксидантов. //Кинетика и катализ. 2004. Т.45. №3. с. 355-362.
- Karadag A., Ozxelik B., Saner S. Review of Methods to Antioxidant Capacities. //Food Anal. Methods. 2009. N.2. pp. 41-60.
- Клебанов Г.И., Теселкин Ю.О., Бабенкова И.В., Любицкий О.Б., Владимиров Ю.А. Антиоксидантная активность сыворотки крови. // Вестник РАМН. 1999. №2. с.15-22.
- Lissi E.A., Salim-Hanna M., Pascual C., Castillo M. D. Evaluation of total antioxidant potencial (TRAP) and total antioxidant reactivity from luminol-enchanced chemiluminescence measurement. Free Radic. Biol. Med. 1995. V. 18. N. 2. pp. 153-158.
- Менгеле Е.А., Круговов Д.А., Касаикина О.Т. «Влияние меркаптоэтанола на окисление углеводородов и цис—транс-изомеризацию ненасыщенных липидов» // Известия Академии наук. Серия химическая. 2015. №4. с. 1-6.
- Niki E.: Free Radical Initiators as Source of Water- or Lipid-Soluble Peroxyl Radicals. METHODS IN ENZYMOLOGY. Eds. L. Packer & A.N. Glazer. Academic Press. NY, 1990. V. 186. pp. 100-108.
- Popov I., Lewin G.: Antioxidative homeostasis, its evaluation by means of chemiluminescent methods. In: Handbook of chemiluminescent methods in oxidative stress assessment. (Eds. I. Popov and G. Lewin), Transworld Research Network, Kerala, 2008, pp. 361-391.
- Pinchuk I., Shoval H., Dotan Y., Lichtenberg D. Evaluation of antioxidants: Scope, limitations and relevance od assays. // Chemistry and Physics of Lipids. 2012. V. 165. pp. 638-647.
- Roginsky V., Lissy E. Review of methods to determine chain-breaking antioxidant activity in food // Food Chemistry. 2005. V. 92. pp. 235-254.
- Русина И.Ф., Карпухин О.Н., Касаикина О.Т. Хемилюминесцентные методы в исследовании ингибированного окисления. // Химическая физика. 2013. Т. 32. №8. с. 1-15.
- Теселкин Ю.О., Бабенкова И.В., Любицкий О.Б., Клебанов Г.И., Владимиров Ю.А.: Ингибирование сывороточными антиоксидантами окисления люминола в присутствии гемоглобина и пероксида водорода. // Вопросы медицинской химии. 1997. Т. 43. №2. c. 87-93.
- Uotila J.T., Kirkkola A.L., Rorarius M. et al. The total peroxyl radical-trapping ability of plasma and cerebrospinal fluid in normal and preeclamptic parturients // Free Radic. Biol. Med. 1994. V. 16, N. 5. pp. 581-590.[schema type=»book» name=»ИССЛЕДОВАНИЕ АНТИОКСИДАНТНЫХ СВОЙСТВ И СТЕХИОМЕТРИИ НЕКОТОРЫХ БИОАНТИОКСИДАНТОВ ДВУМЯ ХЕМИЛЮМИНЕСЦЕНТНЫМИ МЕТОДАМИ» description=»Определены антиоксидантная активность (АОА) и стехиометрические коэффициенты некоторых биоантиоксидантов двумя хемилюминесцентными (ХЛ) методами с разными моделями генерации свободных радикалов: «гемоглобин — перекись водорода — люминол» и «АБАП — люминол» с целью выяснения зависимости этих параметров от способа генерации радикалов. Обнаружены различия кинетики ХЛ в этих моделях и значений АОА для глутатиона и фенозана, что объясняется строением их молекул и особенностями систем генерации радикалов.» author=»Сажина Наталья Николаевна, Попов Игорь Николаевич, Волков Владимир Анатольевич» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-03-11″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_30.05.2015_05(14)» ebook=»yes» ]

