Проблема разделения смесей и выделения полезных компонентов из растворов в настоящее время имеет большое значение. Это связано, в первую очередь, с постоянно увеличивающимися потребностями атомной, нефтяной и фармацевтической промышленности, металлургии цветных и редких металлов [2].
К одним из самых доступных, эффективных и широко применяемых способов разделения смесей относится экстракция. Раньше ее широко использовали для извлечения йода и его соединений из водных растворов. Однако ввиду того, что большое количество углеводорода улетучивается вместе с рафинатом, от этого метода пришлось практически отказаться. Следовательно, важной задачей стало подобрать эффективный экстрагент и оптимальные условия проведения процесса [3].
Целью данной работы являлось исследование влияния pH водной фазы на равновесные параметры процесса экстракции йода.
В экспериментальной работе были использованы растворы йода с различными уровнями pH, значение которых достигалось путем подкисления их раствором соляной кислоты с концентрацией 1 моль/л.
В качестве экстрагента применяли 10% раствор ТБФ в изооктане. Трибутилфосфат относится к нейтральным экстрагентам, способным к образованию координационных связей с извлекаемым ионом, более прочных, чем связи молекул воды [1].
Экстракцию проводили из модельных бессолевых растворов йода. Определение остаточной концентрации йода в рафинате проводили методом объемного анализа с сантимолярным раствором тиосульфата натрия.
Для определения коэффициента распределения, степени извлечения и коэффициента разделения было изучено равновесие процесса экстракции раствора йода с концентрацией от 83 до 164 мг/л в интервале значений рН от 1 до 3.
На рисунке 1 представлена изотерма экстракции йода из исследуемой системы при рН=1,09.
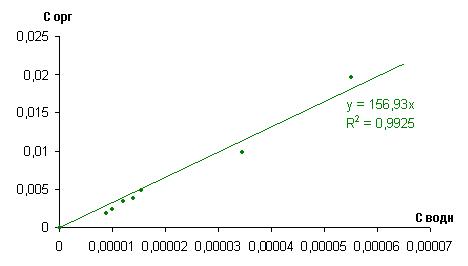
Рисунок 1. Изотерма экстракции йода из смеси 10% ТБФ в изооктане при pH=1,09
Для определения степени ассоциации в экстрагируемых комплексах используют билогарифмические зависимости концентраций извлекаемого компонента в экстракте и рафинате.
Для рН=1,09 билогарифмические зависимости представлены на рисунке 2.

Рисунок 2. Билогарифмическая зависимость концентраций водной и органической фаз при pH=1,09
Из рисунков 1 и 2 видно, что коэффициент распределения D, равен 156,93, а степень ассоциации 1,1814.
По аналогичной методике было исследовано равновесие экстракции при рН=2.09 для раствора с концентрацией йода 164,211мг/л.
Изотерма экстракции и билогарифмические зависимости представлены на рисунках 3 и 4.
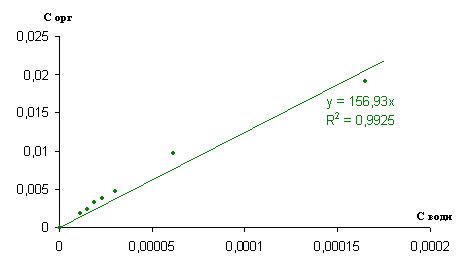
Рисунок 3. Изотерма экстракции йода из смеси 10% ТБФ в изооктане при pH=2,09
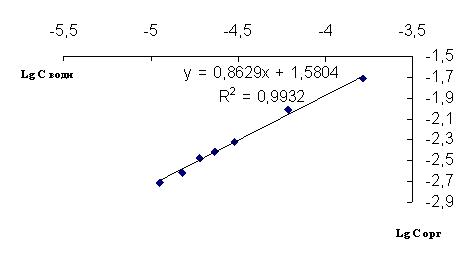
Рисунок 4. Билогарифмическая зависимость концентраций водной и органической фаз при pH=2,09
Полученные зависимости позволяют определить коэффициент распределения для данной системы, равный 156,93 и степень ассоциации 0,8642.
При экстракции раствора йода, при pH=2,98 и концентрации 123,19 мг/л, наблюдается аналогичный коэффициент распределения, что и в предыдущих случаях, равный 156,93 (рисунки 5 и 6).
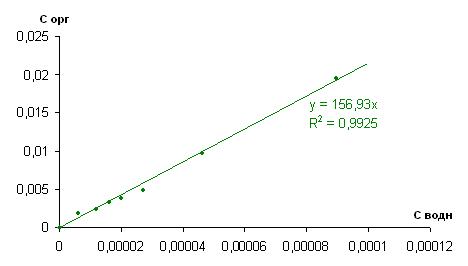
Рисунок 5. Изотерма экстракции йода из смеси 10% ТБФ в изооктане при pH=2,98

Рисунок 6. Билогарифмическая зависимость концентраций водной и органической фаз при pH=2,98
Полученные данные позволяют сделать вывод о том, что изменение pH водной среды в растворе с бессолевым фоном в данной смеси экстрагентов не оказывает влияния на коэффициент распределения (таблица 1).
Таблица 1
Равновесные параметры экстракции для растворов с различными уровнями
pH
| pH | D | n |
R |
| 1,09 | 156,93 | 1,1814 | 98,625 |
| 2,09 | 156,93 | 0,8642 | 95,8875 |
| 2,98 | 156,93 | 0,8996 | 97,7625 |
Следовательно, можно сделать вывод о том, что для улучшения процесса экстракции недостаточно изменять только pH среды. Для повышения эффективности процесса необходимо наряду с изменением уровня pH изменять концентрацию фоновых солей, выбирать другие экстрагенты, менять температуру процесса. В связи с этим в дальнейшем планируется продолжить работу по данному направлению и подобрать оптимальные условия проведения процесса экстракции йода.
Список литературы:
- Вольдман Г. В., Зеликман А. Н. Теория гидрометаллургических процессов: Учеб пособие для вузов. – 4-е изд., перераб. и доп. М.: Интермет Инжиниринг, 2003 – 464 с.
- Мазуренко Е. А. Справочник по экстракции. Киев: «Технiка», 1972 – 448 с.
- Пономарева П. А. Определение термодинамических параметров экстракции йода ТБФ в смеси с изооктаном из высокоминерализованных растворов. Вестник ОГУ. 2011. №6. С. 419-420.[schema type=»book» name=»ЗАВИСИМОСТЬ РАВНОВЕСНЫХ ПАРАМЕТРОВ ЭКСТРАКЦИИ В СИСТЕМЕ I2-ТБФ-ИЗООКТАН ОТ pH ВОДНОЙ ФАЗЫЗАВИСИМОСТЬ РАВНОВЕСНЫХ ПАРАМЕТРОВ ЭКСТРАКЦИИ В СИСТЕМЕ I2-ТБФ-ИЗООКТАН ОТ pH ВОДНОЙ ФАЗЫ» author=»Королева Екатерина Витальевна, Хакимова Диана Ильдаровна, Пономарева Полина Александровна» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-05-02″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_ 28.03.2015_03(12)» ebook=»yes» ]

