В работе использовали поверхностно-активное вещество — представляющее собой молекулы с ионогенной функциональной группой и органическим радикалом с большим числом атомов углерода – додецилсульфат натрия (NaDS).
В процессе флотоэкстракции поверхностно-активное вещество (ПАВ) взаимодействует с неорганическим ионом (катионом металла) и, образующийся сублат удаляется из раствора на поверхности пузырька в органическую фазу — изо-октанол. Коэффициент распределения Sm (III) определяется по формуле:
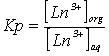 (1),
(1),
где Ln+3org и Ln+3aq – концентрация Sm (III) соответственно в органической и водной фазах [1,2].
Содержание NaDS в водной фазе определялось потенциометрическим титрованием с использованием ионоселективного электрода [3].
В качестве титранта использовали раствор цетилтриметиламмония хлорида концентрацией 0,002 моль/кг.
Экспериментальные данные, полученные в процессе флотоэкстракции по зависимости Kраспред. Sm +3 от значения рН раствора, свидетельствуют о том, что в кислой среде извлечение РЗМ практически не наблюдается, так как согласно значению константы диссоциации додецилсерной кислоты, равному 1,7·10-6 [4], при рН<4,77 додецилсульфат на 90% находится в растворе в молекулярной форме и слабо взаимодействует с катионами металлов.
Таблица 1
Степень извлечения α и коэффициент распределения самария (III) от времени процесса и С0 = 0,001 моль/кг
| pH | C org | Сaq·104 | Kp | a % |
| 5,1 | 0,0135 | 6,6 | 20,5 | 33,9 |
| 6,1 | 0,0141 | 6,3 | 21,9 | 35,4 |
| 6, 9 | 0,0314 | 2,1 | 146,3 | 78,5 |
| 8,0 | 0,0392 | 0,2 | 2222,3 | 98,2 |
| 9,9 | 0,0374 | 0,7 | 577,0 | 93,5 |
На начальной стадии процесса (5-10 минут) удаление ионов самария происходит намного интенсивнее, чем при дальнейшем флотировании. Таким образом, можно найти оптимальное время проведения процесса флотоэкстракции в растворах нитрата самария с начальной концентрацией 0,001 моль/кг. Оно составляет в зависимости от рН раствора от 15 мин. и более. Кинетические кривые процесса флотоэкстракции показывают, что максимальное извлечение ионов самария происходит при рН = 8,0 в течение 30 минут. С течением времени концентрация ионов самария асимптотически приближается к некоторому конечному значению, что характерно для прихода системы в стационарное состояние [5,6].
Кинетические зависимости, представленные на рис. 1, могут быть описаны уравнениями реакции первого порядка, что соответствует теории Познера и Александера [7].
Константы скорости были вычислены по уравнению:

Результаты вычислений приведены в таблице 2.
Таблица 2
Стационарные концентрации самария в водной фазе и константы скорости флотоэкстракции в зависимости от рН
|
рН |
Сeq, моль×л-1·104 |
k, мин-1 |
| 5,1 | 6,60 | 0,007 |
| 6,1 | 6,30 | 0,006 |
| 6,9 | 2,10 | 0,022 |
| 8,0 | 0,17 | 0,760 |
| 8,9 | 0,70 | 0,033 |
Первый порядок процесса флотоэкстракции свидетельствует о протекании его в режиме стационарной диффузии, при котором лимитирующей стадией является диффузия извлекаемых частиц в слое Штерна у поверхности пузырьков газа. Адсорбция извлекаемых частиц на границе раствор-воздух описывается адсорбционной моделью Штерна, в рамках которой адсорбция происходит на определенной площади в мономолекулярном слое [8].
Работа выполнена согласно государственному заданию Минобрнауки России по проекту № 982 «Развитие термодинамической и кинетической теории межфазного ионного обмена применительно к природным и промышленным объектам» от 11.06.2014 г.
Литература:
- Lu Y., Zhu X. Solvent sublation: theory and application//Separation and Pyrification Methods. — 2001. — V. 30. — N. 2. — P. 157-189.
- C.Б. Саввин./ Арсеназо III.: Атомиздат. — 1966. — С. 265.
- С.В. Тимофеев, В.А. Матерова, Л.К. Архангельский // Вестник ЛГУ.- Серия физика, химия. 1978.- № 16.- Вып. 3. — С. 139-141.
- Д.Э. Чиркст, О.Л. Лобачева, И.В. Берлинский. //ЖПХ. — 2009. — № 8.- Т.82.-С. 1273-1276. (D.E. Chirkst, O.L. Lobacheva, I.V. Berlinskiy//Russian Journal of Applied Chemistry. 2009. V. 82. N 8. P. 1370—1374.)
- Adsorptive bubble separation techniques / R.Lemlich. — 1972.- Academic Press. N-Y., London — 53-59 Р.
- L. Lobacheva. Application of solvent sublation for the removal of trace elements in wasterwater //Technische universitat bergakademie Freiberg, Wissenschaftliche Mitteilungen. — V.35. — p.163-166, 2008.
- Posner A.M., Alexander A.E. The kinetics of adsorption from solution to air/water interface. // J. Colloid Sci. — 1953. — V. 8. -No. 6. – p. 125-131.
- Smith J.S., Valsaraj K.T. The promise of Solvent Sublation// Chem. Eng. Progress. — 1998. — V.94. — N. 5. — p.69-76.[schema type=»book» name=»ФЛОТОЭКСТРАКЦИЯ ИОНОВ САМАРИЯ ИЗ РАЗБАВЛЕННЫХ ВОДНЫХ РАСТВОРОВ» author=»Лобачева Ольга Леонидовна» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-05-06″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_ 28.02.2015_02(11)» ebook=»yes» ]

