Реакция выделения водорода (РВВ) из кислых растворов на различных металлах является в электрохимии наиболее изученной [11, с. 703-714; 12, 867 с.; 14, 336 с.; 19, с. 628-636]. Кинетические закономерности этой реакции определяют условия и эффективность получения водорода, часто обусловливают коррозионные разрушения металлов как за счёт поражения их поверхности (общая и локальная коррозия), так и абсорбции водорода, ведущей к охрупчиванию с существенной потерей механических свойств.
Целый ряд вопросов, определяющих кинетику РВВ, изучен очень слабо, хотя во многом является определяющим. В частности, по существу только началось исследование роли растворителя в кинетике РВВ [4, с. 745-752; 7, 624 с.; 12, 867 с.; 13, 319 с.].
Вместе с тем, из экспериментальных результатов следует на существенное влияние природы индивидуального и состава смешанного растворителя на перенапряжение водорода (hH) при постоянстве материала катода. Указывается, в частности, на снижение hH при замене воды метанолом на Вi [10, с. 826-830], этанолом на Ni [9, с. 826-830] и Fe [2, с. 1437-1445; 16, 192 с.],- этиленгликолем (на Нg [1, 179 с.] и Fe [3, с.1480-1487]).
Показано, что изменение сольватной формы протона при переходе от водных к спиртовым средам (C2H4(OH)2, C2H5OH) не сказываются на природе лимитирующей стадии РВВ [4, с. 745-752]. Таким образом, в этих процессах природа адсорбированных молекул растворителя или их соотношения (бинарные среды) играют определяющую роль.
Принципиальное значение имеет вопрос роли растворителя в диффузии водорода в металл и его абсорбции твёрдой фазой. Принято считать, что поток твердофазной диффузии, при прочих равных условиях, определяется степенью заполнения адсорбированным водородом ΘН активных центров поверхности металла [12, 867 с.]. Исходя из этих представлений, переход от замедленной стадии разряда на углеродистой стали в водных хлоридных средах к замедленной рекомбинации (этиленгликолевые растворы НСl с 10 масс.% Н2О) должен привести к существенному возрастанию потока твердофазной диффузии водорода iH. Однако, это наблюдается далеко не всегда [3, с. 1480-1487; 4, с. 745-752; 7, 624 с.]. Более того, в ряде случаев повышение hH ведёт одновременно к возрастанию iH, либо часто никак не сказывается на его величине [4, с. 745-752; 7, 624 с.].
Подобная ситуация связана с наличием на металлах нескольких форм адсорбированного водорода [3, с. 1480-1487; 5, с. 843-850; 6, 328 с.; 15, с. 11-103; 17, с. 1240-1246]. Существует надповерхностный (Нr) и подповерхностный (Hs) адсорбированный водород. Постулируется, что первая форма определяет кинетику реакции выделения водорода, вторая — его твердофазную диффузию [3, с. 1480-1487; 4, с. 745-752; 13, 319 с.]. Соотношение этих форм, находящихся в равновесии, определяемом статистической суммой состояний системы и его смещением в ту или другую сторону, определяет соотношение вкладов РВВ и абсорбции в металл в суммарный сток адсорбированного водорода. Естественно в подобных условиях наличие стимуляторов и ингибиторов наводороживания, способных адсорбироваться на активных центрах поверхности металла, может влиять на сдвиг указанного равновесия [4, с. 745-752].
Представляет интерес в этом отношении исследование влияния гуанидина (молекулярная формула (H2N)2СNH), являющегося одним из наиболее сильных однокислотных оснований с рКа протонированной формы равным, по одним данным 13,6 [8, с. 668-671], по другим — 11 [8, с. 668-671]. Однако, независимо от указанных выше величин рКа гуанидин в кислых средах полностью протонируется [18, с. 135-182]. Вместе с тем, гуанидиний-катион, видимо адсорбируется на поверхности железа и углеродистой стали, так как в его присутствии возрастает поток твердофазной диффузии водорода в металл [18, с. 135-182]. Одновременно наличие и рост концентрации катиона гуанидиния (0,5 – 10 мМ) не изменяет в водных растворах НСl природы замедленной стадии РВВ на железе, которой является разряд.
В развитие этих представлений в настоящей работе проведены подробные исследования в этиленгликолевых растворах НСl, содержащих 10 масс.% Н2О, когда в спиртовой среде замедленной стадией РВВ на железе является реакция рекомбинации адсорбированного водорода [3, с. 1480-1487; 4, с. 745-752].
Таким образом, удаётся получить ответ сразу на несколько вопросов: как влияет в присутствии гуанидина природа замедленной стадии на величину iH? Сказывается ли наличие гуанидина и его концентрации на природу замедленной стадии? Существует ли связь в изучаемых условиях между кинетическими параметрами РВВ, Сгуанидина и потоком твердофазной диффузии водорода.
Методика эксперимента
Кинетика реакции выделения водорода изучена на железе «армко», армированном в оправку из эпоксидной смолы ЭД-5, отверждённой полиэтиленполиамином. Площадь рабочего электрода 1 см2, противоэлектрод-гладкая платина. Измерения проведены в двух экспериментальных сериях: в одной использован насыщенный хлоридсеребряный электрод сравнения, во второй — равновесный водородный электрод в рабочем растворе. Первый электрод приводит к возникновению потенциала жидкостной границы этиленгликоль-вода, второй ведёт к зависимости потенциала электрода сравнения от кислотности рабочего раствора, но позволяет непосредственно оценить величину перенапряжения водорода, определяющего плотность внешнего поляризующего тока. Для приготовления смешанного растворителя, содержащего 10 масс.% воды использован этиленгликоль с исходной концентрацией воды порядка 0,2 масс.%, вода – бидистиллят. Растворитель насыщали сухим хлористым водородом с последующим титрованием щёлочью в присутствии фенолфталеина и дальнейшим доведением до заданной концентрации НСl исходным бинарным растворителем. Затем вводили хлористый литий, высушенный при 105 — 110 0С до достижения ионной силы раствора равной единице. В остальном методика проведения поляризационных измерений, как и изучения диффузии водорода через стальную мембрану (сталь Ст3) не отличалась от описанной в [18, с. 135-182].
Экспериментальные результаты
В фоновых растворах зависимости в координатах E, lgi, как и следовало ожидать, передаются уравнениями прямой линии (участок АВ), которая искривляется (участок ВС) при переходе к области смешанного кинетико -диффузионного контроля (рис. 1а). Величина тафелевского наклона составляет 0,120 ± 0,010 мВ, что удовлетворительно согласуется с данными [3, с. 1480-1487]. Протяженность тафелевского участка снижается по мере уменьшения кислотности среды за счёт соответствующего изменения предельного катодного тока iпред., обусловленного, видимо, диффузионными ограничениями по ионам водорода.
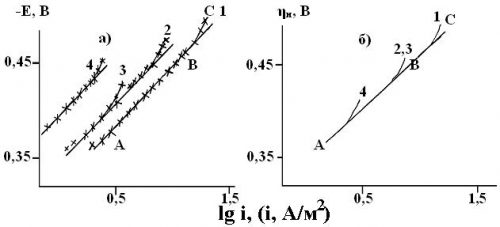
Рисунок 1. Зависимость скорости реакции выделения водорода на железе от потенциала электрода (а), перенапряжения водорода (б) и кислотности среды в фоновых этиленгликолевых растворах(10 масс.% Н2О) с составом электролита х М НСl + (1 — х) М LiCl, х, моль/л: 1 — 0,99; 2 — 0,50; 3 — 0,10; 4-0,05. Комнатная температура, водородная атмосфера.
В этиленгликолевых средах при СН+= const его величина существенно понижена по сравнению с водными в результате повышения кинематической вязкости почти на порядок [3, с. 1480-1487], хотя протон существует в той же сольватной форме (Н3О+), что и в чисто водных средах. Это обусловлено пересольватацией протона в силу основных свойств воды по отношению к этиленгликолю по реакции
С2Н4(ОН)2Н+ + Н2О = Н3О+ + С2Н4(ОН)2, (1)
равновесие которой практически нацело смещено вправо. Скорость РВВ возрастает при постоянном потенциале((dlgik/dlgCH+) > 0) в соответствии с требованиями электрохимической кинетики (ik — плотность катодного тока). Кинетические параметры РВВ приведены в таблице 1. При постоянном перенапряжении скорость реакции выделения водорода не зависит от кислотности среды, что вновь удовлетворительно согласуется с данными [3, с. 1480-1487]. Прежней остаётся и величина тафелевского наклона катодной поляризационной кривой (рис. 1б), на которой отклонения от линейной зависимости (участок ВС) вновь обусловлены появлением диффузионных ограничений подвода ионов гидроксония.
Таблица 1.
Кинетические параметры РВВ на железе в присутствии гуанидина в этиленгликолевых растворах, содержащих 10 масс.% Н2О с составом электролита х М НCl + (1 — x) M LiCl (водородная атмосфера, комнатная температура, неподвижный электрод).
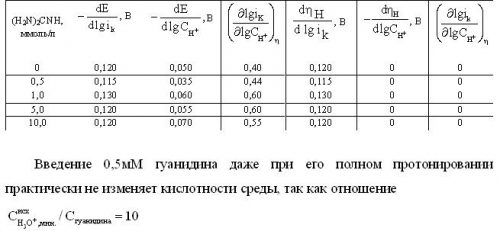
В присутствии гуанидина (H2N)2СNH или, точнее, его протонированной формы (H2N)2СNH2+, характер поляризационных кривых практически остаётся прежним (рис. 2).
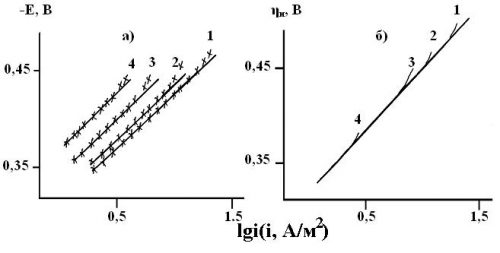
Рисунок 2. Зависимость скорости РВВ на железе от потенциала электрода (а), перенапряжения водорода и кислотности среды в этиленгликолевых растворах, содержащих 10 масс.% Н2О и 0,5мМ гуанидина с составом электролита х М НСl + (1 — х) М LiCl, х, моль/л: 1 — 0,99; 2 — 0,50; 3 — 0,10; 4 — 0,05. Комнатная температура, водородная атмосфера.
Вновь при Е = const величины (dlgik/dlgCH+) > 0, и (dlgik/dlgCH+) = 0 (рис. 2б). Не меняется и характер связи длины тафелевского участка с концентрацией ионов водорода. Кинетические параметры процесса приведены в таблице 1. Подобные данные получены в растворах с концентрацией гуанидина 0,5; 1; 5 и 10 мМ. Помимо рис.2 приведём результаты, наблюдаемые при максимальном содержании (H2N)2СNH (рис. 3), так как в промежуточной области его концентраций картина остаётся качественно той же и не несёт дополнительной информации. Вновь, как и в предыдущих случаях, на поляризационных кривых, легко фиксируются линейные тафелевские участки достаточно протяжённые, что позволяет проводить кинетический анализ процесса (таблица).

Рисунок 3. Зависимость скорости РВВ на железе от потенциала электрода (а), перенапряжения водорода и кислотности среды в этиленгликолевых растворах, содержащих 10 масс.% Н2О и 10 мМ гуанидина с составом электролита х М НСl + (1 — х) М LiCl, х, моль/л: 1 — 0,99; 2 — 0,50; 3 — 0,10; 4 — 0,05. Комнатная температура, водородная атмосфера.
Учитывая, что в присутствии 10 масс. % воды равновесие (1) практически нацело сдвинуто вправо, в фоновых растворах, не содержащих гуанидина, стадия разряда имеет вид:
Н3О+ + е Надс + Н2О (2)
Однако за счёт образования ионов гуанидиния по реакции:
(H2N)2СNH + Н+ → (H2N)2СNH2+
возможен параллельно катодный процесс:
(H2N)2СNH2+ + е Надс + (H2N)2СNH (3),
так же ведущий к появлению адсорбированного атомарного водорода (ij характеризует скорость соответствующей стадии).
Если i2 >> i3 или i3 → 0, то кинетика посадки Надс определяется практически исключительно стадией (2). Именно такая картина реализуется в водных растворах HCl, содержащих до 10 мМ гуанидина [18, с.135-182]. В этом случае совпадает положение катодных поляризационных кривых, полученных в фоновых растворах и в средах, содержащих до 10 ммоль/л гуанидина. Однако, переход к растворителю принципиально иной природы (C2H4(OH)2 +
10 масс.% Н2О) может существенно изменить ситуацию, что и наблюдается экспериментально. С ростом концентрации гуанидина существенно возрастает скорость катодной реакции. Это становится особенно заметно в присутствии 5 и 10мМ (H2N)2СNH.
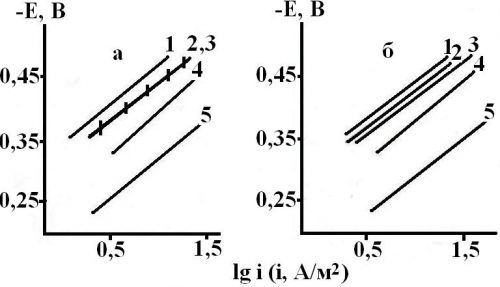
Рисунок 4. Влияние концентрации гуанидина на скорость катодного выделения водорода на железе из этиленгликолевых растворов с 10 масс.% Н2О и составом электролита х М НСl + (1 — х) М LiCl, с х, равным 0,5 (а) и
0,99 (б). Сгуанидина, моль/л: 1 – отсутствует, 2 – 0,5; 3 – 1,0; 4 – 5,0; 5 – 10,0. Водородная атмосфера, комнатная температура.
Так, в присутствии 5 ммоль/л гуанидина скорость катодной реакции возрастает в 3,2 раза, 10 ммоль/л (H2N)2СNH доводят эту разницу до ≈ 16 раз. Наличие уже 0,5 ммоль/л его приводит к увеличению скорости катодного процесса в 1,3…1,5 раза в зависимости от кислотности среды. При этом порядки реакции по гуанидину также изменяются с СHCl, возрастая по мере увеличения концентрации ионов водорода, хотя эти различия и не велики (таблица 2). Однако тенденция прослеживается достаточно достоверно.
Таблица 2.
Влияние концентрации хлористого водорода на порядок катодной реакции по гуанидину на железе в этиленгликолевых растворах HCl (10 масс.% Н2О) с постоянной ионной силой, равной 1.
|
СН+, моль/л |
(dlgik/dlgCгуанидина)Сн+ |
| 0,10 | 0,6 |
| 0,50 | 0,7 |
| 0,99 | 0,8 |
Вместе с тем, кинетические параметры катодного процесса при введении гуанидина и возрастании его концентрации до 10 ммоль/л не изменяется (таблица 1).
Влияние СН+ и Сгуанидина на скорость диффузии водорода через стальную мембрану отличается от воздействия этих факторов на кинетику катодной реакции. Суть различий в следующем. В области кислотности среды (0,05 – 0,50 моль/л HCl) её возрастание на порядок в фоновых растворах увеличивает поток диффузии водорода через мембрану не более чем на 20 %, а последующий рост СHCl в 2 раза повышает величину iH в 3 раза. Это плохо коррелирует с величиной dlgik/dlgCН+, хотя порядки катодной реакции и диффузии водорода через мембрану по CН+ положительны (рис. 5). Ещё большие различия наблюдаются во влиянии концентрации гуанидина на величины ik и iH. Если первая систематически возрастает с повышением Сгуанидина (рис. 4), то вторая резко увеличивается лишь в области малых его концентраций (участок АВ), затем вообще перестаёт зависеть от содержания ионов гуанидиния во всём изученном его концентрационном интервале (участок ВС, рис. 5), либо в его части (отрезок ВС, кривые 2 и 3, рис. 5). Затем возможен некоторый рост с повышением Сгуанидина, но значение ΔiH часто весьма незначительно (рис. 5).
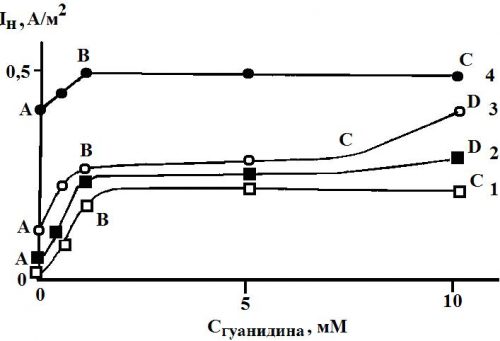
Рисунок 5. Зависимость потока диффузии водорода через стальную (Ст3) мембрану при потенциале коррозии с входной стороны при концентрации НСI, моль/л: 1 — 0,05; 2 — 0,10; 3 — 0,50; 4 — 0,99. Водородная атмосфера, комнатная температура.
Влияние концентрации ионов гидроксония или гуанидиния (в присутствии (H2N)2СNH) нельзя связать с изменением потенциала коррозии входной стороны стальной мембраны. Это заключение базируется на следующем. Рост кислотности раствора на 1,5 порядка увеличивает Екор. железа и углеродистой стали на 0,03…0,04 В, что связано с повышением скорости катодной реакции (таблица 1). Однако, при величине тафелевского наклона порядка 0,120 В наблюдаемый рост ik, связанный с изменением Екор., должен сказываться гораздо слабее, чем это имеет место экспериментально.
Повышение же Сгуанидина ведёт к возрастанию ik с порядком, близким к 1 (таблица 2), однако, это вообще не влияет на величину Екор.
Таблица 3.
Потенциалы коррозии железа армко в этиленгликолевых средах с содержанием 10 масс.% воды при различных концентрациях гуанидина и кислотности среды.
|
Сгуанидина, мМ |
-Екор, В при СНСl, моль/л |
|||
| 0,05 | 0,1 | 0,5 | 0,99 | |
| 0 | 0,240 | 0,220 | 0,215 | 0,205 |
| 0,5 | 0,240 | 0,225 | 0,210 | 0,210 |
| 1 | 0,245 | 0,225 | 0,210 | 0,210 |
| 5 | 0,250 | 0,230 | 0,210 | 0,210 |
| 10 | 0,245 | 0,230 | 0,205 | 0,210 |
Обсуждение
Кинетические параметры РВВ, наблюдаемые при постоянных потенциале (хлоридсеребряный электрод сравнения) и перенапряжении (водородный электрод сравнения), позволяют считать, что в исследуемых условиях замедленной является стадия рекомбинации (таблица 1). Это полностью коррелирует с результатами, полученными в [3, с. 1480-1487; 4, с. 745-752]. Принципиально важно, что на кинетические величины РВВ не влияет природа стадии разряда. Дело в том, что в классическом варианте РВВ донором протонов в первой стадии является его сольватная форма, природа которой обусловливается сольватацией ионов Н+ молекулами растворителя. В водных средах – это Н3О+, в безводных этиленгликолевых — НО-С2Н4-ОH2+, в присутствии различных количеств воды в спирте – смесь Н3О+ и НО-С2Н4-ОH2+, либо Н3О+ как и в водных растворах.
В исследуемом случае существуют два совершенно различных по природе сольватации ионов водорода донора протонов Н3О+ и (H2N)2СNH2+, которые участвуют в реакции разряда (соответственно (2) и (3)). Причем независимо от того соизмеримы величины i2 и i3, или i3 >> i2, кинетические закономерности суммарной реакции выделения водорода не изменяются. Это, во-первых, является дополнительным доказательством того, что замедлена стадия удаления в газовую фазу адсорбированного водорода. Такими процессами могут быть следующие:
реакция Гейровского
Надс + Н3О+ + е Н2 + Н2О, (4)
либо её аналог
Надс + (H2N)2СNH2+ + е Н2 + (H2N)2СNH (5)
или реакция Тафеля
Надс + Надс → Н2. (6)
Согласно экспериментально наблюдаемым кинетическим параметрам сток адсорбированного водорода в газовую фазу обусловлен стадией (5), которая, одновременно, и является лимитирующей. Таким образом, РВВ на железе в присутствии гуанидина протекает по двум маршрутам: (2), (6) и (3), (6) с последней замедленной стадией. При концентрации гуанидина
0,5…1,0 ммоль/л скорость РВВ по этим маршрутам соизмеримы, начиная с Сгуанидина порядка 5 ммоль/л существенно преобладает вклад второго, связанного с катодным восстановлением ионов гуанидиния как донора протонов.
Однако предложенная интерпретация не объясняет различий в кинетических закономерностях, связанных с влиянием на ik и iН кислотности среды и концентрации гуанидина. Удовлетворительно объясняются наблюдаемые экспериментально закономерности, если принять наличие двух форм адсорбированного водорода, находящихся в равновесии [5, с. 843-850; 6, 328 с.; 15, с. 11-103; 17, с. 1240-1246].
Нr ↔ Hs. (7)
Если допустить, что в присутствии гуанидина равновесие (7) смещается вправо в силу того, что часть активных центров занимает его протонированная форма, то iH, определяемая величиной Θнs(степень заполнения поверхности Нs-формой водорода, должна расти, при чем в пределе Θнs → 1 [15, с.11-103]). Таким образом, указанные выше противоречия устраняются. Подобный подход объясняет и наличие различных участков на зависимостях
iН = f (Cгуанидина) и даже связь их числа с СН+.
При адсорбции гуанидин может вытеснять Нrадсc наиболее или, напротив, наименее активных центров (АЦ). На основании полученных экспериментальных данных нельзя ответить на вопрос, с каких именно из этих типов АЦ (Надс,max или Надс,min). Но независимо от этого ясно, что переход к адсорбции атомарного водорода иной группой адсорбционных центров должен привести к появлению нового участках на кривых в координатах iН, Cгуанидина. Число же таких участков на подобных кривых может быть функцией СН+, так как сдвиг равновесия определяется, прежде всего, статистической суммой состояния системы, которая, видимо, заметно меняется с СН+ [18, с. 135-182].
Выводы:
- В этиленгликолевых растворах НСl с постоянной ионной силой, содержащих 10 масс.% Н2О в отсутствие и присутствии гуанидина реакция выделения водорода на железе протекает по механизму Фольмера-Тафеля с замедленной стадией рекомбинации.
- Присутствие гуанидина в количестве (0,5 — 10) мМ ускоряет РВВ с порядком реакции 0,6…0,8 в зависимости от кислотности среды.
- Наличие и рост концентрации гуанидина до 1мМ повышает поток диффузии водорода в углеродистую сталь в обводнённых этиленгликолевых растворах, однако характер связи ik и iН с ростом СHCl и Сгуанидина различен.
- Наблюдаемые зависимости ik = f(CН+), iН = f(CН+) и iН = f(Cгуанидина) удовлетворительно объясняются с позиции наличия двух форм (над- и подповерхностного) адсорбированного водорода.
Список литературы:
- Альберт А., Е Сержент. Константы ионизации кислот и оснований. М.: Химия. 1964. – 179 с.
- Вигдорович В.И., Дьячкова Т.П., Пупкова О.Л., Цыганкова Л.Е. Взаимосвязь кинетики восстановления ионов водорода на железе и потока диффузии водорода в углеродистую сталь в кислых растворах. // Электрохимия. 2001. Т. 37. № 12. – С. 1437-1445.
- Вигдорович В.И., Матвеева М.В. Диффузия водорода через стальную мембрану из растворов системы С2Н5ОН – Н2О – HCl: эффект катодной и анодной поляризации. // Электрохимия. 2006. Т. 42. № 12. – С. 1480-1487.
- Вигдорович В.И., Цыганкова Л.Е., Матвеева М.В., Мартынова А.М., Крыльский Д.В. Влияние гуанидина на кинетику реакции выделения водорода на железе и диффузию его через стальную мембрану в кислых водных хлоридных растворах. // Сорбционные и хромотографические процессы. 2008. Т. 8. № 5. – С. 745-752.
- Вигдорович В.И., Цыганкова Л.Е., Шель Н.В., Зарапина И.В., Матвеева М.В.Влияние катодной поляризации стальной мембраны и кислотности спиртовых растворов HCl на соотношение скоростей реакции выделения водорода и его твердофазной диффузии. // Электрохимия. 2007. Т. 43. №7. – С. 843-850.
- Вигдорович В.И., Цыганкова Л.Е. Электрохимическое и коррозионное поведение металлов в кислых спиртовых и водно-спиртовых средах. — М.: Радиотехника. 2009. 328 с.
- Дамаскин Б.Б., Петрий О.А., Цирлина Г.А. Электрохимия.-М.:Химия. 2001. – 624 с.
- Джепаридзе Д. И. О влиянии структурированности многоатомных спиртов на кинетику протекающих в них электродных процессов. // Электрохимия. 1977. Т.13. №5. – С. 668-671.
- Кришталик Л.И. К теории замедленного разряда Жур. Физич. химии. 1957. Т. 31. № 5. – С. 826-830.
- Пальм У.В., Тенно Т.Т. Изучение кинетики выделения водорода на висмутовом электроде из метанольного раствора // Электрохимия. 1974.
Т. 10. – С. 826-830. - Тоя Т., Ито Т., Иши И.Две формы водорода поверхности металла // Электрохимия. 1978. Т.14. № 5. – С. 703-714.
- Феттер К. Электрохимическая кинетика. М.: Химия. 1967. – 867 с.
- Фрумкин А.Н., Багоцкий В.С., Иофа З.А., Кабанов Б.Н. Кинетика электродных процессов. М.: Изд-во МГУ. 1952. – 319 с.
- Фрумкин А.Н. Электродные процессы (Избранные труды). — М.: Наука. 1987. – 336 с.
- Хориути Д., Тоя Т. Поверхностные свойства твердых тел. / Под. Ред. М. Грина. М.: Мир. 1972. – С. 11-103.
- Экилик В.В., Григорьев В.П. Природа растворителя и защитное действие ингибиторов коррозии. Ростов-на-Дону. Изд-во РГУ. 1984. – 192 с.
- Jerkiewicz G., Zoffaghari A. Comparison of Hydrogen Electroadsorption from the Electrolyte with Hydrogen Adsorption from the Cas Phase // J. Electrochem. Soc. 1996. V. 143. № 4. – P. 1240-1246.
- Tsygankova L.E., Vigdorovich V.I., Vigdorovich M.V. Kinetics of the Hydrogen Evolution Reaction on Iron and Hydrogen Diffusion through a Steel Membrane in Ethylene Gilycol and Ethanol Solutions of Hydrochlric Acid Electroanalytical Chemistry Research Developments. Editor P.N. Jiang-New York. 2006. – P. 135-182.
- Vigdorovich V.I., Tsygankova L.E. Various Forms of Adsorbed Hydrogen and Their Role in the Hydrogen Evolution Reaction and Hydrogenation of Metallic Phases in Electrolyte Solution// Protection of Metals. 2007. V.43 №7. –
P. 628-636.[schema type=»book» name=»ВЛИЯНИЕ ГУАНИДИНА НА РЕАКЦИИ ВЫДЕЛЕНИЯ ВОДОРОДА НА ЖЕЛЕЗЕ И ДИФФУЗИЮ ВОДОРОДА ЧЕРЕЗ МЕМБРАНУ ИЗ ВОДНО-ЭТИЛЕНГЛИКОЛЕВЫХ РАСТВОРОВ НСl» author=»Балыбин Д.В., Кудрявцева Н.М., Попова Е.Д.» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-06-20″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_ 30.12.2014_12(09)» ebook=»yes» ]

