В настоящее время в мире организованно широкомасштабное производство пищевых продуктов растительного происхождения с заданными свойствами, получаемыми при помощи генетически модифицированных источников (ГМИ). В целях реализации прав потребителей на получение полной и достоверной информации о технологии производства, качестве и безопасности пищевых продуктов следует серьезно подойти к вопросу выявления ГМИ в продуктах питания [2, с. 17; 3, с. 3]. На базе научно-исследовательских институтов по всей РФ актуально организовывать специализированные лаборатории для проведения исследований пищевых продуктов на содержание ГМИ и мониторинга оборота пищевых продуктов, имеющих генетически модифицированные аналоги.
В РФ с 1996 г. разработана и функционирует законодательная и нормативная и методическая база, позволяющая регулировать оборот пищевой продукции, полученной из ГМИ. В соответствие с санитарно-эпидемиологическими правилами СанПиН 2.3.2.1078-01 «Гигиенические требования безопасности и пищевой ценности пищевых продуктов», введена обязательная маркировка пищевых продуктов из ГМИ. Маркировке подлежит вся пищевая продукция, содержащая в своем составе более 0,9% компонентов из ГМИ.
Разработка методов определения ГМИ началась одновременно с выходом пищевой продукции из ГМИ на мировой продовольственный рынок. В настоящее время подавляющее большинство ГМИ растительного происхождения, представленных на рынке, как было сказано выше, отличается от исходного традиционного сорта растения наличием в геноме рекомбинантной ДНК — гена, кодирующего синтез белка, который определяет новый признак, и последовательностей ДНК, регулирующих работу этого гена, а также собственно нового белка. В качестве мишени для определения ГМИ в пищевом продукте могут рассматриваться как новый модифицированный белок, так и рекомбинантная ДНК. Все методы идентификации ГМИ растительного происхождения подразделяют на 3 группы: химические, иммунологические и метод полимеразной цепной реакции (ПЦР) [1, с 135].
Если в результате генетической модификации меняется химический состав пищевого продукта, для ее определения могут применяться химические методы исследования — хроматография, спектрофотомерия, спектрофлюориметрия и другие, которые и выявляют заданное изменение химического состава продукта. Эти методы могут использоваться, например, при идентификации некоторых линий генетически модифицированной сои, у которых установлены изменения в жирнокислотном составе липидов [4, с 111].
Присутствие в продукте нового белка дает возможность применять для определения ГМИ иммунологические методы. Они наиболее просты в исполнении, имеют относительно низкую стоимость и позволяют определить конкретный белок, несущий новый признак. В настоящее время разработаны тест-системы, применяя которые можно проводить количественное определение модифицированного белка в таких продуктах, как изоляты и концентраты соевого белка и соевая мука. Однако в случае анализа пищевых продуктов, при производстве которых исходное сырье подвергается значительной технологической обработке (высокая температура, кислая среда, ферментативная обработка и др.), иммунологический анализ может давать нестабильные или плохо воспроизводимые результаты из-за денатурации белка. При исследовании, например, колбасных и кондитерских изделий, продуктов детского питания, пищевых и биологически активных добавок к пище иммуноферментный анализ неприемлем.
Возможность определения белка ограничена уровнем его содержания в продукте. Так, в большинстве генетически модифицированных культур, представленных на мировом продовольственном рынке, уровень модифицированного белка в частях растений, употребляемых в пищу, ниже 0,06%, что затрудняет проведение иммуноферментного анализа. Учитывая это, в большинстве стран основные способы определения ГМИ в продуктах — методы, основанные на определении рекомбинантной ДНК, например, метод полимеразной цепной реакции (ПЦР).
Полимеразная цепная реакция (ПЦР) – экспериментальный метод молекулярной биологии позволяющий добиться значительного увеличения малых концентраций определенных фрагментов нуклеиновой кислоты (ДНК) в биологическом материале (пробе). Этот метод в настоящее время по сравнению с другими методами является:
- наиболее распространенным, так как модифицированная ДНК синтезируется во всех частях ГМИ;
- универсальным, за счет возможности определения нуклеиновой кислоты (ДНК) в любых биологических образцах;
- высокочувствительным, позволяет выявить единичные копии ДНК;
- процесс выполнения диагностики автоматизирован;
- высокая скорость проведения исследования;
- считается менее дорогим, чем другие методы исследования;
- позволяет провести как качественный, так и количественный анализ.
В настоящей работе исследованы три образца круп на содержание ГМИ методом полимеразной цепной реакции (ПЦР) с детекцией продуктов амплификации в режиме «реального времени» при помощи тест-системы «КВАНТУМ-П СОЯ» производства ЗАО «НПО ДНК-Технология». Эта тест-система предназначена для определения процентного содержания промотора 35S относительно геномной ДНК сои (Glycine max) в пробах пищевых продуктов и продовольственного сырья. Тест-система основана на принципах флуоресцентной детекции.
При анализе в качестве образцов использовались:
- крупа полбяная, ООО «Партнет», РФ, Республика Татарстан, ТУ 9294-001-94319966-2010 (номер лунки А1);
- крупа амарантовая, ООО «Бонфан», Нидерланды, EURO NAT F-07340, GLOBALGAP (номер лунки А2);
- крупа гречневая, ОАО «Мельник», Белоруссия, ГОСТ 5550-74 (номер лунки А3).
На компьютере с помощью программного обеспечения «RealTime_PCR v.7.3» для детектирующих амплификаторов ДТ–96 и ДТ–322, создавался тест со следующими параметрами:
- тип проводимого анализа «ГМИ», метод – геометрический (Cp);
- типы пробирок: образец, стандарт, контроль+, контроль-;
- количество стандартов – 3 (дубли – 2);
- количество копий: Стандарт_1 – «5», Стандарт_2 – «1»; Стандарт_3 – «0,1»;
- положительных («K+») и отрицательных («K-») контролей – по 2;
- объём рабочей смеси в пробирке – 35 мкл;
- флуорофоры: FAM – специфичный продукт, HEX – внутренний контрольный образец.
Анализ результатов производился автоматически после окончания программы амплификации. Полученные результаты отображаются в виде протокола, который включает в себя итоговую таблицу (определение содержания ГМИ) и графика (зависимость флуоресценции канала FAM и HEX от номера цикла) (рис. 1).
Таблица 1.
Определение содержания ГМИ
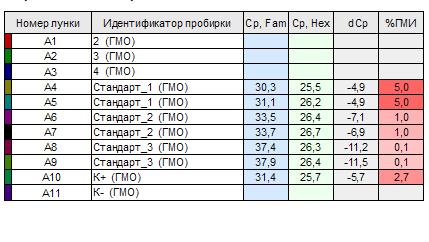
По итоговой таблице 1, видно, что в столбце % ГМИ для каждого стандарта и образца отражаются результаты анализа в виде процентного содержания ДНК промотора 35S относительно геномной ДНК сои. В нашем протоколе у образцов нет числовых показателей (номера лунок: А1, А2, А3), что свидетельствует об отсутствии геномного ДНК в исследованных крупах.
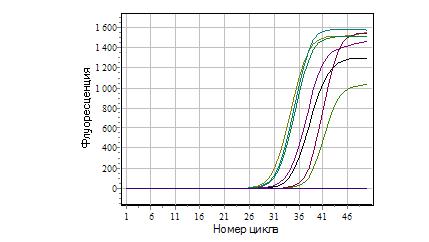
Рисунок 1. Зависимость флуоресценции канала FAM от номера цикла
На рисунке 1 представлены изменения флуоресцентного сигнала в каждом цикле амплификации для канала FAM (предназначен для генно-инженерной вставки) и HEX (предназначен для природного гена), но так как в образцах отсутствует геномное ДНК, видны только кривые флуоресценции стандартных образцов. Если бы удалось выявить ГМИ, то прибавились бы кривые флуоресценции образцов исследуемых круп.
Список литературы:
- Каленик Т.К., Федянина Т.В., Танашкина Т.В. Товароведение и экспертиза пищевой продукции, полученной из генетически модифицированных источников: учеб. пособие. Ростов на Дону: «МарТ», Феникс, 2010. -224 с.
- О Стратегии национальной безопасности Российской Федерации до 2020 года: указ Президента Российской Федерации от 12.05.2009 г. № 537 [Электронный ресурс] // Сайт Совета безопасности РФ. – Режим доступа https://www.scrf.gov.ru/documents/99.html. – Загл. с экрана.
- Основы государственной политики Российской Федерации в области здорового питания населения на период до 2020 года: распоряжение Правительства Российской Федерации от 25.10.2010 г. № 1873-р // Рос.газ. – 2010. – 3 ноября.
- ПЦР «в реальном времени» / Ребриков Д.В., Саматов Г.А., Трофимов Д.Ю. и др.; под ред. д.б.н. Д.В.Ребрикова; предисл. Л.А.Остермана и акад. РАН и РАСХН Е.Д.Свердлова. М.: БИНОМ. Лаборатория знаний, 2009. – 223 с.[schema type=»book» name=»ИССЛЕДОВАНИЕ МЕТОДОМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫХ ИСТОЧНИ-КОВ » author=» Журавко Екатерина Владимировна, Новикова Жанна Викторовна, Саитова Маргарита Эдуардовна » publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-06-16″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_ 30.12.2014_12(09)» ebook=»yes» ]

