Постановка задачи
В монографии [1] предложен сценарий эволюционного развития мира полипептидов и полинуклеотидов, приводящий к самопроизвольному возникновению первичного генетического кода. Проведенные в [2] компьютерные эксперименты показали, что сценарий превращается в работоспособный алгоритм, если к нему добавить положение о непрерывном разрушении случайно возникающих полипептидных и нуклеотидных «текстов» тепловым движением в химической системе. Новые тексты строятся в процессе случайных встреч крупных обломков старых текстов и способствуют рождению сопряженных им полинуклеотидов. Тогда среди сравнительно длинных текстов обнаруживаются почти полные копии текстов, существовавших и разрушенных ранее. То есть, химическая информация, возникшая случайно, передаётся в историческое будущее. Это и было названо первичным генетическим кодом.
Возникает вопрос, поднятый автором работы [3], – как дополнить этот сценарий, чтобы он объяснил феномен возникновения и закрепления в данном химическом мире соединений, несущих полезные биохимические функции? В частности, как случайные процессы могли привести к возникновению белков с функцией ферментов, катализирующих важные биохимические реакции?
В имитационном компьютерном эксперименте невозможно ответить на эти вопросы, поскольку в [2], наряду с повторяемостью текстов будущих биополимеров, оценивалось лишь количество информации по Шеннону, но не определялась их сложность и эволюционная ценность. Следовательно, сценарий [1], основанный на ряде ограничений на случайные события в моделируемом мире, необходимо дополнить такими эволюционными ограничениями, чтобы растущие полипептидные тексты самопроизвольно стремились к возникновению какой-то сложной функции. Тогда эволюция химического мира в компьютерном эксперименте станет канализированной, и модель даст конечный результат, согласующийся с реалиями живого мира. Ради достижения такого результата проведено данное исследование, основанное на следующей гипотезе.
В моделируемом химическом мире могут закономерно возникать соединения с самыми различными свойствами, функциями, но обязательно через случайные встречи между микрочастицами. И есть определённые причины, механизмы, по которым некоторые соединения со своими ценными эволюционными свойствами закрепляются в истории, а некоторые – гибнут и исчезают с исторической сцены.
Остаётся выяснить – почему и как некоторые сложные соединения скорее выживают, чем вымирают. Эта проблема может быть решена уже не проверкой логической согласованности сценария [1], но средствами биофизики, из которой известно, что простые химические соединения, включая короткие пептиды, не обладают специфическими, остронаправленными функциями. Только очень сложные полипептиды, белки с их первичными, вторичными и третичными структурами проявляют биохимические функции. Эти функции напоминают свойства δ-функции: данный белок катализирует только данную химическую реакцию, реагируя только на данный субстрат. На другие посторонние соединения он никак не реагирует.
Итак, в данной работе ставится задача – проследить на физическом уровне, как связана сложность структуры пептида с его стойкостью по отношению к разрушительному воздействию теплового движения. В качестве инструмента исследования предлагается использовать теорию колебательных состояний сложных органических молекул [4] и программы [5] для анализа этих состояний.
Объект исследования и теоретические предпосылки
Рассмотрим этапы наращивания иерархии структур белка в конформации α-спирали. При этом проверим, как физические механизмы формирования первичной, вторичной, третичной и четвертичной структуры белка согласуются с концепцией эволюции, предложенной в [1] и дополненной в [6]. Проводимые физические рассуждения справедливы и для современных механизмов синтеза белка, и для этапа предбиологической эволюции химического мира. Разница только в скорости эволюционных процессов и в степени предопределённости конечного результата. Современный белок формируется на рибосоме за очень короткое время, а его первичная структура жестко определена современным генетическим кодом. Древний белок формировался в течение весьма продолжительного времени, а его первичная структура возникала в ходе случайных встреч молекул аминокислот или готовых коротких пептидов. Эволюция же вторичной структуры и более высоких структур белка протекает одинаково и в современном, и в древнем белке.
Что же касается разрушения пептидов, без чего не мог обойтись сценарий [1], то этот механохимический механизм прояснён в [7]. Показано, что многократные удары в результате теплового движения соседних молекул могут привести к накоплению колебательной энергии в скелете длинной молекулы. Если структура скелета однородна, как в регулярном полипептиде, то накопленная энергия диссипирует по всей длине скелета и не приводит к его разрушению. Если же скелет неоднороден, то в нём возникают локальные колебания с большими амплитудами, что и приводит к распаду длинной молекулы в определённых местах. Показано также, что боковые ответвления плохо проводят поток колебательной энергии, а лёгкие связи вовсе не способствуют распространению колебаний по молекулярному пространству.
Ниже мы покажем, что приведенных здесь теоретических положений достаточно для прояснения механизмов канализации эволюции белка. Заодно проверим, как согласуются физические механизмы организации иерархии структур белка с положениями [1, 6] концепции эволюции химического мира.
Формирование первичной структуры белка
В сценарии [1] учтена способность аминокислот самостоятельно формировать сравнительно длинные пептидные цепи. Известно, что любая пептидная цепь имеет начало и конец. Значит, первичная структура пептида, а затем белка, имеет направленность в молекулярном пространстве. Поэтому при соединении двух молекул аминокислот либо при соединении двух пептидов в более длинную цепь процесс соединения не может проходить в произвольном порядке – конец первой молекулы присоединяет к себе начало второй молекулы, независимо от длин этих молекулярных цепей. Этот процесс в плане своего конечного результата уже в значительной степени предопределён структурой и электрическими свойствами аминокислот. Можно заметить, что уже на этом этапе проявляются все основные черты эволюции по Галимову [1]:
- Реакция присоединения налагает ограничение на свободу движений двух отдельных частиц и, тем самым, упорядочивает мир пептидов. Возникает направленный текст более крупной и сложной частицы, в составе которой исходные компоненты уже не могут совершать произвольные относительные движения. Допущены только строго организованные колебательные движения.
- Природа ведёт себя крайне экономно, используя готовые молекулярные структуры для построения более сложных и эволюционно перспективных структур.
- Частичная направленность эволюционного процесса (разрешены только два варианта результирующего текста) обеспечивается строго детерминированным электрическим механизмом высвобождения молекулы воды из двух соединяющихся сложных частиц. Новая информация возникает путём закрепления случайно возникшей комбинации носителей старой информации.
- Смысл рассмотренного микроэволюционного процесса заключается в достижении главной цели эволюции материи – получен материал, способный к дальнейшей эволюции, к построению ещё более ценных в плане развития объектов. В перспективе – белков.
Из первых двух пунктов следует, что не имеет смысла рассматривать процесс формирования белка из отдельных атомов и подсчитывать комбинаторную сложность молекулы пептида. Процесс формирования первичной структуры белковой молекулы есть эволюционный процесс, в высокой степени канализированный. Однако канализация задана не в самом этом процессе, а на этапе эволюционного развития химического мира, когда возникли аминокислоты. Современный синтез белка в теле рибосомы сильно отличается от случайного наращивания длин полипептидов. И этот современный механизм нельзя называть эволюционным. Это просто линейное развитие заранее известного химического объекта по строго определённому рецепту. Но важно, что данный рецепт хранит в себе всю эволюционную историю случайно-закономерных шагов к появлению современного сложного и ценного химического объекта.
Отметим, что данный этап эволюции белковой молекулы протекает под действием мощных химических сил, поскольку реакция присоединения к молекуле следующей аминокислоты связана с возникновением новых ковалентных связей. Выделяется значительная порция энергии, равная энергии новых химических связей минус энергия активации реакций. С физической точки зрения эти процессы суть проявления игры мощных электрических сил, приводящих к серьёзным перестройкам локальных электронных плотностей в молекулах. На следующем этапе эволюции должны взаимодействовать элементы первичной структуры пептида, причем эти элементы будут использоваться целиком. А управлять процессами второго этапа эволюции будут электрические силы значительно меньшего масштаба. В этом и проявятся подмеченные в работе [6] характерные закономерности эволюционного процесса.
Средствами молекулярного моделирования можно показать, что пептиды со сложными аминокислотными остатками обладают большой механохимической прочностью, и тем большей, чем сложнее их аминокислотый текст. Пусть, например, в первичной структуре пептида рядом оказались сложные по структуре остатки триптофана и лейцина. В результате внутренних вращений эти радикалы могут сблизиться и соединиться с помощью нехимических связей типа ван дер Ваальса. Тогда тепловое разрушение химической связи между этими остатками в скелете пептида может не привести к распаду цепи, поскольку два связанных радикала будут держать распавшиеся фрагменты скелета на малом расстоянии друг от друга, и может произойти обратная реакция их присоединения.
Формирование вторичной структуры белка
Вторичная структура пептида (α-спираль) строится самопроизвольно по эволюционным сценариям. В пептидном скелете цепи наряду с жесткими плоскими фрагментами (–C=O–NH–, пептидная связь) имеются связи, вокруг которых возможно внутреннее вращение. Как только в последовательно строящемся пептиде появляется четвёртый аминокислотный остаток, случайные внутренние вращения в скелете позволяют сформироваться первому витку спирали. И сразу наступает второй этап эволюции данной пептидной структуры, не дожидаясь, пока будет достроена вся первичная структура. Возникает водородная связь между C=O первого остатка и NH четвёртого. Эти связи стабилизируют вторичную структуру пептида, ограничивая свободу внутренних вращений в цепи и переводя эти вращательные степени свободы в более строгие движения, в колебательные. Результаты видны на рисунках 1 и 2.
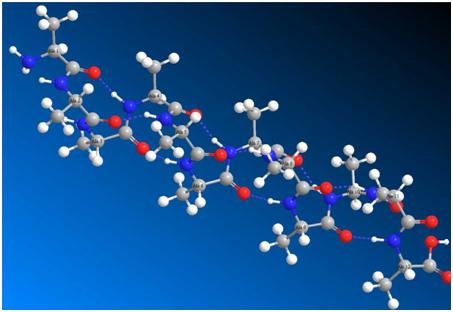
Рисунок 1. Полная структура двенадцатичленного олигомера аланина. Видны водородные связи между первым и четвёртым аминокислотными остатками, и далее так по всей цепи.
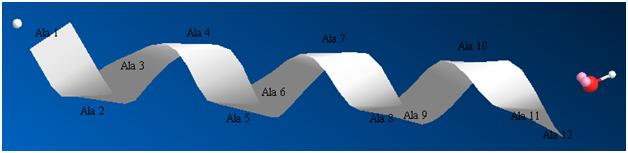
Рисунок 2. Та же структура, показанная в форме «ленты». Атом водорода слева и кислотная группировка справа обозначают начало и конец пептида.
Нетрудно заметить, что жесткая скелетная пептидная структура, даже усложнённая боковыми радикалами, представляет собой не такую уж большую биохимическую ценность. Данная структура не способна катализировать лишь одну важную для живого вещества биохимическую реакцию при полной нейтральности к другим возможным взаимодействиям. Действительно, жесткая α-спираль окружена внешней «шубой» из лёгких радикалов, содержащих множество протонов. Согласно теории [8], именно подвижность протонов лежит в основе механизмов возникновения реакционных центров. Так что, α-спираль готова к многочисленным реакциям со случайными партнёрами.
Этот вывод не изменится, если мы рассмотрим любой более сложный пептид-сополимер. Он будет отличаться от простой модели рисунка 1 только разнообразием боковых радикалов. Но радикалы всех 20 белковых аминокислот содержат протоны. Некоторые радикалы из-за подвижности протонов склонны к изомеризации. А в теории [8] и в наших компьютерных экспериментах [9] выяснилось, что именно изомеризация сложных органических соединений способствует реакциям. Следовательно, этот жесткий «стержень» не годится на роль фермента, пригодного для ускорения одной-единственной биохимической реакции по типу δ-функции. Это всего лишь заготовка для будущего этапа эволюции белка.
Однако эволюционная ценность вторичной структуры заметно выше ценности первичной структуры белка в форме рыхлого клубка. Как мы ниже покажем, сложная вторичная структура является более устойчивой к тепловым разрушающим воздействиям и, тем самым, служит более подходящим материалом для дальнейшей эволюции, то есть для формирования третичной структуры белка.
Отметим, что данный этап эволюции белковой молекулы протекает под действием значительно меньших сил, чем предыдущий этап. При образовании водородной связи выделяется меньшая порция энергии, чем при образовании ковалентной связи. Физически это обусловлено иным устройством потенциальной ямы, в которую попадает протон, по сравнению с потенциальной ямой, характерной для ковалентных связей.
Формирование третичной и четвертичной структуры белка
Третичной структурой называют белковую глобулу, свёрнутую из пептидных лент. Участки лент скреплены супрамолекулярными силами, действующими между аминокислотными радикалами. Это очень слабые силы, аналогичные силам ван дер Ваальса. Под действием таких сил в молекулярных ансамблях самопроизвольно возникают временные комплексы, где две молекулы совершают колебания в яме ван дер Ваальса. Мы ранее подробно исследовали это явление средствами молекулярной динамики [10]. Механизм формирования комплексов ван дер Ваальса можно обобщить и на случай возникновения внутренних супрамолекулярных связей в белке.
При возникновении связанного состояния двух молекул в яме ван дер Ваальса выделяется очень малая порция энергии. Поэтому в жидкости и в газе такие комплексы долго не живут, разрушаются тепловым движением. Но в белке результат совершенно другой. Если вторичная структура длинного частично гибкого пептида позволяет возникать большому числу таких взаимодействий между радикалами, то суммарная энергия супрамолекулярных связей получается значительной, и тепловое движение оказывается бессильным – вся система связей очень устойчива к внешним воздействиям.
Исключение из этого правила составляют истинные химические силы, возникающие в серных мостиках. S-S мостик возникает между двумя значительно удалёнными радикалами цистеина –CH2SH. Частично гибкая пептидная цепь образует случайную петлю, два радикала цистеина сближаются, возникает связь –CH2S–S CH2–, и высвобождается молекула водорода. Так в структуре пептида возникает устойчивая петля. Этот элемент третичной структуры белка важен своей повышенной устойчивостью к внешним воздействиям. Такие петли помогают денатурированному белку снова восстанавливать полную третичную структуру.
Однако самые благоприятные условия для формирования внутренних супрамолекулярных связей в пептиде создают случайные нарушения однородной структуры α-спирали. Причины таких нарушений следующие.
Во-первых, это случайные изгибы скелета пептидной цепи. Они возникают из-за некоторой свободы внутреннего вращения в скелете. Взаимодействия между сложными радикалами инициируют эти небольшие повороты. На рисунке 3 показана лента сравнительно короткого пептида после оптимизации энергии данной структуры. Уже на таком примере видны намечающиеся нерегулярности в ленте. И эти нерегулярности обеспечивают белковой цепи дополнительную защиту от тепловых разрушений.
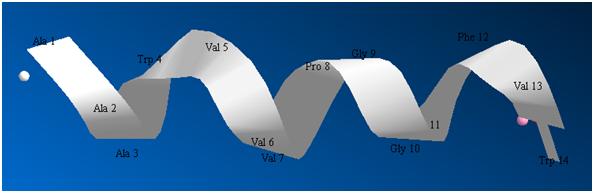
Рисунок 3. Короткий пептид со сложным радикалом триптофана.
Во-вторых, это – иминокислота пролин. Встраиваясь в пептидную цепь, пролин нарушает периодическую структуру скелета α-спирали. В цепи возникают неоднородности и дополнительные возможности изгибаться, создавать длинные петли. Участки вторичной структуры белка получают возможность накладываться друг на друга. Тем самым, различные радикалы получают возможность случайно сблизиться до расстояний, на которых возможно проявление сил ван дер Ваальса и возникновение колебательных состояний пар радикалов в общей потенциальной яме. Таков механизм формирования третичной структуры. И это одновременно механизм упрочнения белковой структуры.
Отметим, что данный этап эволюции белковой молекулы протекает под действием значительно меньших электрических сил, чем предыдущий этап. При образовании каждой связи ван дер Ваальса выделяется меньшая порция энергии, чем при образовании водородной связи. Но во всей третичной структуре белка таких слабых связей очень много, что и обеспечивает белковой глобуле большую прочность.
Такие же супрамолекулярные связи обеспечивают следующий этап эволюции, возникновение четвертичной структуры белка. Две или более молекулы полипептидов случайно найдут друг друга в подходящей среде и составят настоящую прочную супрамолекулу. И тогда с большей вероятностью может случайно возникнуть полость, куда свободно поместится крупная органическая молекула, субстрат, способный по правилам органической химии превратиться в другой органический объект, продукт. Только в обычных условиях, когда этот субстрат свободно плавает в подходящей среде, вероятность его превращения в продукт крайне мала. А в подходящей полости, где субстрат плотно окружен другими сложными органическими структурами, он под действием сил ван дер Ваальса может закрепиться в нужной конформации, испытать подходящие изомер-изомерные превращения и, в конце концов, превратиться в продукт. Данная полость послужит катализатором реакции Субстрат -> Продукт. Например, как полость инсулина, показанного на рисунке 4.
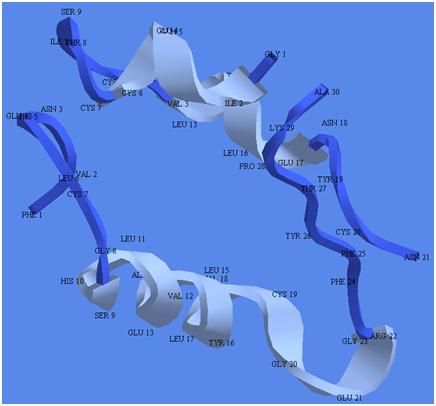
Рисунок 4. Инсулин, четвертичная белковая структура, состоящая из двух различных пептидов.
Заключение
Из приведенного рассмотрения видно, что усложнение случайных структур пептидов в добиологическом мире от первичной структуры до четвертичной сопровождается возрастанием устойчивости к тепловому разрушению. Самая сложная случайная структура, возможно, сможет работать как фермент. При этом деятельность фермента связана с затратами времени на распознавание, ориентацию субстрата, на превращение субстрата в продукт и на выведение продукта из глобулы. Тем самым, возникает своеобразная линия задержки, в которой сложный белок может долго сопротивляться тепловому разрушению. За время этой задержки более простые структуры подвергаются тепловому разрушению и сходят со сцены, на которой разворачивается эволюционный процесс накопления и кодирования сложных белковых структур. Это обусловливает самопроизвольную канализацию эволюционного процесса, его направленность в сторону появления первичного генетического кода. И это привело в древнем химическом мире к возникновению белков, проявляющих сложные биохимические функции.
Список литературы:
- Галимов Э.М. Феномен жизни. Между равновесием и нелинейностью. Происхождение и принципы эволюции. М.: УРСС, 2001. — 254 с.
- Дементьев В.А. Компьютерное моделирование процесса возникновения генетического кода. В сборнике «Проблемы зарождения и эволюции биосферы» под ред. Э.М. Галимова, М:, URSS, 2008, 79-94.
- Малышкин А. П. Адаптивный иммунитет: концепция сцепленных функций. Immunology Innovation, 2013, ISSN 2053-213X.
- Грибов Л.А. Колебания молекул, М:, URSS, 2009. — 544 с.
- Дементьев В.А. Моделирование колебательных состояний молекул в вычислительной среде MatLab, Palmarium Academic Publishing, 2012, ISBN 978-3-8473-9639-0. — 440 с.
- Dement’ev V.A. The Driving Forces of Evolution. ISSN 0016_7029, Geochemistry International, 2014, Vol. 52, No. 13, pp. 1146–1189.
- Грибов Л.А., Дементьев В.А. Волновые движения в молекулярных наноструктурах: результаты компьютерных экспериментов. Журнал структурной химии, 2010, Том 51, № 2, 331-336.
- Грибов Л.А., Баранов В.И. Теория и методы расчёта молекулярных процессов. Спектры, химические превращения и молекулярная логика. М:, URSS, 2006. — 480 с.
- Грибов Л.А., Баранов В.И., Дементьев В.А. К вопросу о теории процессов в реакционных центрах многоатомных молекул. Известия Академии наук. Серия химическая. 2006, №8, 1267-1273.
- Дементьев В.А. Физические аспекты химической кинетики. Евразийский Союз Ученых. XII Международная научно практическая конференция «Современные концепции научных исследований». Часть 7. ISSN 2575-7999, Москва, 27-28 марта 2015, # 3, 2015, стр. 125-128.[schema type=»book» name=»ФИЗИКА КОЛЕБАНИЙ КАК РЕГУЛЯТОР ЭВОЛЮЦИИ БЕЛКА» author=»Дементьев Василий Александрович» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-03-11″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_30.05.2015_05(14)» ebook=»yes» ]

