Материалы исследований подготовлены при финансовой поддержке Российского научного фонда (проект № 16-15-00176).
Введение. Уровень травматизма в Российской Федерации в среднем за последние 30 лет достиг 872±6,3 случая на 10 тысяч человек и не имеет тенденции к снижению показателей [9, 2]. Тяжесть перенесенных травм, в первую очередь, предопределяет срывы восстановительных процессов, приводит к стойкой утрате трудоспособности и снижению качества жизни пострадавших. Последствия травм среди причин первичной инвалидности, занимают третье место после онкологических и сердечнососудистых заболеваний [1, 3, 7], а у граждан трудоспособного возраста выходят на первое место, имея при этом тенденцию к устойчивому росту [ 10, 7].
Наибольшую группу инвалидов среди пострадавших от травм составляют больные с переломами конечностей — 67,9%. И.В.Шведовченко с соавторами на IX съезде травматологов-ортопедов России среди причин инвалидности после травм отметил недостатки амбулаторного лечения (33,3%) и стационарного лечения больных и инвалидов (14,6%), причем в 13,2% использовался метод накостного остеосинтеза [11].
В рамках философии AO/ASIF создан большой набор различных пластин для разных участков костей и оригинальный инструментарий. При применении нейтрализующих пластин основная часть нагрузки приходится на фиксатор, который шунтирует нагрузку на поверхность перелома. Это приводит к ряду негативных последствий: остеопорозу в ненагружаемой зоне кости, снижению эффективности остеорепарации в зоне перелома, а также к повышению риска перелома пластины и винтов несмотря на то, что толщина пластин колеблется от 2,5 до 8 мм [13, 14,16]. К недостаткам накостного остеосинтеза относят и избыточное давление пластины на надкостницу, что приводит к некрозу последней и снижению ее остеогенной способности.
В последние годы появились массивные накостные пластины, выполненные из титанового сплава и имеющие биоактивное покрытие гидроксиапатитом [6]. Такие имплантаты несколько снизили количество осложнений (в первую очередь переломы имплантатов), но сроки консолидации сохранились в большинстве случаев в пределах 4-6 месяцев.
Целью данного исследования является обоснование оптимального вида и структуры накостного имплантата для его быстрой остеоинтеграции, а, следовательно, и сокращения сроков консолидации перелома кости.
Материал и методы исследования. Для исключения перечисленных недостатков современных накостных имплантатов была высказана гипотеза необходимости быстрой остеоинтеграции имплантата, которая обеспечит максимальную стабильность остеосинтеза. Для остеоинтеграции желательно укладывать имплантат под надкостницу и уменьшить толщину имплантата до 1 мм. Снижение прочности такого имплантата возможно ликвидировать с помощью двухплоскостной пластины, внутренние поверхности которых полностью повторяют особенности наружной поверхности сломанной кости. Изготовление подобного имплантата возможно аддитивной технологией лазерного спекания титанового порошка при компьютерном моделировании поверхности кости после КТ поврежденной и контрлатеральной конечности пациента [5].
В экспериментах для изучения процесса остеоинтеграции использованы 10 беспородных собак обоего пола в возрасте от 1 года до 3 лет с массой тела 20±2,9 кг. У животных под общим наркозом осуществляли накостный остеосинтез большеберцовой кости пластинами 20х10 мм выполненными из титанового сплава (Ti6Al 4V) толщиной 1,0 мм: часть пластин имела сплошную структуру ( 3 шт) остальные пористую структуру (10 шт), сравнивали процесс остеоинтеграции при отсутствии биоактивного покрытия и при наличии гидроксиапатита (ГА) на поверхности имплантата фиксированного по разным технологиям ( микродуговое оксидирование (МДО), высокочастотное (ВЧ) магнетронное напыление, композитное покрытие на основе фторуглеродного пластика — сополимера тетрафторэтилена с винилиденфторидом (ТФЭ/ВДВ), наполненного мелкодисперсными фосфатами кальция (ГА) [8, 15]. Пластины располагали под надкостницей и фиксировали к большеберцовой кости двумя шурупами. После операции в течение 7 дней внутримышечно вводили Цефазолин (по 0,5 гр 2 раза в день). Раны контролировали ежедневно.
За животными наблюдали от 7 до 28 дней после операции. Процесс остеоинтеграции контролировали по рентгенологическим признакам и методом анатомического препарирования.
Рентгенографию в динамике эксперимента осуществляли с помощью рентгеновского аппарата PremiumVet (Sedecal, Испания).
Эксперименты выполнены в соответствии с требованиями «Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей» (Страсбург, 1986) и были одобрены Комитетом по этике ФГБУ «РНЦ «ВТО» им. акад. Г.А. Илизарова».
Результаты исследований. На протяжении эксперимента при клиническом обследовании изменений общего состояния животных, отклонений в потреблении корма и воды выявлено не было. Осложнений неврологического и инфекционного характера не отмечено. Опорная функция опытного сегмента сохранялась до окончания эксперимента. На протяжении всего эксперимента имплантаты оставались неподвижными, их смещения не наблюдали.
Рентгенологически признаки остеоинтеграции наблюдали в период фиксации 28 дней в виде тонкого (0,5 мм) слоя минерализованной ткани по внешней поверхности пластины. Такая картина наблюдалась при пористой структуре у пластин с биоактивным покрытием гидроксиапатитом по технологии МДО или полимерного композита (ТФЭ/ВДВ+ ГА). У остальных видов покрытия рентгенологических признаков остеоинтеграции в эти сроки наблюдения не было.
Во время анатомического препарирования вокруг пластин со сплошной структурой признаков остеоинтеграции со стороны надкостницы не отмечено (Рис. 1).
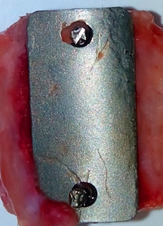
Рис. 1. Титановый иплантат сплошной структуры – отсутствие остеоинтеграции через 28 дней после операции
Анатомическое препарирование при накостном остеосинтезе пористыми пластинами уже с 14 дня наблюдения отмечено появление грануляционной ткани, заполняющей пространство пор и восстанавливающей непосредственную связь надкостницы с компактным веществом большеберцовой кости (Рис. 2а ).
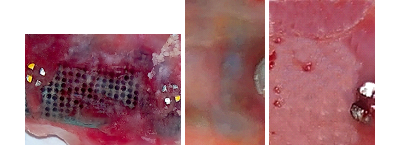
а б в
Рис. 2. Грануляционная ткань на поверхности имплантата и в его порах – 14 дней остеосинтеза (а). Компактное вещество кости, покрывает накостный имплантат и заполняет поры имплантата – 28 дней остеосинтеза: б – технология биоактивного покрытия МДО, в – покрытие полимерного композита (ТФЭ/ВДВ+ ГА).
Наиболее активно процесс остеоинтеграции протекает вокруг пористых пластин с биоактивным покрытием гидроксиапатитом по технологии МДО или полимерного композита (Рис. 2 б, в ). Через 14 дней пластина обычно покрыта тонким слоем минерализованного костного регенерата, а через 28 дней мощный слой кости покрывает всю площадь имплантата.
Обсуждение результатов исследования. Основным принципом современного накостного остеосинтеза является обеспечение механической неподвижности костных отломков, поэтому имплантаты (биоматериалы) изготавливают достаточно жесткими из прочного сплава металлов, значительными по толщине. Дополнительные предложения по увеличению прочности имплантата и надежности остеосинтеза – увеличение толщины имплантата, ребра жесткости, полу-, треть- и четверть-трубчатые (по степени изгиба плоскости пластины вдоль оси фиксатора), частичное ограничение контакта с надкостницей, второй ряд отверстий, компрессирующие овальные отверстия, угловая стабильность винта и др. — не влияют на процесс репаративной регенерации кости, не гарантируют остеоинтеграции имплантата и не сокращают сроки консолидации перелома.
Оценивая имплантаты по активности влияния на репаративную способность кости все биоматериалы, которые используют в качестве временных фиксаторов для сломанной кости (накостные пластины, интрамедуллярные стержни) можно разделить:
- биотолерантные материалы (нержавеющая сталь и кобальтохромовые сплавы) – поверхность таких имплантатов отделяется от смежной кости слоем фиброзной ткани, репаративная регенерация поврежденной кости происходит в обычные сроки и на некотором расстоянии от имплантата (дистантный остеогенез);
- биоинертные материалы (оксиды титана и алюминия) – не вызывают образования фиброзной ткани, репаративный остеогенез протекает в непосредственном контакте с поверхностью имплантата, но консолидация происходит в обычные сроки;
- биоактивных материалов среди металлов нет. К типичным представителям биоактивных материалов относятся биостекла (наиболее часто используется состав: 24,5 % Na2O, 24,5 % CaO, 45,0 % SiO2, 6 % P2O5) и материалы на основе гидроксиапатита – Ca10(PO4)6(OH)2 (плотная и пористая керамика). Однако подобные биоактивные материалы отличает хрупкость и в чистом виде они значительно уступают по прочности металлическим. Выход был найден в производстве металлических имплантатов с гидроксиапатитовым покрытием [4, 8]. Кальций-фосфатная керамика характеризуются образованием очень тесной химической связи с костью (связующий остеогенез) [17, 12], усиливают реакции образования костной ткани начиная с поверхности имплантата и индуцируют образование непрерывной связи от ткани к его поверхности (процесс остеоинтеграции).
В отношении костной ткани следует отметить ее значительный регенерационный потенциал. Восстановление утраченной костной ткани идет из особых участков органа, являющихся своеобразными центрами регенерации. Одним из таких центров в значительной степени является надкостница, поэтому снижение ее репаративных возможностей при компрессионном сдавлении накостным имплантатом недопустимо, т.к это приводит к нарушению в ней кровообращения и некрозу, развитию атрофии кости, раннего остеопороза и замедлению процесса консолидации.
Избежать подобного негативного влияния имплантата возможно только расположив его под надкостницей. Для этого толщина имплантата должна быть минимальной, а структура пористой для быстрого восстановления кровоснабжения кости со стороны надкостницы и использования ее остеоиндуктивных возможностей. Достаточную жесткость имплантата и прочность остеосинтеза можно обеспечить за счет персонифицированной двухплоскостной формы имплантата изготовленного по аддитивной технологии (рис. 3), которая полностью учитывает криволинейную геометрию поверхности трубчатой кости индивидуально для каждого пациента.
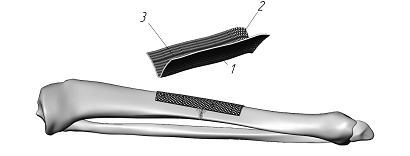
Рис.3. Схема накостного остеосинтеза при переломах диафиза большеберцовой кости пластиной, выполненной по аддитивной технологии (заявка на полезную модель №2016109513 от 16 марта 2016г, положительное решение от 25 июля 2016г):1- наружная поверхность имплантата, 2 – сквозные поры накостного имплантата, 3 – внутренняя поверхность имплантата.
Наружная поверхность диафиза большеберцовой или бедренной кости, в любом поперечном сечении, не имеет форму правильной геометрической фигуры, в частности форму круга или треугольника, и изменяется вдоль продольной оси кости. Продольная ось диафиза большеберцовой или бедренной кости, не обязательно является прямолинейной. Поэтому внутренняя поверхностью пластины при установке на трубчатую кость (бедренная, большеберцовая, плечевая, локтевая, лучевая) должна полностью соответствовать индивидуальным особенностям персонально каждого пациента. Биоактивное покрытие поверхности имплантата гидроксиапатитом стимулирует репаративную регенерацию, а поры в материале имплантата диаметром 500-600 мкм способствуют восстановлению кровоснабжение кости со стороны надкостницы.
Заключение. Философия внутреннего (погружного) остеосинтеза, особенно в настоящее время старается утверждать концепцию стабильной фиксации, бережного отношения к мягким тканям, ранней активизации и функциональной, что далеко не в полной мере относится к современному уровню накостного остеосинтеза. Дальнейшее развитие данного вида остеосинтеза должно отвечать принципу персонального изготовления тонких имплантатов по аддитивной технологии из химически инертных материалов, имеющих биоактивное покрытие и пористую структуру.
Фиксация таких имплантатов под надкостницу должна обеспечить стимуляцию репаративного остеогенеза и быструю остеоинтеграцию имплантата для консолидации костных фрагментов по принципу первичного сращения.
Список литературы.
- Ахметьянов Р.Ф. Особенности первичной инвалидности вследствие травм и других внешних воздействий в РФ // Мед.-соц. эксп. и реабил. – 2005. – № 1. – С. 37–40.
- Кувакин В.И. Ретроспективный анализ травматизма и состояния травматолого-ортопедической помощи населению на рубеже ХХ–ХХІ веков /В.И. Кувакин, А.Ж. Чёрный, Т.Н. Воронцова // Вестник российской военно-медицинской академии. – 2013. — № 3(43). – С. 1-5
- Купкенов Д.Э. Применение стержневых аппаратов при диафизарных переломах голени // Травматология и ортопедия России. – 2010. — № 2(56). – С.39-44.
- Петровская Т.С. Биоматериалы и имплантаты для травматологии и ортопедии. / Петровская Т.С., Шахов В.П., Верещагин В.И., Игнатов В.П. // Томск: Издательство Томского политехнического университета, 2011. 307с.
- Попков А.В., .Попков Д.А Накостный персонифицированный биоактивный имплантат для трубчатых костей. Заявка №2016109513 (014997), от 16.03.2016. Положительное решение от 25 июля 2016г.
- Попов В.П., Здрелько В.П., Трухачев И.Г., Попов А.В. Осложнения при накостном остеосинтезе у больных с переломами длинных трубчатых костей. Гений ортопедии, 2014, №2, с. 5-9.
- Татарников М.А. Основные этапы и перспективы реформирования российского здравоохранения // Главврач. — 2006.- № 12.- С. 29-39.
- Твердохлебов С.И., Игнатов В.П., Степанов И.Б., Сивин Д.О., Петлин Д.Г. Гибридный метод формирования биокомпозитов на поверхности имплантатов из нержавеющей стали // Биотехносфера. – 2012. – № 5-6 (23-24). – C. 63–69.
- Тихилов, Р.М. Состояние травматизма и ортопедической заболеваемости взрослого населения Санкт-Петербурга в 2009–2011 гг. и работа травматолого-ортопедической службы города / Р.М. Тихилов [и др.] // Травматология и ортопедия России. – 2012. – № 4. – С.110–119.
- ХанапияевУ.Б. Влияние иммуномодули-на на иммунный статус больных с открытыми переломами костей голени / У.Б. Ханапияев, М.С. Асамов, В.У. Шодиев // Ортопедия, травматолгия и протезирование. — № 3. — С. 82-84.
- Шведовченко И.В. Инвалидность вследствии травм и заболеваний опорно-двигательной системы и пути ее профилактики в Российской федерации /Шведовченко И.В.,Шестаков В.П.,Лебедева Н.Н., Никитченко И.И.,Свинцов А.А.//Сборник тезисов IX съезда травматологов-ортопедов России. -2010, Том 3, с. 1043-1044.
- Barrere F., van der Valk C.M., Dalmeijer R.A. et al. Osteogenecity of octacalcium phosphate coatings applied on porous metal implants // J. Biomed. Mater. Res. – 2003. – Vol. 66A. – P. 779–788.
- Helfet D.L. tt al. AO philosophy and principles of fracture managmentits evolution and evaluatijn. J. Bone Joint Surg. Am. 85- A:1156, 2003.
- Perren S.M., Matter P. Evolution of AO philosophy. Acta Chir. Orthop. Traumatol. Cech. 70:205, 2003.
- I. Tverdokhlebov, E.N. Bolbasov, E.V. Shesterikov, A.I. Malchikhina, V.A. Novikov, Y.G. Anissimov. Research of the surface properties of the thermoplastic copolymer of Vinilidene Fluoride and Tetrafluoroethylene modified with radio-frequency magnetron sputtering for medical application // Applied surface science –- 2012 — Vol. 263 – pp. 187-194.
- Smith W. R. Травма нижней конечности/ W. R. Smith, P. F. Stahel, S. J. Morgan, P. G. Trafton //Травма: в 3 т./ под ред. Дэвида В. Феличано, Кеннэта Л. Маттокса, Эрнеста Е. Мура ; пер. с англ. под ред. Л. А. Якимова, Н. Л. Матвеева. — М.: Изд-во Панфилова ; Бином, 2013. — Т. 2, гл. 43. — C. 1121-1162.
- Yuan H., van den Doel M., Li S.H. et al. A comparison of the osteoinductive potential of two calcium phosphate ceramics implanted intramuscularly in goats // J. Mater. Sci. Mater. Med. – 2002. – Vol. 13. – P. 1271–1275.[schema type=»book» name=»ОСТЕОИНТЕГРАЦИЯ БИОАКТИВНОГО ИМПЛАНТАТА ПРИ НАКОСТНОМ ОСТЕОСИНТЕЗЕ» description=»Целью данного исследования является обоснование оптимального вида и структуры накостного имплантата для его быстрой остеоинтеграции, а, следовательно, и сокращения сроков консолидации перелома кости. При экспериментальном исследовании на 10 беспородных собаках осуществляли накостный остеосинтез большеберцовой кости пластинами выполненными из титано-вого сплава (Ti6Al 4V) толщиной 1,0 мм: пластины имели сплошную или пористую структуру, сравнивали процесс остеоинтеграции при отсутствии биоактивного покры-тия и при наличии гидроксиапатита (ГА) на поверхности имплантата Пластины фиксировали к большеберцовой кости под надкостницей. Рентгенологические и анатомические исследования показали, что процесс остеоинте-грации пористого имплантата с биоактивным покрытием активно начинается через 7-14 дней образованием грануляционной,а через 28 дней мощный слой кости покрывает всю площадь имплантата, обеспечивая стабильный остеосинтез. Вывод. Фиксация пористых имплантатов с биоактивным покрытием под надкостницу обеспечивает стимуляцию репаративного остеогенеза и быструю остеоинтеграцию им-плантата для консолидации костных фрагментов по принципу первичного сращения.» author=»Попков Арнольд Васильевич, Кононович Наталья Андреевна» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-01-16″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_30.10.16_31(1)» ebook=»yes» ]

