В медицинской практике широко применяются лекарственные препараты на основе растительного сырья, содержащего антраценпроизводные [1, с. 269; 2, с. 880; 3, с. 463], причем наиболее популярным источником являются два вида кассии (сенна) — кассия остролистная (Сassia acutifolia Del.), или сенна александрийская (Senna alexandrina Mill.) и кассия узколистная (Cassia angustifolia Vahl.). Слабительное действие препаратов листьев кассии (отвар, сенадексин, глаксена и др.) обусловливают антраценпроизводные, представленные сеннозидами А, B, C, D, глюко-реином, глюко-алоэ-эмодином, реином, диреином [2, с. 880; 3, с. 463]. Среди сопутствующих веществ известны флавоноиды, в частности, кемпферол-3-O-гентиобиозид, а также производные нафталина — 8-О-β-D-глюкопиранозид торахризона и др. [5, с. 261]. Несмотря на высокую степень изученности химического состава листьев кассии, противоречивой остается информация относительно трактовки доминирующих компонентов. Так, в некоторых работах отмечается, что доминирующими веществами являются сеннозиды А, B, C и D [4, с. 291], в других работах — кемпферол-3-O-гентиобиозид [5, с. 261], а в отдельных литературных источниках – реин [7, с. 42]. Видимо, именно это обстоятельство является причиной того факта, что до сих пор не сложились единые подходы к стандартизации листьев кассии, а в существующих подходах к анализу не в полной мере используется все разнообразие химического состава сырья кассии [8, с. 97].
Целью настоящей работы является изучение компонентного состава доминирующих веществ листьев кассии остролистной.
В результате исследования компонентного состава листьев кассии выделены три доминирующих вещества — 8-О-β-D-глюкопиранозид торахризона (1) (производное нафталина), кемпферол-3-O-гентиобиозид (2) (флавоноид) и 1,7-дигидрокси-3-карбоксиантрахинон (3) (антрахинон).
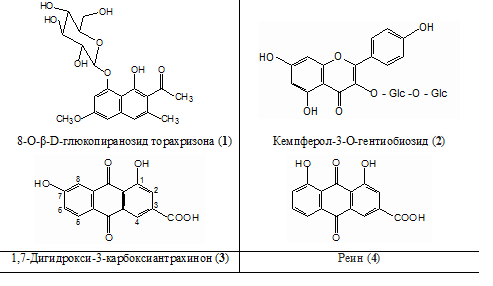
С использованием ТСХ обнаружено, что именно соединения 1-3 являются доминирующими компонентами листьев сенны. На наш взгляд, обнаружение методом ТСХ соединений 1-3, диагностически значимых для листьев сенны, является перспективным подходом в плане идентификации сырья и препаратов данного растения. Это тем более важно, что в силу невысокого содержания сеннозида А и В в листьях кассии [5, с. 261], определение данных соединений методом ТСХ весьма проблематично. Этот вывод согласуется с результатами исследований зарубежных ученых [7, с. 42], в соответствии с которыми доминирующим антраценпроизводным листьев кассии является реин (4). При этом обращает на себя внимание тот факт, что, по нашим данным, доминирующим антраценпроизводным соединением листьев кассии является не реин (4), а близкий к нему по хроматографической подвижности, физико-химическим и спектральным характеристикам антрахинон — 1,7-дигидрокси-3-карбоксиантрахинон (3). Этот вывод сделан на основании данных 1Н-ЯМР-спектра 1,7-дигидрокси-3-карбоксиантрахинона (3): наличие при 11,91 м.д. одного уширенного синглетного сигнала, принадлежащего 1-ОН-группе, в сочетании с характером сигналов ароматических протонов при С-5, С-6 и С-8. По литературным данным, в 1Н-ЯМР-спектре реина характерными являются два синглетных сигнала в области 12,0 м.д. и 11,9 м.д. 1-ОН-группы и 8-ОН-группы [6, с. 217]. Структура соединения 3 подтверждается также и данными 13С-ЯМР-спектра, в котором обнаруживаются сигнал С-1 при 160.99 м.д. и сигнал С-8 при 124.03 м.д.
К доминирующим фенольным компонентам относятся также 8-O-β-D-глюкопиранозид торахризона (1) и кемпферол-3-О-гентиобиозид (2), которые, на наш взгляд, имеют диагностическое значение в плане идентификации сырья кассии. Интересно, что, по данным зарубежных ученых, и в условиях ВЭЖХ кемпферол-3-О-гентиобиозид (2) является доминирующим соединением [5, с. 261].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объектом исследования служил промышленный образец листьев сенны (ОАО «Красногорсклексредства», производящее растение которого идентифицировано как кассия остролистная. Препаративное выделение веществ осуществляли из листьев кассии остролистной с использованием колоночной хроматографии. Воздушно-сухое сырье (100 г) подвергали исчерпывающему экстрагированию 70 % этиловым спиртом, сочетая при этом способ мацерации (24 ч) с последующей экстракцией при температуре 85-90 оС. Водно-спиртовые экстракты упаривали под вакуумом до густого остатка (около 30 мл). Сгущенный экстракт высушивали на силикагеле L 40/100 и полученный порошок (экстракт + силикагель) наносили на слой силикагеля, сформированный в хлороформе. Хроматографическую колонку элюировали хлороформом и смесью хлороформ-этиловый спирт в различных соотношениях (99:1; 97:2; 97:3; 95:5; 93:7; 90:10; 85:15; 80:20; 70:30, 60:40, 50:50). Контроль за разделением веществ осуществляли с помощью ТСХ-анализа на пластинках «Сорбфил ПТСХ-АФ-А-УФ» в системах хлороформ-этанол (9:1), хлороформ-метанол-вода (26:14:3), а также н-бутанол-ледяная уксусная кислота-вода (4:1:2). Фракции, содержащие вещества 1-3, с целью их выделения подвергали рехроматографированию на колонке с силикагелем L 40/100 с использованием смеси хлороформ-этиловый спирт в градиентном режиме. Окончательную очистку вещества 3 осуществляли рехроматографией на колонке с полиамидом «Woelm» (Германия), элюируя смесями воды и этилового спирта в различных соотношениях, а затем водным раствором гидрокарбоната натрия с последующим осаждением целевого соединения из элюата подкислением 10 % раствором хлороводородной кислоты до слабокислой среды (рН около 6,0).
Cпектры ЯМР 1Н и ЯМР 13С получали на приборе «Bruker AM 300», масс-спектры снимали на масс-спектрометре «Kratos MS-30», регистрацию УФ-спектров проводили с помощью спектрофотометра «Specord 40» (Analytik Jena).
8-O-β-D-глюкопиранозид торахризона (1,8-дигидрокси-6-метокси-2-ацетил-3-метилнафталин) (1). Аморфное вещество светло-желтого цвета состава С20Н24О9. Масс-спектр (70 eV, 200 оС, m/z, %): М+ 408 (18%), М+ агликона 246 (82 %), М+ агликона –СН3 231 (100 %), 217 (28 %), lmax EtOH: 241, 265пл, 332пл, 344 нм. Cпектр ЯМР 1Н (300 МГц, ДМСО-d6, δ, м.д., J/Гц): 2.25 (3Н, с, ароматическая СН3 при С-3), 2.53 (3Н, с, СОСН3 при С-2), 4.01 (3Н, с, ароматическая ОСН3-группа при С-6), 3.1-4.5 (6Н глюкопиранозы), 5.02 (1Н, д, 7 Гц, Н-11 глюкопиранозы), 6.92 (1Н, д, 2 Гц, Н-7), 7.05 (1Н, с, Н-4), 6.70 (1Н, д, 2 Гц, Н-5), 9.58 (1H, c, ОН-группа при С-1).
Кемпферол-3-О-гентиобиозид (3-О-гентиобиозид 3,5,7,41—тетрагидроксифлавона) (2). Светло-желтое кристаллическое вещество состава С27Н30О16 с т.пл. 174-177 oС (водный спирт). Масс-спектр (70 eV, 200 оС, m/z, %): 286 (М+ агликона, 100 %), 153 (15), 121 (22), lmax EtOH: 269, 350 нм; + NaOAc 274, 368 нм; + NaOAc + H3BO3 272, 355 нм; +А1С13 и +А1С13 + HCl 275, 305, 395 нм. 1Н-ЯМР-спектр (300 МГц, ДMСO-d6, δ, м.д., J/Гц): 12.58 (1Н, с, 5-ОН), 8.03 (2H, д, 9 Гц, Н-21,61), 6.87 (2Н, д, 9 Гц, Н-31,51), 6.42 (1H, д, 2.5 Гц, Н-8), 6.20 (1H, д, 2.5 Гц, Н-6), 5.35 (1H, д, 7 Гц, Н-111 глюкозы), 4.03 (1H, д, 7 Гц, Н-1111 глюкозы), 3.10-5.2 (м, 12Н глюкозы).
1,7-дигидрокси-3-карбоксиантрахинон (неореин) (3). Кристаллы оранжевого цвета состава С15Н8О6, масс-спектр (70 eV, 200 оС, m/z, %): М+ 284 (100 %), 256 (7), 254 (26), 239 (32), т.пл. 305-308 оС (водный спирт), lmax EtOH 234, 264, 433 нм. 1Н-ЯМР спектр (300 МГц, ДМСО-d6, δ, м.д., J/Гц): 11.91 (1H, c, ОН-группа при С-1), 8.16 (1Н, уш. с, Н-2), 7.85 (1Н, д, 9 Гц, Н-6), 7.80 (1Н, уш. с, Н-4), 7.78 (1Н, д, 1 Гц, Н-8), 7.42 (1Н, д, 9 Гц, Н-5). Спектр 13С-ЯМР (75.47 МГц, ДMСO-d6, δ, м.д.): 191.35 (3-COOH), 183.24 (C-9), 181.05 (C-10), 165.36 (C-3, C-7), 160.99 (C-1), 137.54 (C-6), 133.83 (C-10a), 133.27 (C-4a), 124.51 (C-5), 124.03 (C-2, C-8), 119.39 (C-4), 118.79 (C-8a), 116.22 (C-9a).
Таким образом, в результате изучения компонентного состава листьев кассии остролистной выделены и охарактеризованы с использованием 1Н-ЯМР-, 13С-ЯМР-, УФ-спектроскопии и масс-спектрометрии известные для исследуемого растения 8-О-β-D-глюкопиранозид торахризона (1) и кемпферол-3-O-гентиобиозид (2) [5, с. 261], а также антраценпроизводное, названное нами неореином (3), который является новым природным соединением и имеет строение 1,7-дигидрокси-3-карбоксиантрахинона.
Список литературы
- Государственная фармакопея СССР. Общие методы анализа. Лекарственное растительное сырье. МЗ СССР. 11 изд. М.: Медицина, 1990. Вып. 2. 400 с.
- Куркин В.А. Фармакогнозия: учебник для студентов фармацевтических вузов (факультетов). 2-е изд., перераб. и доп. Самара: «Офорт»; ГОУ ВПО «СамГМУ Росздрава», 2007. 1239 с.
- Куркин В.А. Основы фитотерапии: Учебное пособие для студентов фармацевтических вузов. Самара: ООО «Офорт»; ГОУ ВПО «СамГМУ Росздрава», 2009. 963 с.
- Dave H., Ledwani L. A review on anthraquinones isolated from Cassia species and their applications // Indian Journal of Natural Products and Resources. Vol. 3, No. 3. P. 291-319.
- Demirezer L.O., Karahan1 N., Ucakturk E., Kuruuzum-Uz A., Guvenalp , Kazaz C. HPLC Fingerprinting of Sennosides in Laxative Drugs with Isolation of Standard Substances from Some Senna Leaves // Rec. Nat. Prod. 2011. Vol. 5, No. 4. P. 261-270.
- Liu R., Li A., Sun A. Preparative isolation and purification of hydroxyanthraquinones and cinnamic acid from the Chinese medicinal herb Rheum officinale B by high-speed counter-current chromatography // Journal of Chromatography A. 2004. Vol. 1052. P. 217–221.
- Sakulpanich A., Gritsanapan W. Determination of Anthraquinone Glycoside Content in Cassia fistula Leaf Extracts for Alternative Source of Laxative Drug // International Journal of Biomedical and Pharmaceutical Sciences. Vol. 3, No. 1. P. 42-45.
- Upadhyay A. Chandel Yo., Nayak P.S., Khan A. Sennoside contens in Senna (Cassia angustifolia Vahl.) as influenced by date of leaf picking, packaging material and storage period // Journal of Stored Products and Postharvest Research. 2011. Vol. 2, No. 5. P. 97-103.[schema type=»book» name=»НЕОРЕИН — НОВЫЙ АНТРАХИНОН ЛИСТЬЕВ СASSIA ACUTIFOLIA » description=» АННОТАЦИЯ Из листьев сенны, или кассии остролистной (Сassia acutifolia Del.) выделены и охарактеризованы с использованием 1Н-ЯМР-, 13С-ЯМР-, УФ-спектроскопии и масс-спектрометрии известные вещества — 8-О-β-D-глюкопиранозид торахризона и кемпферол-3-O-гентиобиозид, а также новое природное соединение — 1,7-дигидрокси-3-карбоксиантрахинон (неореин).» author=»Куркин Владимир Александрович, Шмыгарева Анна Анатольевна» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-03-10″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_27.06.2015_06(15)» ebook=»yes» ]

