В последнее время исследования в области бензимидазолов привлекают все большее внимание, обусловленное широким спектром их практического применения в качестве высокоэффективных антиоксидантов [5, с. 1481].
Синтез «гибридных» молекул потенциальных антиоксидантов, обладающих определенным набором полезных свойств, в том числе проявляющих антиоксидантую активность вызывает несомненный интерес [6, с. 42]. Нам представлялось интересным объединить в одной органической молекуле известный фармакофор, в частности, фрагмент экранированного фенола с молекулой бензимидазола [2, с. 663].
Ранее были синтезированы узкие реакционные серии в ряду бензимидазола с фрагментом пространственно-затрудненного фенола и изучены их окислительно–восстановительные свойства [1, с. 446]. В продолжение исследований в этой области в настоящей работе сообщается о получении 1– (3,5–ди–трет–бутил–4–гидроксифенил) –2–арилбензимидазолов (1–7) и изучении их антиоксидантной активности (рис.1).
Репрезентативый ряд производны бензимидазола с фрагментом экранированного фенола был синтезирован кипячением эквимолекулярных количеств 2,6–ди–трет–бутил–п–бензохинонимина с соответствующими ароматическими альдегидами в безводном толуоле в течение 2 часов при 200 0 С с выходами целевых продуктов 70–80 % [4, с.78].
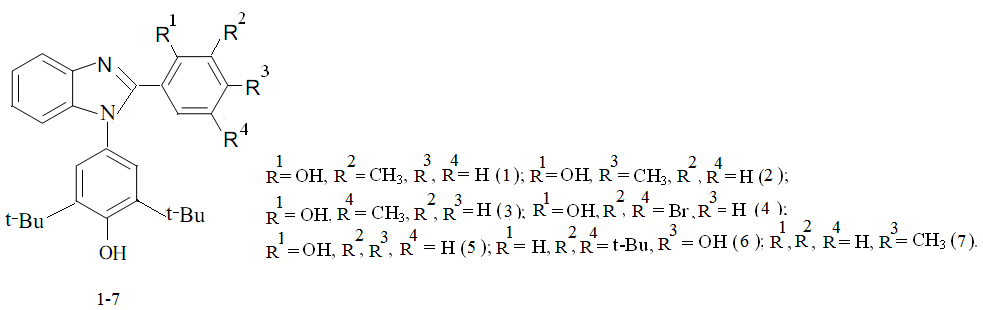
Рис.1. Бензимидазолы с фрагментом экранированного фенола (1-7)
Полученные соединения являются кристаллическими веществами белого или белого с кремоватым оттенком цвета. Не растворимы в воде, растворимы в органических растворителях – ДМФА, ацетонитриле. Строение продуктов доказано методами ИК– и ЯМР 1Н– спектроскопии, а также элементным анализом. ЯМР 1Н cпектры синтезированных соединений записаны на Фурье-спектрометре фирмы Varian Unity (рабочая частота 300 МГц) в CDCl3 (дейтерированном хлороформе), внутренний стандарт – тетраметилсилан (ТМС). Расчет химических сдвигов протонов вели по шкале δ, м.д.. ИК-спектры сняты на двухлучевом спектрофотометре Specord М-80 в таблетке безводного KBr. Определение массовой доли углерода, водорода, азота проводили на автоматическом анализаторе «CHN», модели ЕА 1108, фирмы «Carlo Erba Instruments» (Италия). Ход реакций и чистоту соединений контролировали методом ТСХ на пластинах «Silufol UV–254» в системе бензол-этанол (4:1), проявитель – пары йода. Статистическую обработку данных проводили с использованием пакета программ Statistica 6,0 (StatSoft, США) и Excel 2007 (MS Office 2007, США) с применением парного критерия Стьюдента (t).
В ИК–спектрах соединений (1–7), снятых в таблетке безводного KBr имеются характеристические полосы валентных колебаний неассоциированной (ν 3600 см -1) и ассоциированной (ν 3400 см -1) групп О–Н, полосы валентных колебаний С–Н связей ароматического кольца (ν 3000–3050 см -1), полосы валентных ассиметричных и симметричных колебаний С–Н связей трет-бутильных групп (ν 3000–2850 см -1). Присутствуют также полосы валентных колебаний полуторных С–С связей ароматического кольца (ν 1600,1580,1500 см-1), полосы валентных колебаний >C=С< связей (ν 1663–1660 см -1), полосы поглощения деформационных колебаний С–Н связей ароматических колец (δ 900–750 см -1) полосы поглощения деформационных колебаний С–Н связей трет-бутильных групп (δ 1395–1385 см -1). В спектрах ЯМР1Н синтезированных соединений имеется синглет протонов тре–—бутильных групп (δ 1.38 м.д.); синглет протона гидроксильной группы (δ 5.80), исчезающий при добавлении D2O; сигналы ароматических протонов (δ 7.2–7.9 м.д.). Физико-химические и спектральные характеристики представлены в табл. 1.
Таблица 1.
Физико-химические характеристики исследуемых соединений
| №
п/п
|
Т.пл.,
о С |
Выход, % | Найдено, % | Брутто-формула |
Вычислено, % |
||||
| C | H | N | C | H | N | ||||
| 1 | 197–199 | 74.5 | 77.14 | 9.60 | 6.55 | C28H41N2O2 | 76.89 | 9.38 | 6.41 |
| 2 | 203–205 | 70.0 | 77.02 | 9.63 | 6.58 | C28H41N2O2 | 76.89 | 9.38 | 6.41 |
| 3 | 193–195 | 72.0 | 77.12 | 9.51 | 6.77 | C28H41N2O2 | 76.89 | 9.38 | 6.41 |
| 4 | 205–207 | 72.4 | 56.03 | 6.28 | 5.09 | C27H36N2O2Br2 | 55.86 | 6.21 | 4.83 |
| 5 | 199–201 | 80.0 | 77.25 | 8.85 | 7.03 | C27H36N2O2 | 77.14 | 8.57 | 6.67 |
| 6 | 216–218 | 74.5 | 78.85 | 10.39 | 5.48 | C35H54N2O2 | 78.65 | 10.11 | 5.24 |
| 7 | 202–204 | 76.0 | 78.01 | 10.20 | 6.76 | C28H42N2O | 77.78 | 9.95 | 6.64 |
Антиоксидантная активность (АОА) определялась по модифицированной методике с использованием двух тест–систем, содержащих комплекс насыщенных и ненасыщенных жирных кислот кукурузного масла, в которых индукция перекисного окисления (ПОЛ) инициировалась физическими (ультрафиолетовое облучение) и химическими (система Фентона Fe2+/H2O2) индукторами свободно-радикальных процессов [3, с. 558]. В качестве препаратов сравнения использовались ионол (дибунол) и убихинон (кофермент Q10). Активность выражалась в универсальных (убихиноновых) единицах. Оптическую плотность раствора измеряли на SF –46 при длине волны 450 и 532 нм (где 450 нм соответствует максимуму оптической плотности промежуточных продуктов перекисного окисления – диеновые конъюгаты, а 532 нм — максимуму оптической плотности конечных продуктов перекисного окисления – малоновый диальдегид).
В результате предварительного анализа в обеих тест-системах была выявлена оптимальная биологическая концентрация — 1,0 ∙10-3 моль/л. Расчет степени ингибирования проводили по формуле (1):
% ING = 100 – (I0/ IK ∙ 100) (1)
где: –I0 – оптическая плотность опыта (450+532), ОЕ;
IK – оптическая плотность контроля (450+532), ОЕ.
АОА выражали в убихиноновых единицах (Q-ед), используя формулу (2):
АОА (Q-ед) = % INGi – % INGQ (2)
где: –% INGi – процент уменьшения образования в тест-системе продуктов, реагирующих с ТБК, в присутствии тестируемого синтетического образца; % INGQ – процент уменьшения образования в тест-системе продуктов, реагирующих с ТБК, в присутствии убихинона.
Антиокислительная активность убихинона во всех тест–системах была принята равной 100% или 1,0 убихиноновой единице. В тест–системе УФО/Fe2+ убихинон ингибирует ПОЛ на 11% (1,0); дибунол – на 39% (3,5).
В ряду производных 1–(3,5ди–трет–бутил–гидроксифенил)–2–арилбензимидазолов (1–7) доля высокоактивных соединений составила 85,7 % (6/7). Сравнивая АОА исследуемых соединений (1–7) и веществ – сравнения – убихинона и дибунола, установлено, что соединения (1–6) ингибируют свободно-радикальные процессы на 58–67%, превышая антиоксидантный эффект в той же системе у веществ – сравнения – убихинона и дибунола. У соединения (7) относительно низкое значение АОА, что, по-видимому, объяснятся отсутствием гидроксильной группы. Другие тестируемые образцы этого ряда проявили разновыраженный антиоксидантный эффект (табл.2).
Таблица 2.
Антиоксидантная активность соединений (1-7) и веществ- сравнения в тест-системе с УФО/ Fe 2+ (M ±m; n= 5)
| № соединения | Концентрация, моль/л | Оптическая плотность | АОА, %
(Q-ed) |
|
| λ= 450 нм | λ=532 нм | |||
| 1 | 1,0 ∙10-3 | 0,276±0,002 | 0,074±0,003 | 65,0 (5,9) |
| 2 | 1,0 ∙10-3 | 0,284±0,002 | 0,116±0,003 | 60,0 (5,4) |
| 3 | 1,0 ∙10-3 | 0,282±0,003 | 0,108±0,003 | 61,0 (5,5) |
| 4 | 1,0 ∙10-3 | 0,278±0,003 | 0,082±0,003 | 64,0 (5,8) |
| 5 | 1,0 ∙10-3 | 0,0274±0,005 | 0,056±0,005 | 67,0 (6,1) |
| 6 | 1,0 ∙10-3 | 0,287±0,004 | 0,133±0,004 | 58,0 (5,3) |
| 7 | 1,0 ∙10-3 | 0,412±0,003 | 0,298±0,003 | 29,0 (2,6) |
| Убихинон | 1,0 ∙10-3 | 0,460±0,003 | 0,430±0,001 | 11,0 (1,0) |
| Дибунол | 1,0 ∙10-3 | 0,391±0,005 | 0,219±0,002 | 39,0 (3,5) |
В ходе исследования АОА исследуемых соединений в тест-системе с применением химических (перекись водорода и сульфат железа (II) – система Фентона Fe2+/H2O2 индукторов свободнорадикальных процессов установлено, что максимальный ингибирующий эффект наблюдался также в присутствии соединений (1–6) – 56–64 %. Соединение (7) так же проявило менее выраженный эффект. В системе Фентона наблюдалось заметное снижение антиоксидантного действия у всех тестируемых образцов, что свидетельствует о меньшей устойчивости описываемых соединений к химическим индукторам свободно–радикальных процессов (табл.3).
Таблица 3.
Антиоксидантная активность соединений (1-7) и веществ сравнения в тест-системе с H2O2 / Fe 2+ (M ±m; n= 5)
|
№ соединения |
Концентрация, моль/л | Оптическая плотность |
АОА, % (Q-ed) |
|
| λ= 450 нм | λ=532 нм | |||
| 1 | 1,0 ∙10-3 | 0,278±0,003 | 0,082±0,002 | 64,0 (4,0) |
| 2 | 1,0 ∙10-3 | 0,323±0,001 | 0,107±0,001 | 57,0 (3,6) |
| 3 | 1,0 ∙10-3 | 0,321±0,001 | 0,099±0,001 | 58,0 (3,6) |
| 4 | 1,0 ∙10-3 | 0,281±0,003 | 0,109±0,006 | 61,0 (3,8) |
| 5 | 1,0 ∙10-3 | 0,280±0,02 | 0,090±0,01 | 63,0 (3,9) |
| 6 | 1,0 ∙10-3 | 0,326±0,001 | 0,114±0,001 | 56,0 (3,5) |
| 7 | 1,0 ∙10-3 | 0,429±0,001 | 0,351±0,001 | 22,0 (1,4) |
| Убихинон | 1,0 ∙10-3 | 0,450±0,003 | 0,390±0,001 | 16,0 (1,0) |
| Дибунол | 1,0 ∙10-3 | 0,398±0,005 | 0,237±0,002 | 36,5 (2,3) |
Таким образом, антиоксидантные свойства изучаемых соединений усиливаются при наличии в их структуре гетероциклической системы бензимидазола, сопряженной с фрагментом пространственно–затрудненного фенола. Отдельные радикалы в различных положениях ароматического кольца, сопряженного с гетероциклом, могут усиливать донорно–акцепторные свойства данного ряда соединений. Так, сопряжение гетероциклического кольца производных бензимидазолов в сочетании с фенилом, замещенным фенилом (2-2–гидроксифенилом, гидрокси–3,5–дибромфенилом, трет-бутильной группой) приводит к появлению высокой АОА у изучаемых соединений.
Список литературы:
1.Хубаева Т.О. Синтез и электрохимические свойства производных пространственно– затрудненных фенолов и радикалов на их основе. / Т.О. Хубаева [и др.] // Журнал общей химии. – 2012. – Вып. 82. №3. – С.446 – 454.
2.Хубаева Т.О. 1(3,5-ди-трет-бутил-4-гидроксифенил)-2-арилбензимидазолы: синтез, свойства, перспективы. / Т.О. Хубаева // Вестник Башкирского университета. – 2011. – Т.16. №3. – С. 663 – 667.
3.Кемелева Е.А. Новые перспективные антиоксиданты на основе 2,6–диметилфенола. / Е.А. Кемелева [и др.] //Биоорган. химия. – 2008. Т. 34. Вып. 4. – С.558–569.
4.Пожарский М.В. Практические работы по химии гетероциклов. / М.В. Пожарский [и др.]. – Ростов – на Дону: изд– во РГУ. – 1988. – С. 78.
- Хубаева Т.О. Исследование антиоксидантной активности в области 1-(3,5-ди-трет-бутил-4-гидроксифенил)-2-арилбензимидазолов / Т.О. Хубаева. [и др.] // Журнал общей химии. – 2013.- Т. 83. Вып. 9. – С. 1481– 1485.
- Хубаева Т.О. Синтез, свойства и антиоксидантная активность производных бензимидазола с фрагментом пространственно-затрудненного фенола / Т.О. Хубаева. [и др.] // Вестник Воронежского гос. ун– та. Серия: Химия. Биология. Фармация. – 2014. – №3. – С. 42– 47.[schema type=»book» name=»ИССЛЕДОВАНИЯ В ОБЛАСТИ ПОТЕНЦИАЛЬНЫХ АНТИОКСИДАНТОВ – ПРОИЗВОДНЫХ БЕНЗИМИДАЗОЛА С ФРАГМЕНТОМ ЭКРАНИРОВАННОГО ФЕНОЛА» author=»Хубаева Тамара Отаровна, Хубаева Изабелла Владимировна» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-06-16″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_ 30.12.2014_12(09)» ebook=»yes» ]

