Предисловие
Фундаментальные Законы природы в нашем 3-мерном Мире квадратичны. Наиболее яркие примеры таких законов: Закон всемирного тяготения масс Ньютона, Закон электрического взаимодействия Кулона, Закон интенсивности света. Периодический Закон Д.И. Менделеева, безусловно, является фундаментальным Законом природы и математически он также может выражаться квадратичной формой.
Однако, на сегодня у Периодического Закона Д.И. Менделеева нет общепринятых математических выражений, охватывающих все химические элементы. Есть только табличные представления, причём, несовершенных форм. Цель данного исследования в том, чтобы найти и представить математическую формулу с соответствующей ей формой воплощения Периодического Закона химических элементов.
Диадно-Периодическое распределение квадратов четных чисел
Возьмём ряд квадратов четных чисел (2n)2 при n = 1, 2, 3, 4:
(2n)2 = 4; 16; 36; 64 (1)
Перепишем (1) в виде:
2(2n2) = 2(2; 8; 18; 32) (2)
Получились некие числовые сдвоенности – диады из монад числовой последовательности: 2; 8; 18; 32. Общее количество K можно выразить:
K = 2Σ2n2 = 2(2 + 8 + 18 + 32 + …) (3)
Все члены слагаемых суммы (3) можно развернуть в таблицу с последовательной нумерацией натуральными числами, слева направо по горизонталям монад диад-периодов n, возрастающих сверху вниз:

Рисунок 1. Диадно-Периодическая Таблица пронумерованного множества
квадратов чётных чисел.
Числа от 100 изображены только единичными и десятичными разрядами, а также окрашены в тёмно-коричневый цвет. Таблица представлена 4-мя диадами.
Диадно-Периодическое распределение химических элементов
Известна Периодическая Таблица химических элементов по Жанету, предложенная им ещё в 20-х годах XX-го века.
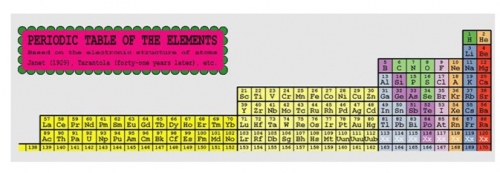
Рисунок 2. Периодическая Таблица химических элементов
по Жанету
Таблица Жанета состоит из 4-х полных диад с известными в его время химическими элементами. В первой диаде две монады по 2 элемента: H, He в верхней монаде, и Li, Be в нижней монаде. Конфигурация этой Периодической Таблицы совпадает с конфигурацией рисунка 1. Однако, верхнее положение с типозадающей функцией химически инертного Гелия в группе с остальными химически очень активными щелочноземельными металлами вызывало сомнения, и в научно-образовательной системе этой таблицей почти не пользуются.
Но положение Гелия, являющегося s-элементом с двумя внешними s-электронами, в одной группе с щелочноземельными металлами также с двумя внешними s-электронами научно оправдано. Благородные газы, от Ne до Rn, являются p-элементами и в Таблице Жанета они справедливо отделены от Гелия. С учётом этих обстоятельств Систематизация химических элементов по Жанету вполне оправдывается, и имеет право не только на существование, но и на широкое признание с всеобщим принятием.
На рисунке 3 представлена Диадно-Периодическая [1, с.70] Таблица по типу Таблицы версии Жанета с ныне известными химическими элементами.

Рисунок 3. Периодическая Таблица типа Жанета с ныне известными
химическими элементами.
Поскольку элементы 119-й и 120-й ещё не обнаружены и не синтезированы, они представлены числами. Гелий, принадлежащий к красному блоку s-элементов оцвечен черным-красным (тёмно-коричневым) цветом с тем, чтобы заострить внимание на его крайнюю химическую инертность как по первому горизонтальному ряду (первой монаде) первого периода (диаде), так и по крайнему правому вертикальному столбцу (группе).
В остальном видна стройная закономерная последовательность s-, p-, d-, f-блоков химических элементов справа налево. Такое 32-х групповое воплощение системы химических элементов, несомненно, логичнее и эстетичнее 18-группового, тем более YIII-группового воплощений системы химических элементов. Ступеньки диад закономерно увеличиваются по ширине на 6, 10, 14 столбцов-групп, составляя ряд ширин: 2, 6, 10, 14 – числовой s-, p-, d-, f-ряд. В этом чётко прослеживается простая математическая закономерность в распределении химических элементов. Ведь, удвоенный ряд: 4, 12, 20, 28 представляют не что иное, как количества последовательно появляющихся и закрепляющихся s-, p-, d-, f-элементов в каждой диаде при последовательном ступенчатом переходе от блока к блоку, начиная с s-блока.
По поводу сомнений в типозадающем положении Гелия над Бериллием можно отметить, что они не только по отношению к Гелию, но и по отношению к Водороду. Разве Водород является щелочным металлом? Конечно же, нет. И вообще в металлической форме сумели получить лишь недавно в особых условиях, причём, в виде следов на поверхности другого материала, а не массивных слитков щелочно-металлического Водорода. Такова уж особенность двух первых типозадающих s-элементов. Последующие типозадающие элементы не так сильно выделяются в своих гомологических группах элементов-аналогов. Связано это с тем, что Водород и Гелий имеют только одну электронную оболочку, тогда как другие типозадающие элементы имеют, по меньшей мере, две электронные оболочки (p-элементы). Чем больше электронных оболочек, тем менее выделяются типозадающие элементы на фоне аналогов. В f-блоке между типозадающими лантаноидами и последующими актиноидами различия физико-химических свойств незначительные.
Все s-, p-, d-, f-блоки представляются собственными компактными участками столбцов-групп элементов-аналогов. Конфигурации рисунков 3 и 1 по четырём диадам совпадают.
Следует заметить, что Диадно-Периодическая Таблица химических элементов, представленная на рисунке 3, по количественно-качественно-эстетическим показателям превосходит Периодическую Таблицу химических элементов, рекомендованную IUPAC.
Во-первых, представлена одной цельной Таблицей, тогда как Таблица IUPAC с отдельно вынесенными лантаноидами и актиноидами фактически состоит из трёх таблиц.
Во-вторых, Периодическая Таблица IUPAC не имеет математической формулы, тогда как Таблица на рисунке 3 имеет строгий математический чётно-квадратичный Закон распределения химических элементов.
В-третьих, Таблица на рисунке 3 не имеет ни одного пустого места, тогда как Таблица IUPAC имеет 36 пустых клеток.
В-четвёртых, Таблица на рисунке 3 имеет закономерно полого изменяющуюся последовательную ступенчатую форму из отдельных компактных блоков s-, p-, d-, f- элементов, тогда как в Периодической Таблице IUPAC в 18-группе s-элемент возглавляет гомологическую группу p-элементов.
Известны две современные формулировки Периодического Закона:
- Свойства химических элементов, а также формы и свойства соединений этих элементов находятся в периодической зависимости от величины заряда ядер их атомов.
- Свойства элементов находятся в периодической зависимости от их порядковых номеров.
В связи с выявлением математически обоснованной Таблицы на рисунке 1, с которой конфигурационно совпадает Таблица на рисунке 3, предпочтительнее формулировка 2. о периодической зависимости свойств элементов от их порядковых номеров.
Общее количество химических элементов в Таблице на рисунке 3 определяется соотношением (3).
Номера N химических элементов заложены в простой чётно-квадратичный Закон:
N = (2n)2 (4)
где n = 1, 2, 3, 4 – номера диад-периодов.
Заключение
Периодический Закон химических элементов выражается простым Законом квадратов чётных чисел и иллюстрируется Диадно-Периодической Таблицей химических элементов.
Литература:
- Сен Гук Ким, Гульнара Мамбетерзина, Дилара Ким. Диадно-периодический Закон Евразийский Союз Ученых. Ежемесячный научный журнал, №30, 2016, часть 4, С. 70-74.[schema type=»book» name=»МАТЕМАТИЧЕСКОЕ НАЧАЛО ПЕРИОДИЧЕСКОГО ЗАКОНА Д. И. МЕНДЕЛЕЕВА» description=»Проблема математизации Периодического Закона решается методом сопоставления суммы квадратов чётных чисел 2n с табличным распределением химических элементов по n диадным периодам. Номера N химических элементов распределяются по n диадным периодам, что позволяет подтвердить периодический закон в формулировке: свойства химических элементов находятся в периодической зависимости от их порядковых номеров» author=»Ким С. Г., Мамбетерзина Гульнара Кенесовна» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-06-06″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_ 30.05.2017_05(38)» ebook=»yes» ]

