[schema type=»book» name=»ИССЛЕДОВАНИЕ ВЛИЯНИя рН И ИОННОЙ СИЛЫ РАСТВОРА НА КИНЕТИЧЕСКИЕ ПАРАМЕТРЫ РЕАКЦИИ ПЕРОКСИДАЗНОГО ОКИСЛЕНИЯ ИОДИД-ИОНОВ » author=»Аронбаев Дмитрий Маркиэлович, Васина Светлана Михайловна» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-06-20″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_ 30.12.2014_12(09)» ebook=»yes» ]
- Введение
Среди катализируемых пероксидазой реакций наиболее важны реакции, связанные с синтезом гормона тироксина, а также реакции окисления токсинов, биологических ядов типа ароматических аминов, фенолов и их производных в биологических защитных механизмах [7,8]. Обе эти функции сопряжены со способностью пероксидазы катализировать реакции галогенирования органических соединений галогенид-ионами.[6]. Так, например присутствие в оптимальных концентрациях перекиси водорода и галогенид-ионов значительно усиливает бактерицидное действие пероксидазы [5,20]. При этом наибольший бактерицидный эффект наблюдается в присутствии иодид-ионов.
Несмотря на то, что реакция пероксидазного окисления иодидов перекисью водорода считается хорошо изученной [1-3] , остается не мало вопросов по применению этой реакции в аналитической химии, для определения активности как самого фермента, так и веществ, ингибирующих эту реакцию [15,18,19]. Если же учесть, что медиаторная система иод-иодид является электрохимически хорошо обратимой, то ее использование в конструировании аналитических систем, датчиков и биосенсоров может показаться весьма перспективной [13,14,19]. Наиболее важными факторами, влияющими на функционирование аналитической системы с участием пероксидазы, являются условия сопряжения ферментативной и медиаторной реакций, позволяющих получить аналитический сигнал [12]. И в этом случае, помимо подбора оптимальных концентраций субстратов, необходимо учитывать влияние рН и ионной силы раствора на максимальную скорость протекания ферментативной реакции.
Целью настоящей работы является исследование влияния рН и ионной силы раствора на пероксидазное окисление иодид-ионов перекисью водорода.
- Материалы и методы
Для исследования использовали пероксидазу хрена фирмы “Reanal” (Венгрия) с RZ 0,6. Иодид калия марки осч, 30% -ную перекись водорода марки осч. “Sigma-Aldrich” (Германия). буферные растворы готовили из фиксаналов кислот 0,1 н. и реагентов квалификации «хч» в соответствии с методиками [4]. Использовали бидистиллированную с удельной электропроводностью 0,02 мСм/м. Ионную силу раствора регулировали добавлением хлористого калия. Концентрацию пероксидазы и перекиси водорода определяли спектрофотометрически с учетом их коэффициентов молярного поглощения (экстинции): для пероксидазы хрена (HRP) ελ 403 нм = 9,5·104 М-1см-1 и для перекиси водорода ελ 230 нм = 72,7 М-1см-1 [ 17 ].
Спектрофотометрические исследования кинетики снимали с использованием спектрофотометра ‘Specord — UV-Vis” (Германия) и спектрофотометра СФ-46 (ЛОМО) с подключенным к нему регистрирующим потенциометром КСП-4. Измерение рН проводили с помощью иономера И-130М со стеклянным рН электродом марки ЭСЛ-63Г и хлорсеребряного электрода сравнения ЭВЛ1-М3 при автоматической термокомпенсации. Эксперимент состоял в следующем: в кварцевую кювету с l=10.0 мм последовательно вносили 2,7 мл смеси растворов иодида калия и пероксидазы в соответствующем буфере с определенным значением рН и 0,3 мл перекиси водорода в том же буфере. Смесь перемешивали и регистрировали скорость изменения оптической плотности раствора при λ= 353 нм. Для учета фоновой реакции параллельно снимали кинетику реакции в отсутствии фермента.
Все измерения проводили в той области, где начальная скорость реакции прямо пропорциональна концентрации пероксидазы (0,25 – 1,0 нМ).
- Результаты и их обсуждение

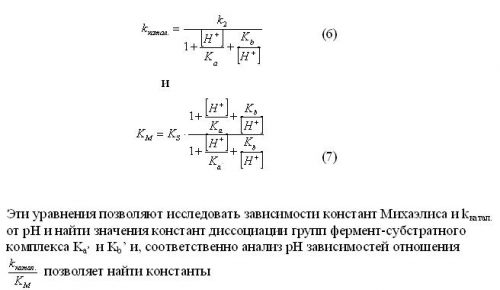
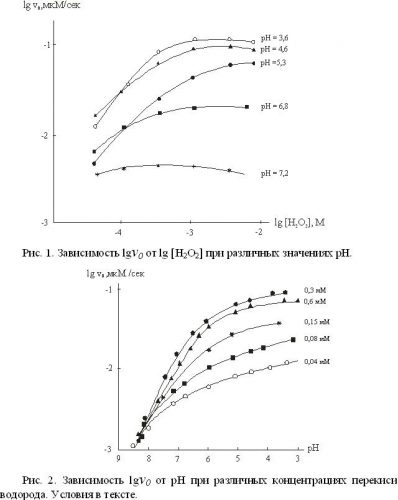
С целью определения оптимума рН для реакции пероксидазного окисления иодидов перекисью водорода мы изучили кинетику реакции в диапазоне рН 3,4 ÷ 9,2 при постоянной концентрации иодид-ионов 3 мМ и пероксидазы 0,25·10-8 М и переменной концентрации перекиси водорода (0,02÷2,5) мМ. Полученные результаты представлены на рисунках 1 и 2.
В диапазоне рН 3,6 – 5,3 зависимость скорости фкерментативной реакции от концентрации перекиси водорода имеет первый порядок. При повышении рН скорость ферментативной реакции уменьшается и процесс каталитического окисления иодид-ионов практически останавливается при рН>7 (см.рис.2). Максимальная скорость реакции наблюдается в диапазоне рН 3,6 – 4,3. Относительное постоянство константы Михаэлиса КМ в этом диапазоне рН позволяет сделать вывод, что субстрат, связываясь с ферментом, не изменяет значений констант диссоциации ионогенных групп активного центра пероксидазы, т.е. Ка ~ Kb и ~ .
Это означает, что ионогенная группа, контролирующая ферментативную реакцию, входит в состав каталитического, а не сорбционного участка активного центра. Подтверждает этот вывод график зависимости lgKM и lgkкатал. от рН, представленный на рисунке 3.
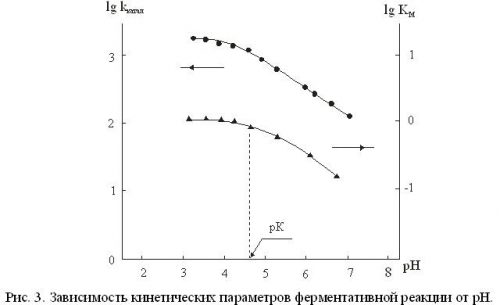
Из рН зависимости КМ следует, что в белковой глобуле фермента имеется ионогенная группа с рК = 4,6, протонирование которой увеличивает kкатал. Наличие максимума пероксидазной активности в диапазоне рН 3,8 – 4,2 можно объяснить электростатическим взаимодействием иодид-ионов с положительным зарядом белковой глобулы фермента, возрастающим при понижении рН. Кроме этого, возможной причиной изменения скорости ферментативной реакции при варьировании рН может быть изменение конформационной подвижности белковой глобулы и, соответственно увеличение доступности порфиринового кольца иодид-ионам. Смещение рН в щелочную область от максимума приводит к перезарядке белковой глобулы пероксидазы и к появлению отрицательных зарядов у полученных групп белка, что затрудняет проникновение иодид-ионов к активному центру фермента и снижает скорость реакции. Данные, полученные авторами [19], показывают, что при рН значительно меньше 5 действительно происходит локальное разрыхление структуры белка в гемсвязывающей области, а при рН< 3 наблюдается общее разрыхление белковой глобулы пероксидазы и диссоциация фермента на гемин и апобелок. Полученные нами значения рН ионогенности групп также согласуются с данными, свидетельствующими о наличии в активном центре пероксидазы ионогенной группы с рК ~ 5,0 , которая оказывает влияние на константы скорости реакции взаимодействия комплекса ЕI с некоторыми субстратами, например, п-крезолом, ферроцианидами, сульфатами и иодидами [8]. Интересно отметить, что в работе [19] на примере флуоресцентного аналога пероксидазы, была изучена конформационная подвижность в области активного центра пероксидазы и ее взаимосвязь с каталитическими параметрами пероксидазного окисления. Было показано, что при рН<5 иодид-ионы начинают эффективно тушить флуоресценцию протопорфирина в комплексе H2Por-apo-HRP и при этом эффективность тушения возрастает по мере уменьшения рН, а, следовательно, и по мере увеличения вероятности появления конформера EH(H2Por ….O) , который является более «рыхлым», чем конформер E(H2Por ….O), и малые ионы I— за время жизни молекулы порфирина в возбужденном состоянии успевают продиффундировать на большую глубину внутрь белка и потушить флуоресценцию порфирина. Было установлено, что при рН=4,6 существует значительное стерическое затруднение для контакта иодид-ионов с порфириновым макро-циклом, которое уменьшается при рН<4,4. Очевидно, и в этом наблюдается тот же эффект зависимости конформационной зависимости конформационной подвижности в области активного центра от рН среды. Полученные нами значения рН ионногенности с рК = 4,6 характерны, в первую очередь, для карбоксильных групп.
При конструировании аналитических систем с использованием медиаторной электрохимически активной пары I2 / 2 I— критерием оптимальной величины рН для пероксидазного окисления иодид-ионов перекисью водорода должна служить наибольшая разница между скоростями ферментативной и самопроизвольной реакциями. Кинетика реакции между иодид-ионами и перекисью водорода в отстутствии катализатора были изучены ранее Абелем и Брэем [16].
Результаты их исследований представлены в таблице 1.
Таблица1.
Кинетика реакции между перекисью водорода и иодид-ионами
|
рН |
I— | I2 | I2 + IO3— |
IO3— |
| 13 | — | I2 →I—
Очень быстро |
I2→IO3—
Очень быстро |
— |
| 5 | I— → I2
Умеренно (а) |
I2 →I—
умеренно |
— |
IO3—→I2 + I—
Очень медленно |
| 1 | I— → I2
Быстрее, чем (а) |
— |
I2→IO3—
Быстро |
IO3—→I2
Быстрее, чем (б) |
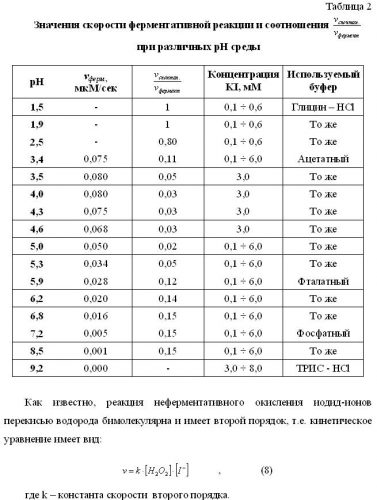
Как видно из таблицы протонирование увеличивает скорость неферментативного образования I2. Поэтому одним из путей уменьшения фонового сигнала является проведение ферментативной реакции при больших рН, однако, лежащих в диапазоне оптимальных значений, соответствующих максимальной скорости ферментативной реакции.
Этот вывод иллюстрируется таблицей 2, в которой указаны соотношения при различных рН и концентрации иодид-ионов и постоянной концентрации перекиси водорода.
Как видно из приведенных в таблице 2 результатов, диапазон рН 4÷5 соответствует максимальной скорости ферментативной реакции и минимальному соотношению скорости фоновой и ферментативной реакций . При этом концентрация иодид-ионов, как правило, не должна быть очень большой.



Заключение
Проведенное исследование кинетики пероксидазного окисления иодид-ионов перекисью водорода позволило сделать следующие выводы, необходимые для оптимизации условий проведения ферментативной реакции в целом:
- Реакция пероксидазного окисления иодид-ионов перекисью водорода является реакцией второго порядка.
- Максимальная скорость ферментативной реакции наблюдается в диапазоне рН 3,8-4.2. Михаэлисовская рН-функция обусловлена наличием в ферменте ионогенных групп с рК 4,6 — характерного для карбоксильных групп.
- Оптимальная концентрация перекиси водорода для достижения максимальной скорости ферментативной реакции находится в диапазоне 0,2-0,4 мМ.
- Для уменьшения скорости самопроизвольной реакции концентрация иодидов должна быть не более 3 мМ.
5.Скорость ферментативной реакции зависит от величины ионной силы раствора, в связи с чем, ионная сила не должна превышать 0,1-0,2 М.
Литература
| 1. | Bjorksten F. A kinetic study of the horse-radish peroxidase – catalized oxidation of iodide // Eur. J.Biochem. – 1968. – V.5. – P. 133. |
| 2. | Bjorksten F. Peroxidase-catalyzed iodide oxidation I // Biochim Biophys.Acta. – 1970. – V.212. –P.396 – 406. |
| 3. | Chance B. The kinetics and stoichiometry of the transition from the primary to the secondary peroxidase peroxide complexes// Arch. Biochem. Biophys. — 1952. — Vol.41.-N2.- P.416 – 424. |
| 4 | https://chem21.info/info/9910/ Справочник химика. |
| 5. | Metzler D. Biochemistry: The Chemical Reactions of Living Cells. — N.-Y.: Academic press. Inc., 1977. |
| 6. | Morrison M., Schonbaum G.R. Peroxidase – catalyzed halogenation // ann. Rev. Biochem. – 1976. – Vol.45. – P.861 – 888. |
| 7. | Neidelman S.L., Geigert J. Biohalogenetion: principles, basic roles and applications. – California: Horwood E., 1986. – 203 p. |
| 8. | Roman R., Dunford H.B. рН dependence of the oxidation of iodide by Compound I of horseradish peroxidase // Biochemistry – 1972. – v.11., No 11. – P. 2076 – 2082. |
| 9. | Steiner N., Dunford H.B. Ionic strength dependence of the oxidation of iodide and ferrocyanide by Compound I of horseradish peroxidase // Eur.J.Biochem. – 1978. – V.82. – P. 543-549. |
| 10. | Sugai T. Application of Enzyme- and Microorganism-catalyzed Reactions to Organic Synthesis // Current Organic Chemistry. – 1999. – Vol.3. –No. 4. – P. 373-407. |
| 11. | А.с. № 1205913 СССР. Способ проведения иммуно-ферментного анализа / Ивницкий Д.М., Юлаев М.Ф., Аронбаев Д.М., Кашкин А.П., Егоров А.М., Дзантиев Б.Б., Варфоломеев С.Д. Опубл. Б.И.1986, №3. |
| 12. | Аронбаев Д.М. Разработка принципов амперометрической детекции в твердофазном иммуноферментном анализе.// Автореф… канд.хим наук. –М.: МГУ. – 21 с. |
| 13. | Ивницкий Д.М. Блинов В.А., Аронбаев Д.М., Назаров А.В. Рамазанова О.А Ицекзон А.М. Биоэлектрохимические датчики в клинико-экспериментальных исследованиях // Тез.докл.XII Менделеевского съезда по общей и прикладной химии. М., Наука, 1981. т.1. с.270-273 |
| 14 | Ивницкий Д.М., Юлаев М.Ф., Аронбаев Д.М., Кашкин А.П. , Мерингова Л. Применение амперометрического датчика проточного типа в иммуноферментном анализе // Ж.аналит. химии.-1986.- Т.41.- №1. — С. 55-59. |
| 15. | Лебедева О.В., Угарова Н.Н. Механизм пероксидазного окисления. Субстрат—субстратная активация в реакциях, катализируемых пероксидазой хрена // Изв. РАН. Серия химии. — 1996. — № 1. — С. 25-32. |
| 16. | Позин М.Н. Перекись водорода и перекисные соединения. – М.-Л. : Химия, 1951. – 576 с. |
| 17. | Справочник химика. Т.IV. 2-е изд. Переработ. и . дополн. Под ред. Б.П.Никольского. – М.:-Л.: Химия, 1965. |
| 18. | Угарова Н. Н. Применение ферментов в химическом анализе // Введение в прикладную энзимологию. Учебное пособие / Под ред. И.В. Березина, К. Мартинека. — М.: Изд-во МГУ, 1982.-С. 306-342. |
| 19. | Угарова Н. Н., Лебедева О.В., Савицкий А.П. Пероксидазный катализ и его применение. — М.:МГУ, 1981. —92 с. |
| 20. | Шафран М.Г. Миелопероксидаза нейтральных лейкоцитов // Успехи совр. Биологии. – 1981. – Т.92. – С.365 – 379. |

