Проблема исследования изменения внутренней организации воды и водных растворов в результате воздействия электромагнитных полей малой мощности до настоящего времени остается нерешенной. Это обусловлено, тем, что вода является структурно крайне динамичной и изменение структурной организации зафиксировать достаточно сложно.
Опубликованы результаты исследований, которые посвящены влиянию высокочастотного электромагнитного поля на свойства воды и водных растворов [1,с.305].
Способность молекул воды образовывать комплексные соединения, к которым относятся аквакомплексы, образующие кристаллогидраты, дает возможность изучить влияние измененной воды на свойства кристаллогидратов, а исследуя свойства кристаллогидратов, можно доказать, что существует изменения и в воде, и в водных растворах, которые выражаются в энергетических характеристиках. Имеющиеся публикации [2,с.70] [3,с.202] показали существенные изменения свойств кристаллогидратов хлорида кобальта, выращенного из растворов после ВЧ полевого воздействия. Тем не менее, остаётся вопрос о влиянии природы иона комплексообразователя на особенности проявления полевого воздействия.
В связи с этим были проведены исследования с другим ионом, как комплексообразователем, при образовании кристаллов пентагидрата сульфата меди.
Выбор объекта исследования был обусловлен, тем, что пентагидрат сульфата меди обладает уникальной структурой по сравнению с другими кристаллогидратами. Из-за того, что ион меди Cu2+ отрицательно гидратирован, а сульфат-ион SO42- — положительно было выдвинуто предположение, что именно этот фактор может дополнительно влиять на процессы кристаллизации и гидратации в результате действия ВЧ поля. На основе имеющихся теоретических данных о кристаллической структуре данного объекта исследования и имеющихся предварительных данных о наличии эффекта полевого воздействия на кристаллогидрат хлорида кобальта CoCl2·6H2O [4,с. 222], и был выбран пентагидрат сульфата меди.
Приготовление растворов сульфата меди
В работе использовалась деионизованная вода с электропроводностью 2,3 мкСм/см. Вода хранилась в герметически закрытых полиэтиленовых бутылях. Методика подробно изложена в работе [3,с.202]. Полевое воздействие на исходный образец воды осуществлялось непрерывно в течение 60 минут при определённой частоте ВЧ поля, после чего облученные и необлученный (контрольный) образцы выдерживались в течение трех суток.
Высушенный сульфат меди использовали для приготовления растворов. Затем, используя обработанный полем и контрольный образцы воды, готовили ненасыщенные растворы сульфата меди, растворяя безводный сульфат в определённой порции воды.
Во второй серии экспериментов воздействию ВЧ поля подвергался раствор сульфата меди, приготовленный по аналогичной методике, на основе воды, не подвергшейся полевому воздействию. Полевому воздействию подвергался готовый раствор
Методика проведения термогравиметрического анализа
Термогравиметрические данные получены с использованием термоанализатора синхронного STA 409 PC/PG Luxx (Германия, Netzsch-Geratebau GmbH) НОИЦ НМНТ Федерального Томского государственного политехнического университета.
Условиями, при которых осуществляется анализ, являлись температурная программа, состоящая из одного сегмента при равномерном нагреве со скоростью 10°С в минуту в интервале температур 25 – 300°С в атмосфере воздуха. Пример кривой термического анализа приведён на рис.1 для контрольного образца, на рисунке 2 – для образца полученного с использованием полевого воздействия.
На основе анализа кривых получены значения тепловых эффектов испарения воды из образцов и убыль массы. Последние данные использовались для определения числа молекул воды, испаряющихся одновременно при определённой температуре, и составления схемы реакции последовательной дегидратации. Графики регистрировались и обрабатывались автоматически в ходе нагрева образца с помощью программы NETZSCH Proteus Analysis.
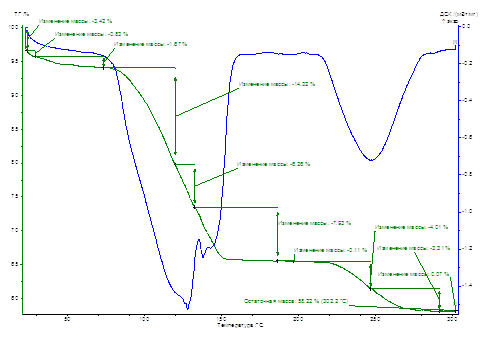
Рисунок 1 – Зависимости ТГ,% – Т, ̊C; ДСК, мВт/мг – Т, ̊C (прибор STA 409 PC) для контрольного образца
По кривой ТГ определялась потеря массы образца в результате его дегидратации.
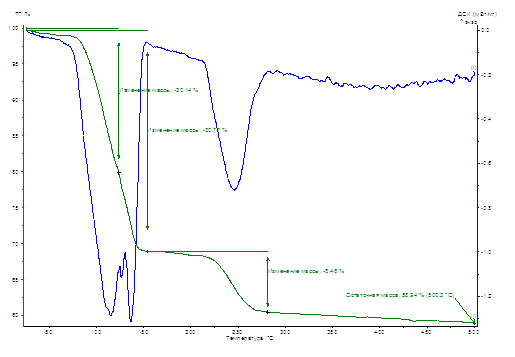
Рисунок 2 – Термогравиметрические кривые для образца 30 МГц. (Полевому воздействию подвергалась вода).
На основе относительной потери массы образца рассчитывалось количество молекул воды, испаряющееся на определённом этапе нагрева.
При работе с программным обеспечением NETZSCH Proteus Analysis, площадь пиков рассчитывается автоматически для каждой кривой в координатах ДСК, мВт/мг – Т, ̊C. Величина площади пика и представлена как энергия дегидратации кристаллогидрата выраженная в Дж/г.
Все данные образцов, полученных из растворов в результате полевого воздействия, сопоставлялись с данными контрольного образца, который был выращен из водного раствора без полевого воздействия.
Термодинамические характеристики процессов дегидратации кристаллогидратов
С помощью данных, полученных из термограмм, рассчитывались потери молекул воды. В таблице 1 приведены данные для образцов, выращенных из растворов на основе воды, подвергшейся полевому значению. В таблице 2 – результаты термического анализа образцов, полученных из растворов, подвергшихся полевому воздействию. Из анализа термограмм контрольного образца было выявлено, что первые две молекулы воды теряются при температуре 110,0ºС при соответствующей энергии дегидратации 3,92 кДж/моль.
Таблица 1
Результаты термогравиметрического анализа CuSO4∙5H2O (облучённая вода)
| Контрольный образец | ||||
| Интервал температур этапа, ∆Tраз., ˚C | Температура max, Tраз., ˚C | Qдегидратации, кДж/моль | Потеря массы, % | Потеря количества H2O |
| 80,4 – 147,6 | 110,0 | 3,92 | 18,09 | 2,51 |
| 210,6 – 262,1 | 134,5 | 1,87 | 12,79 | 1,78 |
| 240,8 | 2,01 | 7,07 | 0,98 | |
| Всего: | 7,80 | 37,95 | 5,27 | |
| Облучение, 30 МГц | ||||
| Интервал температур этапа, ∆Tраз., ˚C | Температура max, Tраз., ˚C | Qдегидратации, кДж/моль | Потеря массы, % | Потеря количества H2O |
| 77,7 – 148,5 | 115,6 | 3,69 | 30,77 | 4,27 |
| 216,0 – 267,1 | 136,8 | 1,63 | 8,46 | 1,18 |
| 246,6 | 2,00 | — | — | |
| Всего: | 7,32 | 39,23 | 5,45 | |
| Облучение,170 МГц | ||||
| Интервал температур этапа, ∆Tраз., ˚C | Температура max, Tраз., ˚C | Qдегидратации, кДж/моль | Потеря массы, % | Потеря количества H2O |
| 75,3 – 144,7 | 40,2 | 0,13 | 5,70 | 0,79 |
| 214,9 – 262,8 | 107,7 | 3,31 | 16,14 | 2,24 |
| 130,1 | 2,46 | 12,70 | 1,76 | |
| 240,4 | 2,05 | — | — | |
| Всего: | 7,95 | 34,54 | 4,79 | |
Соответственно другие две молекулы воды теряются при температуре 134,5ºС при энергии дегидратации 1,87 кДж/моль. Последняя молекула воды уходит при температуре 240,8ºС, энергия дегидратации составляет 2,01 кДж/моль. Схема данного процесса дегидратации может быть представлена следующим образом:
По тому же механизму происходит дегидратация и после полевого воздействия на частотах 60, 90, 110, 130, 150, 190 и 200 МГц. Температуры дегидратации и энергии, приходящиеся на молекулы воды в каждом этапе, незаметно отличаются друг от друга. Но есть изменения, которые существенно превышают ошибку измерения.
В образце подвергшийся полевому воздействию на частоте 30 МГц этапы дегидратации существенно изменяются. Процесс дегидратации происходит в два этапа, то есть первыми уходят сразу 4 молекулы воды. Это происходит в узком температурном интервале 115,6 – 136,8ºС. Происходит потеря индивидуальности в этих группах молекул воды. Энергия дегидратации, приходящаяся на каждую из четырех молекул воды, составляет 1,33 кДж/моль. Последняя молекула воды уходит при температуре 246,6ºС при энергии дегидратации 2,00 кДж/моль. Дифференциация наблюдается только в четырех молекулах воды, которые входят в комплекс.
В образце для частоты 170 МГц, также изменяются процессы дегидратации. Процесс дегидратации происходит в три этапа, но уже отличается от эталонного образца. В данном образце первая молекула воды уходит при температуре 40,2ºC с энергией дегидратации 0,13 кДж/моль. Таким образом, при данной теплоте уходит адсорбционная вода. Другие две молекулы воды уходят при температуре 130,1ºС, а последние две при 240,4ºС, что соответствует полному обезвоживанию сульфата меди. Энергия дегидратации составляет 2,05 кДж/моль.
Многочисленные данные ранних исследований, говорили и том, что эффект полевого воздействия существенно уменьшается с увеличением концентрации раствора. При повышенной концентрации соли нативная структурная организация воды разрушается практически полностью и структура «навязывается» ближним порядком координационной гидратной оболочки у ионов растворенной соли. Тем не менее, представляло интересным изучить и определить влияние поля на кристаллизацию из растворов, которые подверглись полевому воздействию.
Как и в первой серии экспериментов было обнаружено отчётливое отличие в процессах дегидратации кристаллогидратов как с точки зрения последовательности удаления молекул воды, так в температурах и энергетике процесса. Результаты приведены в таблице 2.
Таблица 2
Результаты термогравиметрического анализа кристаллов CuSO4∙5H2O (облученный раствор)
| Облучение,30 МГц | ||||
| Интервал температур этапа, ∆Tраз., ˚C | Температура max, Tраз., ˚C | Qдегидратации, кДж/моль | Потеря массы, % | Потеря количества H2O |
| 76,6 – 142,2 | 105,6 | 3,38 | 25,27 | 3,51 |
| 213,9 – 262,4 | 126,2 | 2,56 | 13,53 | 1,88 |
| 241,4 | 2,00 | — | — | |
| Всего: | 7,94 | 38,80 | 5,39 | |
| Облучение,60 МГц | ||||
| Интервал температур этапа, ∆Tраз., ˚C | Температура max, Tраз., ˚C | Qдегидратации, кДж/моль | Потеря массы, % | Потеря количества H2O |
| 78,6 – 140,7 | 130,9 | 1,32 | 19,49 | 2,71 |
| 214,2 – 264,8 | 111,6 | 4,76 | 8,52 | 1,18 |
| 239,7 | 2,12 | 6,62 | 0,92 | |
| Всего: | 8,20 | 34,63 | 4,81 | |
| Облучение,150 МГц | ||||
| Интервал температур этапа, ∆Tраз., ˚C | Температура max, Tраз., ˚C | Qдегидратации, кДж/моль | Потеря массы, % | Потеря количества H2O |
| 77,6 – 146,6 | 115,9 | 3,74 | 20,02 | 2,78 |
| 214,7 – 264,8 | 132,1 | 1,74 | 9,27 | 1,29 |
| 243,3 | 1,81 | 7,45 | 1,04 | |
| Всего: | 7,29 | 36,74 | 5,11 | |
Для частоты 30 МГц показано, что этапы дегидратации изменяются по сравнению с контролем. Первые три молекулы воды удаляются при температуре от 105,6 – 126,2ºС с энергией дегидратации 1,98 кДж/моль, приходящейся на каждую из трех молекул воды. Другие две молекулы воды уходят при температуре 241,4ºС, энергия дегидратации 2,00 кДж/моль соответственно. Данный процесс дегидратации можно представить следующим образом:
У образцов для частот 60 и 150 МГц механизм дегидратации можно представить следующим образом:
Первые три молекулы воды уходят при температурах 115,9ºС и 130,9ºС соответственно. При этом энергия дегидратации у образца 150 МГц намного выше 3,74 кДж/моль, чем у образца 60 МГц – 1,32 кДж/моль. Зато на четвертую молекулы воды у образца для частоты 60 МГц, которая удаляется при температуре 111,6ºС, приходится больше энергии дегидратации 4,76 кДж/моль, чем на удаление четвертой молекулы воды из образца 150 МГц – 1,74 кДж/моль при температуре 132,1ºС. Последняя молекула воды удаляется из образцов 60 и 150 МГц при температуре 239,7ºС и 243,3ºС с энергиями дегидратации 2,12 кДж/моль и 1,81 кДж/моль соответственно.
Наблюдаемые ярко выраженные результаты полевого воздействия можно объяснить исходя из предположения об изменении уровня внутренней организации и в воде и в водных растворах, суть которой заключается в более упорядоченном расположении молекул воды в ансамблях. Это изменение приводит к изменению термической устойчивости связей воды в кристалле между собой, а также сказывается на прочности связи их с ионом меди. Наблюдаемое отличие в механизме и энергии дегидратации для гидратов кобальта и меди обусловлено конкурирующим действием межмолекулярного взаимодействия молекул воды в водной «сетке», с одной стороны, и донорно-акцепторным взаимодействием иона металла и молекул воды – с другой.
Таким образом, на основе анализа термической стойкости кристаллогидрата сульфата меди подтверждено изменение внутренней организации молекул воды в результате воздействия ВЧ поля.
Список литературы:
- . Бессонова А.П., Стась И.Е. Влияние высокочастотного электромагнитного поля на физико-химические свойства воды и ее спектральные характеристики // Ползуновский вестник. – 2008 – №3. – C. 305–309.
- Шипунов Б.П., Чащевая Ю.М. Изменения силовых характеристик колебательных мод кристаллогидрата хлорида кобальта // Известия Алтайского государственного университета. — 2015. – 1-2 (85) С.70-76.
- Шипунов Б.П., Чащевая Ю.М. Влияние ВЧ поля на термодинамическую устойчивость кристаллогидратов хлорида кобальта // Известия вузов. Сер. Физика и химия материалов. — 2014. — Т. 57, № 7/2. С.202-204.
- Шипунов Б.П. Чащевая Ю.М., Стась И.Е. Термодинамические особенности кристаллогидратов хлорида кобальта, выращенных из растворов, подвергшихся действию ВЧ-поля. // Известия Алтайского государственного университета – Барнаул: Алтайский государственный университет, 2013. – С. 222 – 226.[schema type=»book» name=»ИЗМЕНЕНИЯ ЭНЕРГЕТИКИ ПРОЦЕССА ДЕГИДРАТАЦИИ КРИСТАЛЛОГИДРАТА СУЛЬФАТА МЕДИ КАК РЕЗУЛЬТАТ ПОЛЕВОГО ВОЗДЕЙСТВИЯ» description=»На основе термогравиметрического анализа кристаллогидратов сульфата меди установлено изменение основных энергетических параметров процесса дегидратации. Показано, что изменения происходят как при полевом воздействии на воду, на основе которой готовится маточный раствор, так и при воздействии полем определённых частот непосредственно на раствор. Обнаружено, что при воздействии поля предварительно на воду для частот 30 и 170 МГц происходит радикальное изменение порядка процесса дегидратации: для контрольного образца процесс можно представить схемой 2/2/1, для образца после полевого воздействия при 30 МГц – 4/1, для частоты 170 МГц -1/2/2. В том случае, если полевому воздействию подвергались растворы сульфата меди схемы дегидратации и энергетика процессов заметно меняется. Для образцов после воздействия полем частотой 30 МГц реализуется схема 3/2, для частот 60 и 150 МГц реализуется схема 3/1/1 Разнонаправлено сдвигается во всех экспериментах и температурная область соответствующего этапа дегидратации. Эти факторы доказывают о протекании процессов внутренней организации диполей молекул воды в результате воздействия высокочастотного (ВЧ) поля.» author=»Шипунов Борис Павлович» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2016-12-22″ edition=»euroasian-science.ru_25-26.03.2016_3(24)» ebook=»yes» ]

