Исследования последних лет позволили связать большинство патологических процессов в человеческом организме с нарушениями прооксидантно-антиоксидантного баланса, как на клеточном уровне, так и в организме в целом, которые обусловлены накоплением активных форм кислорода (АФК) и метаболитов перекисного окисления липидов (ПОЛ) за счет уменьшения процессов их нейтрализации и элиминации из организма [7,10]. Особенно это актуально при инфекционных заболеваниях, при которых геморрагический синдром и тромботические осложнения являются наиболее частыми и опасными формами клинической патологии, определяющими исход заболевания. Среди них особое место занимает крымская геморрагическая лихорадка (КГЛ), возбудителем, которой является РНК-вирус, вирус Крым-Конго геморрагической лихорадки, принадлежащий к роду Nairovirus семейства Bunyaviridae. В настоящее время эта лихорадка в структуре инфекционной патологии составляют относительно незначительный удельный вес, вместе с тем сохраняется стойкость, ранее открытых природных очагов, и напряженная обстановка непредсказуемости и возрастания их активность, а так же отмечается тенденция к расширению ее ареала распространения [2,3]. В Российской Федерации эпидемически активная территория по КГЛ составляет 49,9% Южного и Северо-Кавказского федеральных округов, где в течение 15 лет было выявлено 1654 больных, среди которых 4,4% с летальным исходом, причиной которых являлись полостные кровотечения [2,5]. Ряд исследователей установили, что одной из важной причин возникновения нарушений в гемостазе является цитокиновый взрыв [8,11], способствующий гемофагоцитарному синдрому, но в то же время было доказано, что его формирование обусловлено генетической предрасположенностью у пациентов с иммунологическими дефектами [12]. А так же Celik V.K. et al., 2010 отмечали повышение уровня аденозиндезаминазы и ксантиноксидазы в плазме у больных КГЛ, которые вызывали повреждение тканей и возникновение у них кровоизлияний [ 9] .
Цель исследования: исследовать состояние оксидантно-антиоксидантной системы в плазме у больных КГЛ, дисбаланс которой может выступать как фактор в развитии у них геморрагического синдрома (ГС).
Материалы и методы исследования. Для решения поставленной цели с 2005 по 2014гг. на базе НИИ КИП и кафедре инфекционных болезней ГБОУ ВПО «Астраханский ГМУ», а так же в отделениях ОИКБ им. А.М. Ничоги г.Астрахани было проведено клинико-лабораторное исследование 84 больных, с диагнозом КГЛ выставленный, на основании определения генома РНК вируса ККГЛ в постановке ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени. Работа выполнена в рамках реализации гранта Президента Российской Федерации «Разработка алгоритмов персонализированного лечения больных Крымской геморрагической лихорадкой на основании изучения системы гемостаза и особенностей клинического течения» (НШ-2968.2014.7).
Наблюдаемые больные были разделены на две группы в зависимости от наличия клинических симптомов геморрагического синдрома (ГС) и сопоставимые по возрасту и полу (р˃0,05). В I группу вошли 41 больной с клиническими симптомами ГС в возрасте 44,5±1,9 лет, среди которых 73,0±5,4% составляли лица мужского пола и 27,0±5,3% ‒ женского. Во II группу были включены 43 пациента без клинических симптомов ГС в возрасте 43,9±1,8 лет с равнозначным распределением по полу к I группе.
Концентрацию малонового диальдегида оценивали по степени взаимодействия тиобарбитуровой кислоты с низкомолекулярными диальдегидами [4] с образованием окрашенного комплекса, имеющего максимум светопоглащения при длине волны 535 нм на спектрофотометре ПЭ5300. Активность каталазы в плазме рассчитывали по способности перекиси водорода образовывать с солями молибдена стойкий окрашенный комплекс на спектрофотометре ПЭ5300 при длине волны 410 нм против контрольной пробы [1]. Содержание церулоплазмина (ЦП) определяли по оксидазной активности белка, используя в качестве субстрата окисления ортофенилендиамин окрашенный комплекс на спектрофотометре ПЭ5300 при длине волны 440 нм. Лактоферрин (ЛФ) определяли методом иммуноферментного анализа (ИФА), используя коммерческий иммуноферментный набор с иммобилизированными антителами к ЛФ (ЗАО «Вектор-Бест», федеральная лицензия № 64/562/98) на ASYS Hitech Gmbh анализаторе ‒ иммуноферментный планшетный EXPERT PLUS.
Состояние оксидантно-антиоксидантной системы (ОАОС) у пациентов оценивали расчетом коэффициента окислительно-антиокислительного баланса (К оаос), который вычисляли по формуле [6]
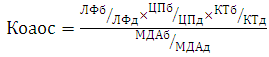
Статистический анализ проводили с использованием программы «BioStat-программа статистического анализа. Версия 2009» с расчетом критериев Шеффе, Тьюки-Крамера, Ньюмена-Кейлса, Бонферрони, Fisher, Стьюдента.
Результаты. В 52% случаев больные обращались за медицинской помощью на 2-3 сутки болезни, а у остальных была более поздняя госпитализация в стационар, при этом у них регистрировали клинические симптомы ГС. Заболевание в большинстве случаев (87%) начиналось остро с внезапного подъема температуры тела до 39,0 — 400С, а у четверти больных с наличием ГС регистрировали чрезмерную степень лихорадки. Так же было отмечено, что прием антипиретиков не способствовал стабилизации температуры тела. На 3-5 сутки болезни у 71% больных с наличием ГС и 15% — при его отсутствии температура кратковременно снижалась до нормальных цифр, а затем вновь повышалась, что было расценено как «врез температурной кривой». И, именно в это время, у пациентов с симптомами ГС фиксировали появление его первых симптомов.
Длительность основных клинических симптомов, таких как общая слабость, диффузная головная боль, снижение аппетита, нарушение сна, головокружение, тошнота, рвота, явления склероконъюнктивита, а так же миалгия были более продолжительными у больных с проявлениями ГС (от 2 до 5 суток), чем при их отсутствии.
Клинические проявлениями ГС у больных КГЛ были представлены как полостными, так и бесполосными кровотечениями. В данном наблюдении бесполосные кровотечения регистрировали в 90,9%, как проявление геморрагических элементов сыпи на поверхности кожи (85%), кровоточивости десен (58%), постинъекционных (77%) и посттравматических (10%) кровоизлияний. В то время полостные кровотечения были представлены носовыми (31%), желудочно-кишечными (27%), маточными (8%) и гематурией (29%).
Одним из ранних признаков дермальных проявлений ГС являлась эритема кожных покровов лица, шеи и верхних отделов груди, регистрируемая на 1,0±0,32 день болезни и сопровождающаяся чувством жара и гиперестезией на фоне лихорадки. В дальнейшем у 85% больных в среднем на 4,5±0,66 день болезни появлялись геморрагической сыпи. В единичных (12%) случаях кожные высыпания были представлены в виде розеолезно-папулезных и геморрагических элементов.
Среди больных с наличием ГС чувство тошноты постоянно присутствовало у 70% до 4,6±0,45 дня болезни, при этом у 62% она сопровождалась рвотой, которая в тяжелых случаях приобретала геморрагический характер (17%). У пациентов при отсутствии ГС тошнота и рвота регистрировалась только в течение двух суток в 50% и в 33% соответственно.
Увеличение печени выявляли у 50 % больных с клиническими признаками ГС, тогда как при его отсутствии – только в 31%. При пальпации печень была эластичной консистенции с умеренной болезненностью, край ее выступал на 1-3 см из-под реберной дуги. Повышение биохимических маркеров регистрировали только у 40% больных с наличием ГС, при этом концентрация общего билирубина повышалась до 22,5±0,69 мкмоль/л, за счет увеличения непрямой фракции, а активность аланинаминотрансферазы (АлАТ) была умеренной до 1,66±0,81 ммоль/л и только в 9% случаев она достигала 4,26 ммоль/л.
В ходе исследования было выявлено, что у больных КГЛ с наличием ГС статистически значимое (p<0,001) повышение МДА в плазме более чем в 3 раза по сравнению с контрольными значениями (7,6±0,8 мкмоль/л), в то время как во II группе концентрация этого альдегида не изменялась. Активности каталазы статистически значимое (р<0,001) снижалась как при наличии ГС, так и при его отсутствии более чем в 2 раза по сравнению с контрольными значениями (310±55,8мкат/л).
Интенсивность липидной пероксидации оценивали по концентрации малонового диальдегида (МДА) в плазме, так он является конечным продуктом перекисного окисления липидов. Было выявлено, что у больных КГЛ с наличием ГС статистически значимое (p<0,001) повышение МДА в плазме более чем в 3 раза по сравнению с контрольными значениями (7,6±0,8 мкмоль/л), в то время как во II группе концентрация этого альдегида не изменялась.
Активности каталазы статистически значимое (р<0,001) снижалась как при наличии ГС, так и при его отсутствии более чем в 2 раза по сравнению с контрольными значениями (310±55,8мкат/л). Учитывая современный взгляд в ауторегуляции функционирования компонентов антиоксидантной защиты организма в физиологических процессах, в данном исследовании определяли уровень церулоплазмина (ЦП) и лактоферрина (ЛФ) в плазме наблюдаемых больных. Насыщение плазмы ЦП статистически значимо (р<0,001) было низким на 77% по сравнению с контрольными значениями (0,3±0,01ус.ед) у пациентов с наличием ГС, тогда как при их отсутствии ‒ равнозначным здоровым лицам. Концентрация ЛФ у больных с ГС подобно ЦП статистически значимо (р<0,001) снижалась на 13% по сравнению с контрольными значениями (1,0±0,01г/л), но при отсутствии ГС активность этого ферритина статистически значимо повышалась в 1,8 раза, при этом наиболее чаще регистрировали значения приближенные к максимальным(1,5 г/л).
Для убедительности суждения о причинно-следственной связи истощения функционирования антиоксидантной системы в возникновении ГС был рассчитан коэффициент соотношения активности антиоксидантной и оксидантной систем, который статически значимо (р<0,001) снижался в обеих группах, но при этом его глубокая депрессия развивалась у больных с клиническими проявлениями ГС, так как его значения (0,02±0,009) были в десятки раз меньше контрольных (1,2±0,08). Во II группе данный коэффициент по сравнению со значениями здоровых лиц уменьшался в 6 раз.
Таким образом, результаты данного исследования доказывают, что в возникновении и развитии ГС у больных КГЛ ведущую роль выполняет окислительный стресс, возникающий из-за значительного снижения потенциала антиоксидантной системы, что убеждая в целесообразности введения лекарственных препаратов, обладающих антиоксидантными свойствами, как основными в патогенетической терапии при КГЛ.
Список литературы:
- Королюк, М.А. Метод определения активности каталазы / М.А. Королюк, Л.И.Иванова, И.Г.Майорова, В.Е. Токарев// Лаб. дело ‒1988.‒№1.‒ С. 16-19.
- Малеев, В. В. Крымская геморрагическая лихорадка / В. В. Малеев, Х. М. Галимзянов, A. M. Бутенко и соав.// – М.‒Астрахань. ‒2003. − 120 с.
- Малецкая, О. В. Эпидемическая ситуация по Крымской геморрагической лихорадке в Южном федеральном округе / О. В. Малецкая, А. П. Бейер, Д. С. Агапитов и др. // Журнал микробиологии. − − № 6. – С. 51–54.
- Медицинские лабораторные технологии : руководство по клинической лабораторной диагностике : в 2 т. / [В.В.Алексеев и др.]; под ред. А.И. Карпищенко. ‒ 3-е изд., перераб. и доп. ‒ Т.2 ‒ М. : ГЭОТАР – Медиа, 2013.‒ 792с. : ил.
- Письмо Роспотребнадзора от 27.01.2014 г. № 01/742-14-32 «Об эпидемиологической ситуации по КГЛ в субъектах ЮФО и СКФО Российской Федерации в 2013 году и прогнозе на 2014 год». ‒ 2014.‒ С.24.
- Чиссов, В.И. Лечение тяжелых послеоперационных гнойно-воспалительных и септических осложнений с использованием антиоксидантных препаратов / В.И.Чиссов, Р.И.Якубовская, Е.Р.Немцова, и соавт.//Хирургия.‒2008.‒ №11.‒ С.14-19.
- Bayraktar, N. Lipid peroxidation and antioxidant enzyme activities in cancerous bladder tissue and their relation with bacterial infection: a controlled clinical study./ N. Bayraktar, S. Kilic, M.R. Bayraktar, N.Aksoy //J Clin Lab Anal. ‒2010.‒ №24.‒ Р. 25–30.
- Cagatay, A. Haemophagocytosis in a patient with Crimean-Congo haemorrhagic fever /A.Cagatay, M.Kapmar, Karadeniz et al.// J.Med.Microbiol. – 2007.-Vol.56.-P.1126-1128.
- Celik, V.K. Determination of serum adenosine deaminase and xanthine oxidase levels in patients with crimen-congo hemorrhagic fever/ V.K.Celik, I.Sari, A.Engin, et al.// Clinics [online]. 2010, vol.65, n.7, pp. 697-702. 65.‒№7.‒Р.697‒702. ISSN 2010.1807-5932.
- Draganov D., PON1 and oxidative stress in human sepsis and an animal model of sepsis/ D. Draganov, J. Teiber, C. Watson et al.// Adv Exp Med Biol.‒ 2010.‒ № 660.‒ Р. 89–97.
- Fisgin T.N. Crimean-Congo hemorrhagic fever: five patients with hemophagocytic syndrome / T.N. Fisgin, T. Fisgin, E. Tanyel, N. Tulek. // Am. J. Hematol.-2008.‒Vol.83.‒P. 73‒76.
- Gurgey, A. Secondary hemophagocytic lymphohistiocytosis in Turkish children / A. Gurgey, G. Secmeer, B. Tavil et al. // Pediatr. Infect. Dis. J. 2005. ‒Vol. 24.‒ 1116-1117.[schema type=»book» name=»РОЛЬ ОКИСЛИТЕЛЬНОГО СТРЕССА В РАЗВИТИИ ГЕМОРРАГИЧЕСКОГО СИНДРОМА У БОЛЬНЫХ КРЫМСКОЙ ГЕМОРРАГИЧЕСКОЙ ЛИХОРАДКОЙ» description=»Цель исследования: исследовать состояние оксидантно-антиоксидантной системы (ОАОС) в плазме у больных крымской геморагической лихорадкой (КГЛ), который оценивали отношением активности каталазы, лактоферрина и церулоплазмина к концентрации малонового диальдегида в плазме больных при КГЛ. В результате было выявлено снижение в десятки раз этого коэффициент у больных с клиническими проявлениями геморрагического синдрома (ГС) по сравнению с контрольными значениями. Это позволяет рассматривать дисбаланс в ОАОС как фактор в развитии ГС при КГЛ.» author=»Лазарева Елена Николаевна, Кантемирова Бела Исмаиловна, Бабаева Марина Алексеевна, Кобченко Наталья Васильевна» publisher=»БАСАРАНОВИЧ ЕКАТРЕИНА» pubdate=»2017-01-19″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_28.11.15_11(20)» ebook=»yes» ]

