Фибрилляция предсердий (ФП) — наджелудочковая тахиаритмия, характеризующаяся некоординированной электрической активностью предсердий с частотой импульсов 350-700 в минуту с последующим ухудшением их сократительной функции. Фибрилляцией предсердий страдают 1-2 % общей популяции, и этот показатель растёт в последние годы [3]. Число больных фибрилляцией предсердий (ФП) в США оценивают более чем в 2,2 миллиона человек, в странах Европейского союза — 4,5 миллиона [14,18]. Хроническое течение ФП приводит к увеличению риска смерти примерно в 1,5-2 раза [10,16].
В связи с вышеизложенным, лечению ФП уделяется огромное внимание. Выделяют медикаментозные и хирургические методы лечения ФП. Хирургические методы лечения показаны пациентам, у которых сохраняются клинические симптомы, несмотря на оптимальную медикаментозную терапию [4]. К ним относятся транскатетерные методы лечения и различные модификации операции «Лабиринт» [3,5].
Для определения оптимального метода хирургического лечения пациентов с ФП требуется наличие максимальной информации о морфофункциональном состоянии левого предсердия (ЛП). Ряд авторов уделяют особое внимание объему ЛП, анатомии впадения ЛВ в ЛП [18,20], тромбозу ушка ЛП [5], наличию и распространенности фиброза ЛП [11,12,19].
Среди методов визуализации ЛП выделяют трансторакальную и чреспищеводную эхокардиографию, селективную кардиоангиографию, мультиспиральную компьютерную томографию (МСКТ) ЛП и легочных вен (ЛВ), магнитно-резонансную томографию (МРТ) сердца. К сожалению, каждый из методов имеет свои достоинства и недостатки. В настоящее время все большее внимание клиницистов привлекают МСКТ и МРТ сердца, которые помогают уменьшить количество других диагностических процедур [1].
В связи с этим целью данного исследования явилось изучение анатомических и функциональных параметров ЛП у пациентов с ФП с помощью мультиспиральной компьютерной томографии и магнитно-резонансной томографии.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование выполнено в Рентгенодиагностическом отделе НЦССХ им. А.Н.Бакулева РАМН.
Проспективно обследовано 19 пациентов с различными формами ФП. Среди них 16 мужчин и 3 женщины. Средний возраст составил 53,68 ± 6,94 г. В 50% случаев встречалась пароксизмальная форма ФП, в 33% перстистирующая форма и в 17% постоянная форма ФП.
Рентгеновскую компьютерную томографию выполняли на сверхбыстром 128-срезовом мультиспиральном компьютерном томографе с ретроспективной ЭКГ синхронизацией. Методика исследования состояла из нативного сканирования и серий контрастного усиления на фоне внутривенного введения неионных контрастных препаратов из расчета не более 1мл/кг массы тела с использованием автоматического инъектора. Исследование выполняли на фоне задержки дыхания на вдохе. Толщина реконструируемых срезов была от 0,6мм до 3мм. Последующая постпроцессорная обработка данных проводилась на рабочих станциях и включала: построение мультипланарной реконструкции (МПР) и 3-D-изображений для оценки анатомических параметров ЛП и ЛВ, расчет объема ЛП.
МРТ проводили на высокопольном МР томографе с напряженностью магнитного поля 1,5T с использованием кардиопакета для сканирования, включающие импульсные последовательности «турбо спин-эхо» с синхронизацией ЭКГ для изучения морфологии сердца и сосудов, «градиент-эхо» (кино-МРТ) для оценки функциональных параметров сердца. Сканирование осуществляли на задержке дыхания на фазе вдоха, толщина срезов была от 3мм до 8мм. Для выявления наличия и степени распространенности фиброзных изменений миокарда использовали методику отсроченного контрастирования гадолиний содержащими контрастными препаратами. Препараты вводили внутривенно болюсно при помощи автоматического инжектора со скоростью 3 мл/с в дозе 0,15-0,2 ммоль/кг. Постпроцессорная обработка проводилась на рабочих станциях с использованием кардиопакетов, включала расчет объемных параметров ЛЖ, а также анализ локализации и распространенности фиброза миокарда ЛП.
Статистическая обработка состояла из оценки достоверности и различий между двумя независимыми признаками непараметрических критериев, используя U-критерий Вилкоксона –Манна –Уитни. Для изучения линейной зависимости между признаками применяли корреляционный анализ с расчетом критериев Спирмена. Для количественных параметров определялось среднее значение, для качественных показателей – частоты (%).
РЕЗУЛЬТАТЫ
В исследовании, при анализе анатомии впадения ЛВ в ЛП (рис.1) на МСКТ, мы получили следующие результаты: типичное впадение ЛВ наблюдалось в 58% случаев, сближенные устья ЛВ -26%, стволом ЛВ впадали в ЛП в 16% случаев. Сопоставление анатомии впадения ЛВ в ЛП с формами ФП представлены в таблице 1. Провести статистический анализ между анатомией ЛВ и формами ФП оказалось затруднительным в связи с небольшим количеством пациентов в группах.
Таблица 1. Анатомия впадения ЛВ в ЛП и формы ФП.
|
Анатомия ЛВ/форма ФП |
Пароксизмальная форма ФП | Постоянная
форма ФП |
Персистирующая форма ФП |
| Типичное впадение ЛВ (58%) | 31% | 7% | 18% |
| Устья ЛВ сближены (26%) | 18% | 7% | 7% |
| Общий ствол ЛВ (16%) | 0% | 12% | 7% |
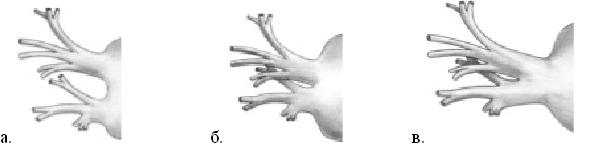
Рис. 1. Варианты строения легочных вен. а) типичное впадение ЛВ 58%; б) сближенные ЛВ 26%; в) общий ствол 16%.
По данным МСКТ объем ЛП в систолу ЛЖ варьировал от 80 мл до 342 мл, в среднем составил 166±67,2 мл, а в диастолу ЛЖ от 49 мл до 304мл, в среднем — 141,2±54,9мл (рис.2).
 Рис. 2. МСКТ. Объем левого предсердия с учетом ушка. 3D-реконструкция левого предсердия и легочных вен: а) в систолу ЛЖ (166±67,2мл); б) в диастолу ЛЖ (141,2±54,9мл).
Рис. 2. МСКТ. Объем левого предсердия с учетом ушка. 3D-реконструкция левого предсердия и легочных вен: а) в систолу ЛЖ (166±67,2мл); б) в диастолу ЛЖ (141,2±54,9мл).
Среди обследованных пациентов данных за тромбоз ушка ЛП на МСКТ и МРТ получено не было, что подтверждено интраоперационно.
При анализе функции ЛП у пациентов с ФП фракция выброса в среднем составила 17±2%. При этом статистический анализ не выявил значимой корреляции между фракцией выброса, ударным объемом ЛП и распространенностью фиброза ЛП (r = 0.08 и r=0.13 соответственно).
Так же у обследованных пациентов размер фиброзного кольца митрального клапана составил 34,6±5,01мм. Мы не выявили корреляции размера фиброзного кольца митрального клапана с объемом ЛП. Однако, в свою очередь, была выявлена высокая линейная зависимость с конечным диастолическим объемом ЛЖ (r=0.77)(рис.4).
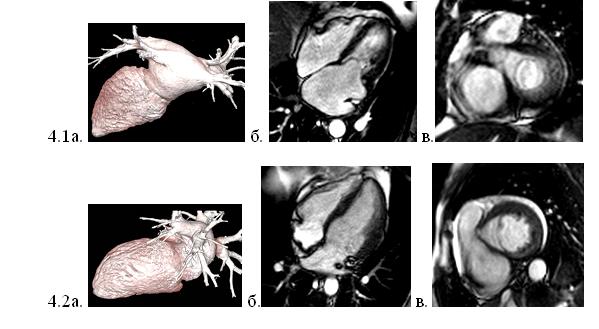
Рис. 4. Объем ЛЖ и фиброзное кольцо МК.
4.1. Пациент с дилатированным ЛП и нормальными размерами фиброзного кольца митрального клапана. а) МСКТ. 3D-реконструкция ЛЖ и ЛП; б) Кино МРТ- 4-х камерная плоскость; в) Кино МРТ – короткая ось на уровне фиброзного кольца митрального клапана.
4.2. Пациент с большим объемом ЛЖ и расширенным фиброзным кольцом митрального клапана. а) МСКТ. 3D-реконструкция ЛЖ и ЛП; б) Кино МРТ- 4-х камерная плоскость; в) Кино МРТ – короткая ось на уровне фиброзного кольца митрального клапана. Плоскости идентичны.
Анализируя МРТ данные о наличии фиброзных изменений ЛП, мы получили следующие локализации фиброза: по межпредсердной перегородке, свободным стенкам ЛП, фиброзному кольцу и створкам митрального клапана. При сравнении распространенности фиброза ЛП с объемом ЛП мы не получили взаимосвязи (r=0.18). Наличие и распространенность фиброза ЛП не имели корреляции с объемом митральной регургитации (11,08±9,7мл) (r=0,11).
ОБСУЖДЕНИЕ
Данное исследование состояло из анализа анатомических и функциональных параметров ЛП у больных с ФП на МСКТ и МРТ. На МСКТ анализировали объем, фракцию выброса и размеры ЛП, ушко ЛП, варианты впадения ЛВ в ЛП. На МРТ оценивали наличие и распространенность фиброза ЛП, митральную регургитацию, объемные показатели ЛЖ, фиброзное кольцо митрального клапана, необходимо для дальнейшего прогноза отдаленных последствий в послеоперационном периоде пациентов с ФП.
По литературным данным фракция выброса ЛП у здорового человека составляет более 50%, а при фракции выброса ЛП менее 50% оценивают функцию левого предсердия как декомпенсированную с высоким риском развития легочной гипертензии [6]. В ходе работы, мы выявили большой объем ЛП (146± 55,9мл) и низкую фракцию выброса ЛП (17±2%), что свидетельствовало о декомпенсации функции ЛП.
В ходе работы мы отметили тенденцию расширения фиброзного кольца вслед за увеличением объема левого желудочка (r=0.77), что может свидетельствовать о длительности и тяжести ФП, а так же о развитии сердечной недостаточности. Увеличение объема ЛЖ и, как следствие, расширение фиброзного кольца митрального клапана является результатом аритмогенной кардиомиопатии. Аритмогенная кардиомиопатия развивается вследствие длительно существующей тахисистолической формы ФП, и проявляется сердечной недостаточностью различной степени тяжести. Клиника сердечной недостаточности напрямую зависит от фракции выброса левого желудочка и степени недостаточности митрального клапана.
В последнее время в мировой литературе все чаще обсуждаются возможности МРТ в диагностике и детальной оценке фиброза миокарда ЛП у пациентов с ФП. Проводятся как клинические, так и экспериментальные исследования. Многие авторы предлагают рассматривать в качестве основного этиологического фактора в развитии ФП воспалительный процесс в ЛП, исходом которого может стать формирование фиброза в миокарде ЛП [9].
Так, исследователи из Центра изучения аритмий при Университете штата Юта обнаружили, что МРТ с отсроченным контрастированием может использоваться для оценки степени и распространенности фиброза левого предсердия [12]. В свою очередь, от степени и распространенности фиброза ЛП напрямую зависит эффективность электрофизиологических процедур при ФП [8]. По нашим данным, на МРТ, при оценке фиброзных изменений миокарда ЛП, очаги повреждения имели различную локализацию. При детальном анализе, сопоставляя результаты обоих компьютерных томографов, мы получили данные о том, что наличие и распространенность фиброза левого предсердия не коррелировали с объемом ЛП (r=0.18). Так, в исследование вошли пациенты, у которых были большие объемы ЛП, но распространенность фиброза была минимальной или отсутствовала (рис.3), и наоборот, встречались пациенты с нормальными размерами ЛП, но с выраженным фиброзом миокарда ЛП (рис.3). Исходя из этого, можно предположить, что в формировании фиброза играют роль не только механические факторы, но и более сложные патогенетические механизмы, что согласуется с данными литературы.

Рис. 3. Распространенность фиброза (МРТ-данные) и объем ЛП (КТ-данные). а- МСКТ ЛП и ЛВ. 3D-реконструкция; б, в – МРТ, инверсия-восстановление (PSIR) 4- (б) и 2-камерная плоскость (в), фиброзные изменения стенок ЛП (стрелка), г- МСКТ ЛП и ЛВ. 3D-реконструкция; д, е – МРТ, инверсия-восстановление (PSIR) 4- (д) и 2-камерная плоскость (е), фиброзные изменения отсутствуют.
ВЫВОД
По данным нашей работы, очаги фиброзных изменений миокарда ЛП не зависели от объема ЛП и фракции выброса ЛП и митральной регургитации.
Имелась высокая линейная корреляция между конечным диастолическим объемом левого желудочка и размером фиброзного кольца митрального клапана.
Взаимодополняющие компьютерные методы исследования дают полную картину анатомических и функциональных параметров ЛП у пациентов с ФП и могут быть рекомендованы к клиническому применению в составе оптимального алгоритма предоперационного обследования.
СПИСОК ЛИТЕРАТУРЫ
- Александрова С.А. «Спиральная компьютерная ангиография в оценке анатомии легочных вен у больных с фибрилляцией предсердий» Автореф. дисс. к.м.н., Москва, 2004.
- Бокерия Л.А., Макаренко В.Н., Александрова С.А., Глазкова Е.Ю. Диагностика тромбоза ушка левого предсердия методом мультидетекторной компьютерной томографии. — Грудная и сердечно-сосудистая хирургия.- —№3.С.4—8.
- Бокерия Л.А., Оганов Р.Г.Клинические рекомендации по диагностике и лечению пациентов с фибрилляцией предсердий. — Вестник аритмологии 2010.— С. 53—57.
- Бокерия Л. А., Ревишвили А. Ш. и др.Рекомендации по лечению больных с нарушениями ритма сердца. — 2005. — С. 181—237. — 237 с.
- Бокерия Л.А., Ревишвили А.Ш. Современный подходы к нефармакологическому лечению фибрилляции предсердий. – 2006.
- Бузаев И.В. «Прогнозирование изменений центральной гемодинамики и выбор метода пластики левого желудочка при хронических аневризмах сердца» Автореф. дисс. к.м.н., Новосибирск, 2006.
- Гринь В.К.,Кравченко Т.В., Филюк А.В., Эстрин С.И.
Устранение фибрилляции предсердий у больного с дилатационной кардиомиопатией. ВА-N51 от 14/04/2008, стр. 58-60. - Ревишвили А.Ш., Рзаев Ф.Г., Ханкишева Ф.Р., Джорджикия Т.Р. Отдаленные результаты интервенционного лечения стабильной и хронической форм фибрилляции предсердий. ВА-N45 от 11/10/2006, стр. 27-34.
- Тарасова О.А. Показатели воспаления при фибрилляции предсердий у пациентов с артериальной гипертонией, их связь с факторами риска сердечно-сосудистых заболеваний. Российский кардиологический журнал. № 3 2007, стр. 18-23.
- Benjamin EJ, Wolf PA, D’Agostino RB, Silbershatz H, Kannel WB, Levy D (1998). «Impact of atrial fibrillation on the risk of death: the Framingham Heart Study». Circulation 98 (10): 946–52.PMID 9737513.
- Daniel Perry, Alan Morris, Robert MacLeod, Joshua Cates. – Automatic detection of left atrial fibrosis and scar tissue in cardiac LGE MRI using unsupervised learning. – CARMA center , University of Utah; 675 Arapeen Drive, Suite 102B; Salt Lake City, UT 84108,
- Gaston R. Vergara, M.D. and Nassir F. Marrouche, M.D. Tailored Management of atrial Fibrillation Using a LGE-MRI Based Model: From the Clinic to the Electrophysiology Laboratory. — University of Utah, Salt Lake City, Utah, USA. – J cardiovasc Electrophysiol, Vol. pp. 1-7.
- Go AS, Hylek EM, Phillips KA, et al. (May 2001). «Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the An Ticoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study». JAMA 285 (18): 2370–5.
- Lloyd-Jones DM, Wang TJ, Leip EP, et al. (August 2004). «Lifetime risk for development of atrial fibrillation: the Framingham Heart Study». Circulation 110 (9): PMID 15313941.
- Marcos Daccarett, Troy J. Badger, Nazem Akoum. Association of Left Atrial Fibrosis Detected by Delayed-Enhancement Magnetic Resonance Imaging and the Risk of Stroke in Patients With Atrial Fibrillation. J Am Coll Cardiol, 2011; 57:831-838.
- Narumiya T, Sakamaki T, Sato Y, Kanmatsuse K (2003 January). «Relationship between left atrial appendage function and left atrial thrombus in patients with nonvalvular chronic atrial fibrillation and atrial flutter». Circulation Journal 67 (1): 68–72. DOI:1253/circj.67.68. PMID 12520155.
- Nazem Akoum, Marcos Daccarett, Chris Mcgann, Nathan Segerson, Gaston Vengara, Suman Kuppahally, Troy Badger, Nathan Burgon, Thomas Haslam, Eugene Knolmovski. – Atrial Fibrosis Helps Select the Appropriate Patient and Strategy in Catheter Ablation of Atrial Fibrillation. – Carma Center, University of Utah, Salt Lake City, Utah, USA. – J of Cardiovascular Electrophysiology. Vol. 22, No. 1, January 2011 – P. 16-22.
- Peter Rubin; Robert I. Simon MD; Douglas L. Mann MD FACC; Douglas S. Fenton MDBraunwald’s Heart Disease: A Textbook of Cardiovascular Medicine, 2-Volume Set: Expert Consult Premium Edition — Enhanced Online Features and Print. — Philadelphia: Saunders, 2011. — ISBN 1-4377-2708-5
- Rashed Karim, Hannah Cliffe, Jaspal Gill Reza Razavi, Tobias Schaeffter, Kawal Rhode. — A Fast and Automatic Segmentation of Left Atrial Fibrosis from Delayed-Enhancement MRI. — Department of Imaging Sciences and Biomedical Engineering Kings London, United Kindom.
- Wei-Shiang Lin., Prakash V.S., Ching-Tai Tai, Ming-Hsiung Hsieh et al. Pulmonary vein morphology in patients with paroxysmal atrial fibrillation by ectopic beats originating from the pulmonary veins (implications for catheter ablation) // Circulation. — 2000- . Vol 101. — P. 1274 — 1281.[schema type=»book» name=»ОЦЕНКА АНАТОМО-ФУНКЦИОНАЛЬНЫХ ПАРАМЕТРОВ ЛЕВОГО ПРЕДСЕРДИЯ У БОЛЬНЫХ С ФИБРИЛЛЯЦИЕЙ ПРЕДСЕРДИЙ МЕТОДАМИ КОМПЬЮТЕРНОЙ ТОМОГРАФИИ» author=»Л.А. Бокерия, В.Н. Макаренко, С.А. Александрова, З.З. Иванова» publisher=»басаранович екатерина» pubdate=»2017-06-05″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_ 30.12.2014_12(09)» ebook=»yes» ]

