В Научном Центре сердечно-сосудистой хирургии им. А.Н. Бакулева с 2008 по 2013 гг было обследовано 35 больных c ишемической болезнью сердца и онкопатологией, которым первым этапом была выполнена реваскуляризация миокарда – ангиопластика со стентированием коронарных артерий, а вторым этапом было проведено лечение онкопатологии.
Первый этап лечения — реваскуляризация миокарда был выполнен в НЦ ССХ им. А.Н. Бакулева. Второй этап лечения был проведен в онкологических клиниках (РОНЦ им Н.Н. Блохина и др.).
В исследование вошли 30 мужчин и 5 женщин. Возраст больных колебался от 56 до 79 лет, средний возраст составил 66,5 лет +/- 6,4.
У подавляющего большинства больных было диагностировано злокачественное заболевание желудочно-кишечного тракта — у 12 (34,3%) больных и онкоурология – у 11 (31,4%) пациентов, у 6 (17,1%) пациентов были диагностированы злокачественные заболевания легких.
У 33 (94,3%) пациентов не было отмечено признаков генерализации онкологического процесса с наличием отдаленных метастазов — только у 2 (5,7%) пациентов был выявлен рецидив онкозаболевания после ранее проведенного радикального лечения. У 13 (37,1%) больных перед реваскуляризацией миокарда уже были проведены курсы химиотерапии/лучевой терапии.
Из 35 больных, перед проведением реваскуляризации миокарда стенокардия 2 ФК отмечена у 11 (31,4%) пациентов, у 9 (25,7%) — 3 ФК, а у 4 (11,4%) больных — 4 ФК по классификации ССS. У 9 (25,7%) пациентов отмечена безболевая ишемия миокарда и у 2 (5,7%) больных – нестабильная стенокардия (рис 1).
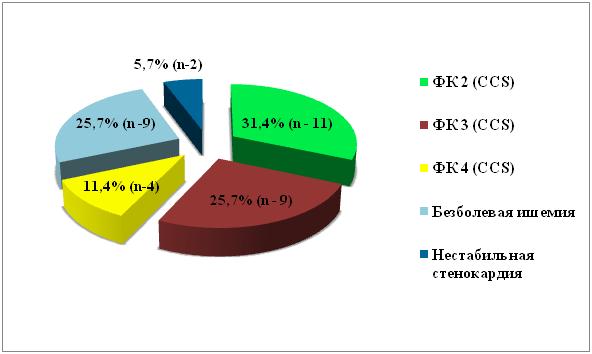
Рис №1. Распределение больных в зависимости от клинических проявлений ИБС
Большинство пациентов (97,1%) имели IIA стадию недостаточности кровообращения и 1 (2,9%) — I стадию НК. Пациенты с декомпенсацией сердечной недостаточности не были включены в исследование.
У 16 (45,7%) больных в анамнезе был инфаркт миокарда (ИМ), а 5 (14,3%) пациентов переносили ИМ дважды. У 5 (14,3%) больных ранее уже было выполнено эндоваскулярное вмешательство с ангиопластикой и стентированием коронарных артерий, у 1 (2,8%) пациента ранее было выполнено аорто-коронарное шунтирование. Почти у всех пациентов (34 – 97,1%) была выявлена артериальная гипертензия, мультифокальный атеросклероз диагностирован у 13 (37,1%), хроническая обструктивная болезнь легких – у 13 (37,1%), сахарный диабет – у 6 (17,1%), хроническая почечная недостаточность – у 3 (8,5%), ожирение II-III степени — у 20 (57,1%) пациентов.
По данным коронарографии у 7 (20%) пациентов были выявлены значимые стенозы одной коронарной артерии, у 11 (31,4%) – двух и у 17 (48,6%) – трех и более коронарных артерий (рис 2).
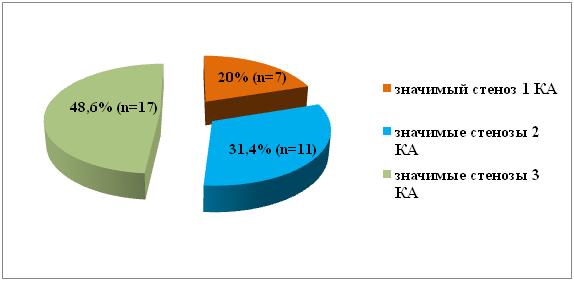
Рис № 2. Результаты коронарографии
- Непосредственные результаты эндоваскулярной реваскуляризации миокарда, выполненной первым этапом у больных с онкопатологией
Перед проведением реваскуляризации все пациенты получали двойную антитромбоцитарную терапию, включая ацетилсалициловую кислоту в дозе 300 мг/сутки и клопидогрел в дозе 75 мг/сутки. Непосредственно перед реваскуляризацией миокарда была проведена оценка уровня агрегации тромбоцитов с аденозиндифосфатом (целевой уровень агрегации тромбоцитов перед выполнением чрезкожного коронарного вмешательства – менее 45%).
У всех 35 пациентов была выполнена реваскуляризация миокарада, в том числе у 15 (42,8%) – полная реваскуляризация, а у 20 (57,1%) – неполная реваскуляризация. Стенты без лекарственного покрытия были имплантированы 23 (65,7%) больным (от 1 до 4 стентов, в среднем – 2 стента), с лекарственным покрытием — 12 (34,3%) пациентам (от 1 до 6 стентов, в среднем 2,2 стента). Тип используемого стента определяли в каждом случае индивидуально, исходя из сроков предполагаемого вмешательства по поводу онкопатологии, анатомии коронарного русла, а также характера атеросклеротического поражения коронарных артерий.
В ранние сроки после проведения реваскуляризации миокарда ни у одного из пациентов не было отмечено клиники стенокардии, при этом всем больным с безболевой ишемией миокарда (n = 11) после реваскуляризации был выполнен нагрузочный тест — стресс ЭХО КГ или сцинтиграфия миокарда для оценки результатов эндоваскулярного лечения ИБС.
У 16 (45,7%) пациентов перед реваскуляризацией миокарда было выявлено снижение ФВ левого желудочка (среднее значение ФВ 48,7 +/- 4,4%). После проведения реваскуляризации миокарда у 5 из 16 больных с исходно сниженной ФВ левого желудочка (среднее значение ФВ — 45,4% +/- 5,4%) по данным контрольной ЭХО КГ на момент выписки из отделения было отмечено увеличение ФВ левого желудочка в среднем на 8,8% (среднее значение ФВ после реваскуляризации миокарда составило 53,8 +/- 2,4, р = 0,013). У остальных 11 больных со сниженной ФВ левого желудочка не было отмечено увеличения ФВ левого желудочка при выписке.
Все пациенты были выписаны в удовлетворительном состоянии (отсутствие клиники стенокардии, расширение двигательной активности) через 2-3 дня после чрезкожного коронарного вмешательства на фоне тщательно подобранной медикаментозной терапии, включая ингибиторы АПФ, бета адреноблокаторы, двойную антиагрегантную терапию, статины.
- Результаты второго этапа лечения больных с ИБС и онкопатологией в течение года после реваскуляризации миокарда
Всем пациентам вторым этапом было проведено лечение онкопатологии в сроки от 1 месяца до 16 месяцев после реваскуляризации миокарда (в среднем через 2,9 +/- 3,4 месяца). Хирургическое лечение онкопатологии было выполнено 16 (45,7%) пациентам, 16 (45,7%) больным была проведена химиотерапия или лучевая терапия и 3 (8,6%) — комбинированное лечение (рис. 3).
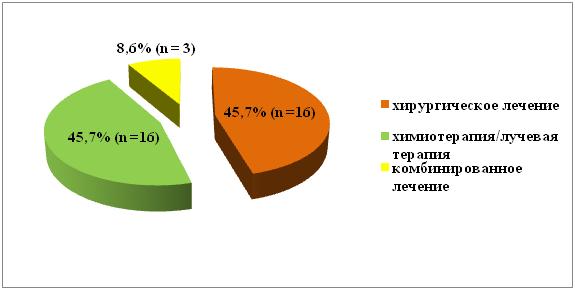
Рис № 3. Второй этап — лечение онкопатологии
Всем пациентам, которым было выполнено радикальное хирургическое лечение онкозаболевания, за 5-7 дней до второго этапа оперативного вмешательства была проведена отмена антиагрегантов с назначением низкомолекулярного/нефракционированного гепарина с отменой введения последнего в день хирургического вмешательства. После проведения оперативного лечения антиагреганты были назначены в первые 6 — 48 часов в зависимости от риска развития послеоперационных геморрагических и тромботических осложнений.
У всех больных было отмечено гладкое течение раннего послеоперационного периода. Не было зарегистрировано ни одного случая острого нарушения коронарного кровообращения в интраоперационном периоде. По представленным данным ни у одного из пациентов не было отмечено интраоперационной кровопотери значимо отличавшейся от больных без исходной реваскуляризации. Не было также интраоперационной и госпитальной летальности.
Следует отметить, что все пациенты после проведения ЧКВ и в последующем получали двойную антиагрегантную терапию – ацетилсалициловую кислоту в дозе 300 мг в течение 3 месяцев с дальнейшим снижением дозы до 100 мг и клопидогрел в дозе 75 мг, а также адекватную гипотензивную терапию, включая ингибиторы АПФ, бета адреноблокаторы медленных кальциевых каналов, статины.
Не было отмечено и случаев острой сердечной недостаточности во время и в ранние сроки после проведения лечения онкопатологии.
У 3 (8,5%) пациентов был выявлен возврат клиники стенокардии в течение года после реваскуляризации миокарда, что потребовало выполнения контрольной коронарографии с последующей реваскуляризацией миокарда (при коронарографии были выявлены значимые рестенозы в ранее имплантированных стентах). У первого пациента клиника стенокардии возникла через 6 месяцев после чрезкожного вмешательства (ранее была проведена имплантация стента с лекарственным покрытием) в период прохождения курсов химиотерапии. У второго пациента рецидив стенокардии возник через 12 месяцев после первого этапа — реваскуляризации миокарда. Второй этап – хирургическое лечение рака желудка был выполнен через 1,5 месяца после эндоваскулярной реваскуляризации миокарда с использованием стента без лекарственного покрытия. Третьему пациенту повторная реваскуляризация миокарда была выполнена через 3 месяца после первичной реваскуляризации в связи с возникновением рецидива стенокардии – были выявлены рестенозы в ранее имплантированных стентах (без лекарственного покрытия). Через 6 месяцев после повторной реваскуляризации миокарда больному было выполнено хирургическое лечение онкопатологии – нефрэктомия. Всем этим пациентам при повторной реваскуляризации были имплантированы стенты с лекарственным покрытием.
Летальность после выполнения двухэтапного хирургического лечения ИБС и онкопатологии (в течение года после реваскуляризации миокарда) составила 14,3%. Причиной смерти у 5 больных через 2-3 месяца после ЧКВ явилась онкопатология (этим пациентам после реваскуляризации миокарда была выполнена только химиотерапия).
- Обсуждение
Необходимость первичной реваскуляризации миокарда у пациентов с ишемической болезнью сердца и стенокардией 3-4 ФК, а также безболевой ишемией миокарда, которым планируется хирургическое лечение некардиальной патологии, на настоящий момент не вызывает сомнений.
Так, по данным Шестопаловой И.М. (2010 год), реваскуляризация миокарда, выполненная первым этапом у больных с ИБС (со стенокардией 3-4 ФК) и онкопатологией по сравнению с группой пациентов, которым была проведена только медикаментозная терапия перед хирургическим лечением онкозаболевания, имеет значительные преимущества. Был проведен анализ результатов второго этапа — хирургического лечения онкопатологии торако-абдоминальной локализации у этих двух групп. Так, в первой группе (в этой группе 7 пациентам было выполнено стентирование коронарных артерий, 17 – аортокоронарное шунтирование) была отмечена меньшая частота возникновения сердечной недостаточности в раннем послеоперационном периоде по сравнению с группой пациентов, которые получали только медикаментозную терапию (20 пациентов); также в группе первичной реваскуляризации была отмечена меньшая летальность после проведения хирургического лечения онкопатологии [1, с. 10].
И хотя очевидна высокая эффективность первичной реваскуляризации миокарда у пациентов с ИБС и сопутствующей онкопатологией, по-прежнему, остаются до конца нерешенными ряд вопросов ведения этих больных. Проблема двойной дезагрегантной терапии у пациентов с имплантированными стентами, которым планируется хирургическое вмешательство по поводу онкопатологии, стоит особенно остро.
Так, преждевременная отмена антиагрегантной терапии перед выполнением хирургического лечения у пациентов с имплантированными стентами является по мнению Hawn M.T. наиболее значимым предиктором тромбоза стента [3, с. 10].
По данным KałuzaG.L. отмечено увеличение смертности на 20% в связи с интраоперационным тромбозом стентов у пациентов, которым была выполнена операция в течение нескольких недель после проведения стентирования коронарных артерий на фоне отмены дезагрегантов [4, с. 10].
В последних Европейских рекомендациях (2014 год) по оценке кардиального риска перед оперативным лечением некардиальной патологии у пациентов с недавно имплантированными стентами рекомендуется отложить проведение оперативного вмешательства до завершения полного курса двойной антитромбоцитарной терапии (при имплантации стентов без лекарственного покрытия – минимум 4 недели, оптимальный срок – 3 месяца, в случае применения нового поколения стентов с антипролиферативным покрытием – минимум 3 месяца), а для пациентов с высоким риском возникновения сердечно – сосудистых осложнений рекомендуется применение двойной антитромбоцитарной терапии в течение 1 года независимо от типа имплантированного стента [5, с. 10]. Также, согласно этим рекомендациям, следует по возможности выполнять хирургическое лечение на фоне аспирина.
Важно отметить, что у пациентов с онкопатологией имеется склонность к повышенной свертываемости крови, что может создавать дополнительные трудности при отмене антиагрегантов перед проведением хирургического лечения.
В частности, в ряде исследований повышенный уровень фибриногена коррелировал с распространенностью онкологического процесса [2;6, с 10].
В проведенным нами исследовании более, чем у половины больных (n = 19), был отмечен повышенный уровень фибриногена – более 4 г/л (среднее значение 5,3+/- 0,9 г/л).
За 5-7 дней до выполнения хирургического лечения онкопатологии у всех пациентов была проведена отмена антиагрегантов с назначением низкомолекулярного/нефракционированного гепарина, с последующей отменой антикоагулянтов в течение 6-48 часов после выполнения оперативного вмешательства и возвратом к двойной антитромбоцитарной терапии.
В Европейских рекомендациях 2014 года рекомендуется избегать применения низкомолекулярного гепарина как «моста» к выполнению хирургического лечения у пациентов с недавно имплантированными стентами, которые продолжают получать двойную антитромбоцитарную терапию и имеющих высокий риск тромбоза стента в интраоперационном периоде. Как альтернативу низкомолекулярному гепарину в этих случаях рекомендуется рассмотреть блокаторы гликопротеиновых рецепторов IIbIIIa [5, с 10].
Сложности применения антиагрегантной терапии у больных с ИБС и онкопатологией перед проведением хирургического лечения требует в каждом конкретном случае индивидуального подхода с учетом риска тромбоза стента/кровотечения.
В данном исследовании при выполнении второго этапа в интраоперационном и раннем послеоперационном периодах не было отмечено ни геморрагических, ни тромботических осложнений на фоне отмены дезагрегантной терапии перед проведением радикального лечения онкопатологии. Не было отмечено также и госпитальной летальности.
По данным многоцентрового реестра по oценке исходов чрезкожного коронарного вмешательства у пациентов с онкопатологией (208 больных), перенесших острый инфаркт миокарда с подъемом сегмента ST, было отмечено увеличение смертности от сердечно-сосудистых осложнений в два раза по сравнению с группой контроля (пациенты без сопутствующей онкопатологии). При этом, более высокая летальность была выявлена у пациентов с диагностированным онкологическим заболеванием в течение 6 месяцев перед выполнением эндоваскулярной реваскуляризации миокарда. У этих пациентов также прослеживается связь с ранней сердечной смертностью после выполнения чрезкожного коронарного вмешательства [7, с.10].
Однако, по данным зарубежных авторов имеется и положительный опыт первичной реваскуляризации у этой категории больных. По данным Voltolini L. et al резекция легкого по поводу рака после первичного чрезкожного коронарного вмешательства у 16 пациентов (всем пациентам были имплантированы стенты без лекарственного покрытия) показала хорошие непосредственные и отдаленные результаты. При среднем сроке наблюдения 30 дней ни у одного пациента не было выявлено признаков ишемии миокарда, 5 (31%) пациентов умерли из-за метастазирования. Пятилетняя выживаемость составила 53% [8, с.10].
В нашем исследовании все летальные исходы в течение нескольких месяцев после реваскуляризации миокарда не были связаны с сердечно-сосудистыми событиями, а были обусловлены генерализацией онкологического процесса.
Список литературы
1. Шестопалова И.М. Стратегия диагностики и лечения ишемической болезни сердца в торако-абдоминальной онкохирургии. Автореф. диссертации доктора мед.наук. М.; 2010 г.
2. Guo Q, Zhang B, Dong X, Xie Q, GuoE, Huang H. et. al. Elevated levels of plasma fibrinogen in patients with pancreatic cancer: possible role of a distant metastasis predictor. Pancreas. 2009 Apr;38(3):e75-9
3. Hawn M.T., Graham L.A., Richman J.S., Itani K.M., Henderson W.G., Maddox T.M. Risk of major adverse cardiac events following noncardiac surgery in patients with coronary stents. JAMA 2013;310(14):1462-1472.
4. Kałuza G.L., Joseph J., Lee J.R., Raizner M.E., Raizner A.E. Catastrophic outcomes of noncardiac surgery soon after coronary stenting. J Am Coll Cardiol 2000;35(5):1288-1294.
5. Kristensen S.D., Knuuti J., Saraste A., Anker S., Bøtker H.E., De Hert S.et al. 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management: The Joint Task Force on non-cardiac surgery: cardiovascular assessment and management of the European Society of Cardiology (ESC) and the European Society of Anaesthesiology (ESA). Eur Heart J. 2014 Sep 14;35(35):2383-431.
6. Lee S.E., Lee J.H., Ryu K.W., Nam B.H., Cho S.J., Lee J.Y.,et al. Preoperative plasma fibrinogen level is a useful predictor of adjacent organ involvement in patients with advanced gastric cancer. J Gastric Cancer. 2012 Jun;12(2):81-87
7. Velders M.A., Boden H., Hofma S.H., Osanto S., van der Hoeven B.L., Heestermans A.A. еt al. Outcome after ST elevation myocardial infarction in patients with cancer treated with primary percutaneous coronary intervention. Am J Cardiol. 2013;112(12):1867-72.
8. Voltolini L, Rapicetta C., Luzzi L., Paladini P., Ghiribelli C., Scolletta S. et al. Lung resection for non-small cell lung cancer after prophylactic coronary angioplasty and stenting: short- and long-term results. Minerva Chir.2012;67(1):77-85[schema type=»book» name=» НЕПОСРЕДСТВЕННЫЕ РЕЗУЛЬТАТЫ ДВУХЭТАПНОГО ЛЕЧЕНИЯ БОЛЬНЫХ С ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА И ОНКОПАТОЛОГИЕЙ» author=»Домбровский Михаил Михайлович, Никитина Татьяна Георгиевна, Алекян Баграт Гегамович, Бокерия Леонид Антонович» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-06-04″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_ 30.12.2014_12(09)» ebook=»yes» ]

