ВВЕДЕНИЕ
Пептидная регуляция является одной из важнейших и многофункциональных систем у всех живых организмов. Образование регуляторных пептидов тканеспецифично и представляет собой результат протеолитической деградации ряда функционально важных белков: гемоглобина, актина, ряда внутриклеточных ферментов в протеосомах [1, 2].
Было обнаружено образование пептидных соединений, являющихся фрагментами гемоглобина и актина в эритроцитах человека [3, 4]. Авторами показано, что протеолиз гемоглобина в эритроцитах приводит к образованию около 50 пептидов, обладающих различной биологической активностью. Кроме того, процесс генерации пептидов проходит двуступенчато: эндопептидазами, а затем экзопептидазами. Это косвенно подтверждает то, что протеолитический комплекс ферментов в эритроцитах может быть частично представлен сохранившимися каталитическими протеасомными субъединицами. Возможно также частичное сохранение ряда регуляторных механизмов, обнаруживаемых в протеасомах других клеток [1, 2].
Наличие регуляции процесса производства пептидов в эритроцитах подтверждается полученными нами ранее данными о зависимости уровня производства пептидов в эритроцитах человека от количества цАМФ, состояния рецепции и возраста клеток, а также от содержания ионов кальция и магния в инкубационной среде, то есть данный процесс подвержен значительной регуляции [5, 6].
Возможным механизмом регуляции протеолитических ферментов протеасом кроме фосфорилирования может служить процесс гликозилирования протеосомных белков или самого гемоглобина.
Таким образом, представляет определенный интерес исследование изменений пула генерируемых пептидов в условиях гипергликемии, сопровождающей течение сахарного диабета, особенно, в связи с тем, что из эритроцитов в кровь попадают пептидные соединения, обладающие определенной биологической активностью [7]. Изменение спектра биологически активных соединений в условиях избытка глюкозы в крови может сопровождаться определенными регуляторными сдвигами гомеостаза.
Основными методами, применяемыми авторами при исследовании спектра эритроцитарных пептидов является ВЭЖХ и электрофорез в ПААГ [2,3].
В настоящее время мало работ, посвященных изучению спектра пептидных соединений методом капиллярного электрофореза, который отличается высокой эффективностью, большой производительностью и точностью [8].
Целью данного исследования стало изучение общего количества и спектра пептидных соединений, выделяемых эритроцитами человека в инкубационную среду в условиях гипергликемии и нормогликемии, а также эритроцитами пациентов с сахарным диабетом Ι типа методом капиллярного электрофореза.
МАТЕРИАЛЫ И МЕТОДЫ
В проведенных исследованиях использовалась свежезабранная венозная кровь доноров и пациентов с сахарным диабетом Ι типа. Количество исследуемых образцов составило порядка 25 в каждой изучаемой группе. Средний возраст доноров составил 28,4±1,7 лет, пациентов 25,8 ±1,7 лет с длительностью заболевания 3-5 лет. Средний уровень глюкозы в крови пациентов составил 6,59 ±0,92 мМоль. Свежая донорская кровь любезно предоставлена Самарской Областной стацией переливания крови. Фракцию чистых эритроцитов получали после первичного центрифугирования в режиме 500g, 10 минут и удаления плазмы и лейкоцитарной пленки. Далее осуществляли 4-х кратное отмывание холодным раствором PBS, t +4 ºС в том же режиме центрифугирования, каждый раз удаляя верхний слой, содержащий лейкоциты. Чистоту полученных фракций эритроцитов проверяли микроскопически после окраски мазков по Романовскому. Пробы помещали в пробирки, обработанные силиконовой жидкостью (Sigma). Далее проводили инкубацию эритроцитов в растворе Рингера-Локка (нормогликемия – 5 мМ/л глюкозы; гипергликемия – 10 мМ/л глюкозы) в соотношении 1:1, при 37ºС в течение 60 минут, при периодическом осторожном перемешивании каждые 5 минут (во избежании гемолиза). Затем инкубационную среду отделяли центрифугированием в том же режиме. Эритроциты депротеонировали с помощью 10%-ной ТХУ кислоты в соотношении 1:3 и центрифугировали при 1000g 15 минут.
В инкубационной среде и надосадочной жидкости определяли содержание пептидных соединений по методу Лоури [7]. Спектр пептидов исследовали в инкубационной среде (без протеонирования) методом капиллярного электрофореза на приборе «Капель 105М» с СФ-детектором и системой жидкостного охлаждения, кварцевые капилляры с внутренним диаметром 75 мкм и эффективной длиной 50 cм, ООО. Люмекс, г.Санкт-Петербург. Для кондиционирования ежедневно перед работой капилляр последовательно промывали следующим образом: 10 минут дистиллированной водой, 5 мин раствором 0,5 М соляной кислоты, 5 мин дистиллированной водой, 5 мин раствором 0,5 М гидроксида калия, 5 мин дистиллированной водой. Перед каждым анализом капилляр промывали раствором ведущего электролита (0,1 М боратный буфер, рН 9,17) в течение 10 минут. Детектирование проводили в УФ области света при длине волны 254 нм, что позволяет выявить пептиды, содержащие остатки ароматических аминокислот, а также в условиях высокой концентрации пептидных соединений регистрировать и не содержащие таковых, использовали гидродинамический способ ввода пробы. Полученные электрофореграммы обрабатывали при помощи программного обеспечения «Эльфоран».
Работа осуществляется при финансовой поддержке проекта РФФИ 13-03-97013 р_Поволжье_а.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Общее содержание пептидов в инкубационной среде эритроцитов из крови доноров в условиях гипергликемии оказалось выше на 19%, чем при нормогликемии. В инкубационной среде эритроцитов из крови пациентов с сахарным диабетом Ι типа общее содержание пептидов достоверно не отличалось от условий нормогликемии, но наблюдалось высокая вариабельность данного показателя. Возможно, это обусловлено, во-первых, относительно нормальным содержанием глюкозы в крови пациентов, а также значительной разницей анамнеза больных, дозой принимаемого инсулина и маркой препарата (табл.). Следует отметить, что общее содержание компонентов в инкубационных средах, которые определяются по методу Лоури оказывалось достаточно высоким (60-90 мкг/мл).
Определение количества пептидов в эритроцитах показало, что у пациентов с сахарным диабетом Ι типа их значительно больше, чем у доноров. Уровень превышения составил более 250% (табл.).
Усиление процессов протеолиза внутри эритроцитов у больных сахарным диабетом может быть обусловлено наличием в циркулирующей популяции большего процента поврежденных клеток, что в свою очередь может быть объяснено как повреждением мембранных белков процессами неферментативного гликирования, так и повреждением рецепции клеток препаратами инсулина, адсорбированием на поверхности эритроцитов дериватов инсулина и комплексов антиген-антитело [9]. Малый выход пептидов в инкубационную среду, возможно, связан с нарушением процессов транспорта пептидов через поврежденную мембрану эритроцитов у больных сахарным диабетом Ι типа.
Отсутствие отличий в содержании пептидов в инкубационной среде, однако, сопровождается значительным изменением спектров компонентов, содержащих ароматические группировки в своем составе. Анализ усредненных электрофореграмм показал, что у доноров при инкубации в условиях нормогликемии обнаруживается один высокий пик компонента, выходящего на 5-й минуте элюирования (возможно, более малой молярной массы), а также много низких пиков среди которых два высоких пика (возможно, большей молярной массы), выходящие между 13-14-ой и 17-18-ой минутами (рис.1). При инкубации донорских эритроцитов в условиях гипергликемии спектр данных соединений менялся: среди коротких пиков в наибольшем количестве регистрируются два пика регистрируемых между 2-3-ой и 3-4-ой минутами, а также одним средним пиком (ближе к 4-ой минуте элюирования) и одним высоким (ближе к 5-ой минуте элюирования) (рис.2).
У пациентов с сахарным диабетом Ι типа нами были обнаружены в инкубационной среде также только рано выходящие соединения, содержащие ароматические группировки, которые регистрировались двумя малыми пиками (между 3-5-ой минутами элюирования) и одним высоким на 6-ой минуте элюирования (рис.3). Можно заметить, что электрофореграммы компонентов инкубационных сред донорских эритроцитов в условиях гипергликемии схожи с таковыми у инкубационных сред эритроцитов пациентов с сахарным диабетом I типа. Таким образом, гликозилирование мембранных белков и гемоглобина эритроцитов может способствовать изменению спектра компонентов, выделяемых клетками в инкубационную среду.
Присутствие в составе данных компонентов соединений с высокой биологической активностью может оказывать существенное влияние на регуляцию процессов гомеостаза у пациентов с сахарным диабетом Ι типа. Кроме того, повышение уровня глюкозы в крови характерно при многих физиологических ситуациях: постсорбционный период, острый и хронический стресс, эмоциональное напряжение и др. Возможно, что в данных условиях будет меняться спектр, а соответственно и биологическая активность, генерируемых эритроцитами в кровь биологически активных соединений, что будет сопровождаться изменениями регуляции процессов жизнедеятельности.
БЛАГОДАРНОСТИ. Авторы выражают искреннюю признательность заведующей кафедрой физической химии и хроматографии Самарского государственного университета Онучак Л.А. за возможность проведения капиллярного электрофореза проб, а также главным врачам и сотрудникам Самарской областной станции переливания крови и Самарского областного диабетического центра за предоставление материалов для исследования.
Список использованных источников
- Цимоха А.С. Протеасомы: участие в клеточных процессах // Цитология. 2010. Т.52. №4. С.277-300.
- Сорокин А.В., Ким Е.Р., Овчинников Л.П. Протеасомная система деградации и процессинга белков //Успехи биологической химии. Т.9. С. 3-76.
- Карелин А.А., Иванов В.Т. Пептидомика – новое направление постгеномных технологий // Вестник Российской академии наук. 2005. Т. 75. № 2. С. 139-148.
- М.М. Филиппова, Д.П. Хачин, О.В. Сазонова и др. Фрагменты функциональных белков в переживающей культуре эритроцитов человека // Биоорганическая химия. – – т.34. – №2. – С.160-170.
- Кленов Р.О., Кленова Н.А. Действие цАМФ на образование пептидов в эритроцитах человека в зависимости от возраста клеток // Бюлл. эксперим. биол. и мед. Т.149. № 6. С.644-648.
- Исаева А.В., Кленов Р.О., Кленова Н.А. Влияние дефицита кальция и магния на содержание пептидных соединений в эритроцитах человека при инкубации in vitro //Вестник СамГУ. Ест.-науч.серия. 2011. №8.(89) С.179-183.
- Шатаева Л.К., Хависон В.Х., Ряднова И.Ю. Пептидная саморегуляция живых систем (факты и гипотезы). – Изд-во СПб.: Наука, 2003. – 222с.
- Niya Dan, Ravindran Ganesan, Keith G. Flood, David Tsai, Van D. Determination of enantiomers in a synthetic argininal peptide using capillary zone electrophoresis and high-performance liquid chromatography// Journal of Chromatography A. V.891. P.115–127.
- А.Г. Голубев Изнанка метаболизма //Биохимия.1996. Т.61. №11. С. 38-41.
Таблица
Содержание пептидных соединений, мкг/мл
| Условия инкубации | Эритроциты | Инкубационная среда |
| нормогликемия (доноры) | 109,2±7,6 | 72,6±4,7 |
| гипергликемия (доноры) | 115,6±6,3 | 86,7±4,5* |
| Пациенты с сахарным диабетом I типа | 305,4±25,9*
|
64,9±12
|
Примечание: *P<0,01
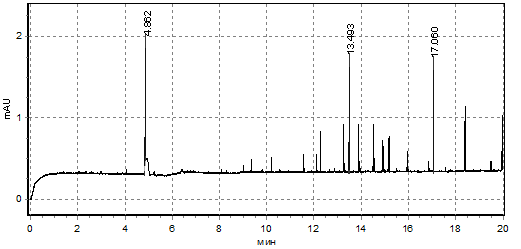
Рис.1. Усредненная электрофореграмма пептидных соединений, выделенных эритроцитами доноров в инкубационную среду (условия нормогликемии)
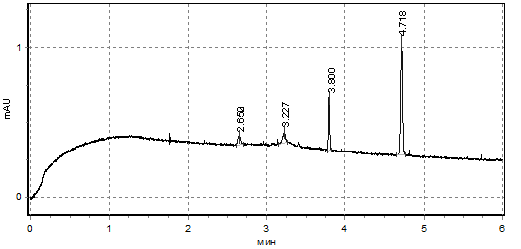
Рис.2. Усредненная электрофореграмма пептидных соединений, выделенных эритроцитами доноров в инкубационную среду (условия гипергликемии)
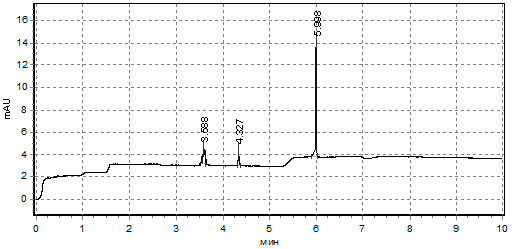
Рис. 3 Усредненная электрофореграмма пептидных соединений, выделенных эритроцитами пациентов с сахарным диабетом I типа в инкубационную среду (условия нормогликемии)[schema type=»book» name=»СПЕКТРЫ ПЕПТИДНЫХ СОЕДИНЕНИЙ, ВЫДЕЛЯЕМЫХ В ИНКУБАЦИОННУЮ СРЕДУ ЭРИТРОЦИТАМИ ЧЕЛОВЕКА В УСЛОВИЯХ ГИПЕРГЛИКЕМИИ» description=»Проведено изучение общего количества и спектра пептидных соеди-нений, поступающих в инкубационную среду Рингера-Локка из эритроцитов человека донорской крови после 60-ти минутной инкубации их при 37◦С в условиях содержания глюкозы 5 мМ/л (нормогликемия) и 10 мМ/л (гипергликемия), а также при инкубации в условиях нормогликемии эритроцитов пациентов с сахарным диабетом I типа. Общее содержание пептидов в инкубационной среде эритроцитов из донорской крови в условиях гипергликемии выше на 19%, при изучении эритроцитов из крови пациентов с сахарным диабетом Ι типа общее содержание пептидов в инкубационной среде достоверно не отличалось от условий нормогликемии для эритроцитов из крови доноров, однако внутри эритроцитов было обнаружено превышение количества пептидов более, чем в 2,5 раза. Изучение спектра пептидных соединений методом капиллярного электро-фореза выявило изменение спектра пептидов, выделяемых эритроцитами человека в инкубационную среду, как в условиях гипергликемии, так и у пациентов с сахарным диабетом I типа. » author=»Садыхова Анна Викторовна, Кленова Наталья Анатолиевна, Лебедева Елена Алексеевна» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-03-30″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_30.04.2015_04(13)» ebook=»yes» ]

