В клетках человека примерно 20 тысяч генов кодируют уже известные белки, 5 тысяч – не выясненные. Сложная организация живого мира требует не только биохимического разделения белков на семейства, но и уровневой классификации.
Белки имеют модульный (мотивы, домены) или мозаичный тип строения. Тем не менее в данной работе сделана попытка вычленения некоторых групп белков по размерности и уровням организации материи. (Таблица 1)
Таблица 1.
Размерности в белковых структурах (метафизический аспект самоорганизации)
| Размерность 1 / ноль
(1D / точка) |
Размерность 2
(2D структуры) |
Размерность 3
(шаровидные 3D структуры) |
Сложности |
| Петли, хвосты, крючки (у гистонов) | Плоскости
/ бочки-? |
Агрегаты-?, ансамбли
/ ? |
Сети / Губки |
|
Аллотропные формы углерода [углерод как основа органической химии] |
|||
| Углеродная основа органических веществ / Алмаз | Графит
|
Аморфный
углерод[1] |
? |
|
Полостные структуры углерода |
|||
| Трубки | ? | Полые сферы (фуллерены) | ? |
|
Субмолекулярный уровень |
|||
| Участки первичной структуры белка,альфа-спиральные
участки белка (петли, хвосты в молекуле белка…) / Плотные упаковки бета-складок (типа прионных) |
Бета-складчатые участки белка | Глобула
(домены) белка (с гидрофобным центром, апериодически-ми последователь-ностями) |
?Глобулы
(четвертичные структуры) Повторы в участках белка («полимеризую- щиеся»; это каждый третий белок человека [2]), амилоидогенные участки |
|
Повторы в белках [2; рис. 1] |
|||
| формирующие
размерность 1 |
формирующие
размерность 2 |
формирующие
размерность 3 |
? |
|
Молекулярный уровень |
|||
| Фибриллярные белки
— Коллаген — Эластин — Миозин — Кератин |
?Белки в виде тора
— Многие шапероны — Многие экзоток- ны бактерий — Металл-фиксиру- ющие типа гемоглобина |
Глобулярные
— Альбумин — Многие рецепторы — Белки семейст- ва иммуногло- булинов |
Полимеризую-
щиеся белки — Фибриноген à фибрин — Казеиноген à казеин |
|
Надмолекулярный уровень |
|||
| Белковый
цитоскелет клетки; флагеллин жгутиков; световоды у растений … |
?
Комплексы торов — Протеасомы |
Белковый
геном-обслужи-вающий аппарат (включая белко- вые ансамбли); белки капсида вирусов |
Белки
матрикса(губки) / Белки клатрины … (образующие сеть) |
|
Комбинаторные |
|||
| Белки, работающие в комплексе с
ДНК и mРНК (протяженными структурами) |
Белки мембранные
— Белки трансмемб- ранных каналов («бочкообразные») — Белки семейства ТМ (= транс- мембранные) -? — Ансамбли цитохромов |
Белки, работающие в комплексе с rРНК
(в составе рибосом /массивная объемная конструкция/) |
?
Белки в строме (губке) — Гемоглобин в строме эритроцита, — Актомиозин — … |
|
Фаг (белковые структуры) |
|||
| Фибры фага | Отросток фага
(плоскость, скрученная в цилиндр?) |
? Головка фага
(капсид) |
— |
|
Вирусы /?/ |
|||
| Филаментозные
(протяженные) |
Палочковидные
(цилиндрические) |
Сферические | — |
|
Компоненты жгутика [6] [есть аналогия с секреторными системами (молекулярными шприцами) бактерий] |
|||
| Белки жгутиков, пилей,
ворсинок бактерий, простейших |
? Протонные насосы,
обслуживающие движение жгутика |
Белковые моторы
(ротор, статор), вращающие жгутики [4] |
Крючок,
система тарелок (опорные структуры) |
Изучается взаимосвязь между ландшафтами и динамическими свойствами белковых молекул. По выражению А. Каява, «белки хотят контролировать все три измерения». [2] Белки с апериодическими последовательностями формируют 3D глобулы; однако большая часть белков содержит массивы тандемных повторов (tandem repeats /TRs/). [13] Повторы в белках формируют мотивы разных форм (рис. 1) в зависимости от размера (чем больше тандемных повторов, тем выше вероятность формирования глобулы). Повтор «нить-петля-нить» назвали бета-дугой; из β-дуг могут состоять кристаллиты полиглутамата, вызывающие нейродегенерацию. [9] Белки с большими поверхностями часто являются основой белковых машин, поскольку за выступы, вытянутые части легко цепляются иные молекулы. [2]
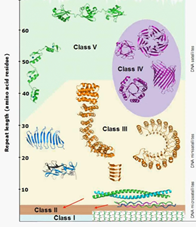
Рис. 1. Варианты самосборки тандемных повторов в белках [по 2]
Размерность один (нечто длинное) через петлю становится размерностью два; плоскости, наслоившись друг на друга как листы шифера, формируют агрегаты – размерность три; в губках могут быть удлиненные ходы – размерность один (как дырка в экситоне), вывернутая наизнанку. Многоплановость бесконечна. Размерность два привлекательна с точки зрения динамики; это часто флуктуирующая составляющая.
Биологических (белковых, на основе нуклеиновых кислот и других) машин множество; в данной сфере активно проводятся нанотехнологические разработки. Накопительный этап (сложностей) обязательно должен сменяться обобщениями (упрощениями), хотя бы для базы философских выводов или для синергетических наработок.
Раскладка белков по динамике (таблица 2) позволила сделать методологический вывод о необходимости вычленения трех «динамик» — «on-off», вибраторов и функционалов (назовем пока так).
Таблица 2.
Функции белков с точки зрения динамики (тетрадный подход)
| Флуктуации, стремящиеся к нулю | Флуктуации | Функции | Структура |
|
Философская тетрада [10, с. 584] – сознание, информация, биология, физика |
|||
| Сознание («Я» как вычленение единственно важного в данный момент) / Бессознательное | Информация/
Хаос или ландшафт /?/ |
Биологическое
(живое) |
Физическое
(не живое) |
|
Детерминизм |
|||
| «математический» /
«Я» (?) |
стохастический | причинно-следственный
(каскад АàВàСà…)à причинно-следственные законы |
«комбинатор-ный» (эмбрио-генез …);
табличные законы (Менделеева, Менделя …) |
| «Выворачивание
наизнанку»
|
Нечто информативное /на фоне хаоса/ | Нечто
временное (пошагово сдвиговое) |
Нечто пространствен-ное |
|
«Выворачиваниенаизнанку» |
|||
| Соответствующие
феномены квантовой механики /?/
|
В мире флуктуаций –
пока не ясно, но интересен разворотчерез зеркало[3] |
В биологическом мире – это «сон-бодрствова-ние»* | В физическом мире – это «черная дыра – информация» |
| Электромагнитные волны -? (константа
скорости) |
Флуктуации
электрического поля |
Магнитное поле?(в биологических системах) | Гравитационное поле (определя-емое структура-ми /массой/ …) |
|
Белки |
|||
| адинамичные / полимеризующиеся
— белки волос, жгутиков, ресничек, пилей бактерий — фибрин — казеин молока — …
|
динамичные
~Треть белков эукариотических клеток относится к неструктуриро-ванным (без стабильной структуры) [2] |
формирующие каскад (А+В à изменение конформацииà + Сà …) для мягкости регуляции … | комбинаторные
— комплекс RISC* — рибосомальные белки — R-L (рецептор — лиганд) — фермент- субстрат — иммунные комплексы … |
|
Разделение белков по динамике |
|||
| «On-off» [7] – с «двумя» состояниями
[«переключатели»] — гемоглобин (с кислородом и без кислорода) — трансферрин (с атомами железа и без) — белки ионных каналов (открыты, закрыты …) … |
«Вибраторы»
— C1q и ему подобные (МВР /маннан- связывающий протеин/, фиколины, C1qL1-4 [8, 11,12] ) |
«Функционалы»
-сократительные — актин — миозин — … — эфферентные |
Опорные белки
— коллаген — белки Белки цитоскелета клетки
|
|
Гипотезы механизмов флуктуаций белковых молекул |
|||
| макрофизическая
(лунные циклы и пр.) |
действие факторов среды (термодинамика,
влияние рН …); заряда … |
кинетическая | Результат
формирования комплексов с иными субстанциями/?/ |
|
Субмолекулярный уровень (части белка) |
|||
| Тандемные повторы
в белке àБета-арки (Рис. 1) (затравки дляструктуризации). Патологические амилоидные отложения. |
Петли, шпильки
в белке (маркерная Часть белка для его распознавания … ?)
|
Глобулярные
альфа-спираль-ные участки белка (эффек-торная /функ- ционально активная/ часть белка) |
Фибриллярные
белки, бета-складчатые листы (скелетная часть белка) |
Примечание. * RISC – RNA-inducedsilencingcomplex
* Переходы «сон –бодрствование» с возможностью замедления
переходной фазы вопреки принципу неопределенности
Гейзенберга [упрощенно, либо «режим пространства»
(корпускул), либо «режим времени» (динамики – волны);
корпускулярно-волновой дуализм] — феномены сознания
(экстрасенсорики). Данный дуализм также надо менять на
триадный, что и обсуждается через кота Шредингера.
Можно совмещать тетрады статики (деление по размерностям) с тетрадой динамики (флуктуации-функции-«арматура») в одной таблице. В перспективе — раскладка тетрадой флуктуирующего звена /?/ — самого перспективного и тяжелого в осмыслении. Во многих сферах науки структурно-функциональный подход будет меняться на структурно-функционально-флуктуационный. В протеомике следует вычленять «вибраторы» (тоже делящиеся на тетраду) — белки, в частности, способные к постоянной смене значимого (для молекулярного уровня организации клетки; для данной строчки раскладки) электрического заряда (…) в разных частях молекулы. Вибраторы должны быть и на субмолекулярном уровне (часть молекулы – петля, хвост …), если данный белок ключевой в регуляции.
Уровневую вертикаль (от квантовой механики до макроорганизма) надо выстраивать не по опорным белкам и не по обслуживающему аппарату, а по составляющим флуктуирующего звена. Допустим, «я хочу согнуть палец и сгибаю» (произвольные движения); то есть нечто «идеальное» (от «идея», сознания; точнее – «идеально-материальное» в свете корпускулярно-волнового дуализма квантовой механики), превращается в конечном счете в нервные импульсы, идущие от определенного участка коры мозга через двигательные ядра к нужной мышце. По каким принципам ландшафт выстраивается в нужном направлении (кто переключает рельсы)? С точки зрения В.В. Налимова [5], «человек в каком-то смысле мыслит всем телом» [в этом аспекте интересен ролик https://www.youtube.com/watch?v=RotAuvM3fJ0 ], а переключение происходит по степени вероятности (автоматически /при переутомлении/ запустится наиболее часто используемый маршрут (корригируемый «Я»).
В первое звено (таблицы) вписываются белки, имеющие ограниченное число степеней свободы, в частности, «on-off» белки [7]. (Рис. 2) Данные протеины должны работать четко, как переключатели, без творчества и без «общения», как очень примитивные роботы. К этой же составляющейотносятся структуры типа волос, жгутиков, пилей бактерий, ресничек микроорганизмов, многие фибриллярные белки, световоды у растений, волноводы и другие.
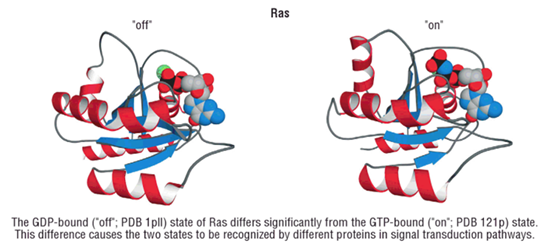
Рис. 2. «On-off» конформации белка [по 7].
Методологический вывод – акцент внимания должен быть сделан на белки, постоянно меняющие свою конформацию в силу допустимых степеней свободы (такой-то структуры (части) молекул /IgG3, C1q…/ …), возможности взаимодействия с иными структурами (фосфорилирование, убиквитирование, метилирование …), особенности термодинамики молекул белка и окружающей среды, передвижение заряда по молекуле (коллагеноподобные части белка …).
Список литературы:
- Аллотропия углерода // https://en.wikipedia.org/wiki/Allotropes_of_carbon
- Каява А. «Темная материя протеома: пространственная структура неглобулярных белков» // https://www.youtube.com/watch?v=3BhWZP9qxHM
- Ложкина А.Н., Резникова А.Ю. Действие алюминиевого экрана (фольги) на флуктуации времени свертывания плазмы крови // Актуальные проблемы современной науки. Сб. науч. тр. (Томск). — 2013. — Т.2, N 2. — С. 21-22.
- МетлинаА.Л. Жгутики прокариот как система биологической подвижности // Успехи биологической химии. – 2001. — Т. 41. — С. 229-282.
- Налимов В.В., Дрогалина Ж.А. Реальность нереального. Вероятностная модель бессознательного. — М.: Мир идей, АО АКРОН. – 1995.– 432 с.
- Секреторные системы бактерий (википедия) // https://en.wikipedia.org/wiki/Secretion#Secretion_in_Gram_negative_bacteria
- Breen C. Protein Structure and Function: Gregory A. Petsko, Dagmar Ringe (Eds.), Blackwell Scientific Publications, Oxford. – 2004. – 195 p.
- , Ignatius A., Gebhard F., Huber-Lang M. New insights of an old defense system: structure, function, and clinical relevance of the complement system // Molecular medicine. – 2011. – Vol. 17, № 3. – С. 317. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3060978/
- Huang R.K., Baxa U., Aldrian G. et al. … & Kajava A.V. Conformational switching in PolyGln amyloid fibrils resulting from a single amino acid insertion // Biophysical journal. – 2014. – Vol. 106, № 10. – P. 2134-2142.
- Ivancevic V. G., Ivancevic T. T. Computational mind: a complex dynamics perspective. – Springer, 2007. – Vol. 60. – 690 p.
- Liu F.,Tan A., Yang R. et al. C1ql1/Ctrp14 and C1ql4/Ctrp11 promote angiogenesis of endothelial cells through activation of ERK1/2 signal pathway // Molecular and Cellular Biochemistry. – 2016. – P. 1 — 11. https://link.springer.com/article/10.1007/s11010-016-2842-7
- Naito A.T., Sumida T., Nomura S. et al. Complement C1q activates canonical Wnt signaling and promotes aging-related phenotypes // Cell. – 2012. – Vol. 149, № 6. – P. 1298 — 1313. https://news.am/rus/news/108930.htmlhttps://www.sciencedirect.com/science/article/pii/S0092867412005314
- Richard F.D., Kajava A.V. TRDistiller: A rapid filter for enrichment of sequence datasets with proteins containing tandem repeats // Journal of structural biology. – 2014. – Vol. 186, № 3. – P. 386-391.[schema type=»book» name=»РАЗМЕРНОСТИ В СТРОЕНИИ БЕЛКОВ (МЕТАФИЗИЧЕСКИЙ АСПЕКТ)» description=»Разделение белков диадой на фибриллярные и глобулярные (размерности один и три) сменилось на вычленение группы мембранных белков – триаду. Однако мембраносцепленные молекулы представляют не молекулярный уровень организации, а надмолекулярный и субклеточный, поэтому данная триада не правомочна. В работе очерчена примерная раскладка белков по уровневой организации и целочисленным размерностям.» author=» Ложкина Анна Николаевна» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-01-17″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_30.10.16_31(2)» ebook=»yes» ]