Метилированные аминыкак общие предшественники в органическом синтезе применяются в производстве инсектицидов, ускорителей вулканизации резиновых изделий, лекарственных средств, растворителей. Так, метиламин (СН3NH2)используется в производстве фунгицидов, дубильных веществ, красителей, ракетных топлив. Промышленное производство метиламина составляет 1.0×106 т/год.Известно, что накопление метилированных аминов в грунтовых водах приводит к ухудшению качества питьевой воды. Предельно допустимая концентрация (ПДК) метиламина в воде составляет 1 мг/л (33 мкМ).Метилированные амины являются важными интермедиатами метаболизма растений, образующих кофеин, теанин и теобромин, а также служат центральными компонентами синтеза и распада таких осмолитов, как глицин/бетаин,пролин/бетаин и N-окись триметиламина у галофильных водорослей и прокариот (аэробных метилобактерий). К аэробнымметилобактериям относят уникальные микроорганизмы, способные использовать в качестве источников углерода и энергии производные метана.По типу питания различают три группы метилобактерий. Облигатные метилотрофы используют только С1-соединения. Ограниченно-факультативные могут расти только на одном или нескольких полиуглеродных субстратах.Факультативные метилотрофы используют наряду с С1-соединениями, различные полиуглеродныесубстраты[1, 3]. Взаимодействие метиламина с аэробнымиметилобактериями приводит к изменению их дыхательной активности, обусловленной, в том числе, окислением метиламина оксидоредуктазами микроорганизма с потреблением молекулярного кислорода. Это свойство бактерий может быть использовано в аналитических целях.Известен хроматографический метод определения алифатических аминов в газовой фазе [2]. Разработан амперометрический медиаторный ферментный биосенсор на основе фермента метиламиндегидрогеназыдля определения в водной среде гетероциклического соединения гистамина (4-(2-аминоэтил)-имидазола) [5].Методы требуют сложного оборудованияи реактивов.
Штамм Methylopilamusalis представляет собой аэробные факультативные метилобактерии, выделенные из банана. Он назван Methylopilamusalissp. nov. (типовой штамм ВКМ B-2646T=DSM 24966T=CCUG 61696T) [4].Ранее показано, что у факультативного метилотрофаштаммаM. musalisВКМ B-2646 в большей степени осуществляется прямое окисление метиламинав формальдегид с помощью фермента метиламиндегидрогеназы, хотяодновременно обнаружена и активность ферментов N-метилглутаматного пути.Высокая скорость роста штамма M.musalisВКМ B-2646 на среде с метиламином в качестве источника углерода и энергии, позволила отобрать этот штаммв качестве биорецепторасенсора для определения метиламина.
Целью работы являлось исследование влияния метиламина на дыхательную активность иммобилизованных клеток метилобактерийMethylopilamusalis ВКМ B-2646.
МЕТОДИКА
Материалы и реактивы.В качестве источника углерода,азота и энергии и использовали метиламин. Соли для приготовления питательной среды были аналитической чистоты («Реахим», Россия). Агаризованные среды готовили с бакто-агаромTypeUSA(«Difco», США). Для определения субстратной специфичности использовали реактивы производства фирмы «Sigma» (CША).
Объект исследования.В работе использовали штамм аэробныхметилобактерийMethylopilamusalisВКМ B-2646, хранящийся во Всероссийской коллекции микроорганиизмов (ВКМ).
Среда и условия культивирования. Метилобактерии выращивали на среде «К», которая содержала (г/л): КН2РО4 – 2.0; MgSO4·7H2O – 0125; NaCl – 0.5; FeSO4·7H2O – 0.002; вода дистиллированная 1 л, значение рН 7.2 устанавливали 3М NaOH. Для приготовления всех растворов и буферов использовали дистиллированную или деионизованную воды.
Культивирование проводили в колбах объёмом 750 мл, содержащих 200 мл среды. После стерилизации (1 атм.; 30 мин) в среду добавляли 1 мл 30% (об/об) метиламина и 20 мл жидкой посевной культуры или засевали смывом стерильной средой с агаризованной скошенной культуры. Метилобактерии инкубировали на качалке (140 об/мин) при температуре 29оС до начала стационарной фазы роста (2-5 сут.). Штамм поддерживали пересевом на агаризованной (2% агара) среде «К» с метанолом.
Биомассу(конец экспоненциальной фазы роста) отделяли центрифугированием при 5000g в течение 30мин, +4°С. Клеточную суспензию хранили в холодильнике при +4°С.
Иммобилизация клеток. Для иммобилизации аликвоту клеточной суспензии центрифугировали при 10 000 gв течение 3 мин при комнатной температуре. Клетки отмывали дважды 50мМК-фосфатным буфером, рН 7.5. Иммобилизацию клеток M.musalisВКМ B-2646осуществляли методом физической адсорбции. Для этого клеточную суспензию, содержащую 10 мкл50мМК-фосфатного буфера(рН 7.5) с 1 мг сырой биомассы, наносили на полоску носителя, формируя пятно диаметром 5 мм. Пятно подсушивали при комнатной температуре в течение 20 мин. Биорецепторфиксировали на измерительной поверхности кислородного электрода типа Кларка («Кронас», Россия) с помощью нейлоновой сетки.
Носители для биорецептора.Были испытаныследующие носители:хроматографическаястеклобумага «WhatmanGF/A» (Великобритания),мембраны «Владипор»: регенерированная целлюлоза на полипропилене (размер пор 50 нм), полисульфонамид на лавсане (размер пор 100 нм), полиэфирсульфон на лавсане (размер пор 220 нм), ацетат целлюлоза на тканевом лавсане (размер100 нм) (ЗАО НТЦ “Владипор”, г. Владимир).Условия измерений. Измерения проводили в открытой кювете объёмом 2 мл в 50мМК-фосфатным буфере(рН 7.5), насыщенном кислородом,при комнатной температуре.Регистрируемым параметромпри фиксированном потенциале (-700мВ)являлась максимальная скорость изменения выходного сигнала dI/dt(нА/с), связанная пропорциональной зависимостью со скоростью изменения концентрации потреблённого кислорода (ответ сенсора). После установления постоянного уровня тока в кювету микропипеткой вводили 100 мкл пробы.
Построение зависимостей ответа сенсора от значений рН. Для измерения рН-зависимости использовали 50мМК-фосфатный буфер со значениями рН 6.0,6.5; 7.0, 7.5, 8.0. В качестве субстрата использовали 0.12мМметиламина. Все исследования проверялись в трёх повторностях.
Построение зависимостей ответа сенсора от концентрации NaCl. Для исследования зависимости ответа сенсораот ионной силы буферного раствора использоваликонцентрации растворовNaClв диапазоне 50 – 500 мМ. Значение рН полученных растворов доводили до значения 7.5. В качестве субстрата использовали 0.12мМметиламина.
Субстратная специфичность.Оценку субстратной специфичности биорецептора проводили по 8 субстратам: метиламин, его промежуточный продукт деградации формальдегид, диметиламин, триметиламин, формиат натрия, первичные алифатические спирты: метанол, этанол. Кроме того использовали С6 сахара: глюкозу и фруктозу. Содержание субстратов в кювете составляло0.1 мМ.
Операционная стабильность биосенсора. Для определения операционной стабильности проводили 20 последовательных измерений величин ответа сенсора на введение в кювету 100 мкл пробы.Содержание в кювете составляло 0.12 мМметиламина.
Долговременная стабильность определялась путём ежедневного измерения величины ответа сенсора на одну и ту же концентрацию метиламина (0.12 мМ) в течение 5 дней.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В таблице 1 приведены данные об ответе сенсорана основе клеток M.musalisВКМ B-2646, иммобилизованных на различные носители,при введении в кювету раствора метиламина.
Таблица 1.
Сравнение носителей для биорецептора на основе ИмКM. musalis
ВКМ B-2646
| №
п/п
|
Название носителя, фирма |
Ответ биосенсора, % |
| 1. | Хроматографическая бумага «WhatmanGF/A» (Великобритания) | 100.0 |
| 2. | Мембраны «Владипор» регенерированная целлюлоза на полипропилене (размер пор 50 нм) (Россия, Владимир) | 27.4 |
| 3. | Мембраны «Владипор» полисульфонамид на лавсане (размер пор 100 нм) (Россия, Владимир) | 65.5 |
| 4. | Мембраны «Владипор» полиэфирсульфон на лавсане (размер пор 220 нм) (Россия, Владимир) | 74.5 |
| 5. | Мембраны «Владипор» ацетат целлюлоза на тканевом лавсане (размер100 нм) (Россия, Владимир) | 97.4 |
Самая большаявеличинаответа получена при использовании в качестве носителя хроматографической бумаги «Whatman GF/A» (Великобритания). Этот носитель и был использован в дальнейших исследованиях.
Значение рН среды является одним из факторов, влияющих на активность клеточных ферментов биорецептора. Для измерения рН-зависимости использовали 50 мМкалий-фосфатныйбуфер в диапазоне значений рН 6.0 — 8.0. Максимальный ответсенсора на основе иммобилизованных клетокM.musalisВКМ B-2646наблюдался при рН 7.5.Калий-фосфатный буфер со значением рН 7,5 использовали в дальнейших исследованиях.Следует отметить, что значения рН 7.5-8.5 были оптимальными и для работы амперометрического биосенсора с биорецептором на основе фермента метиламиндегидрогеназыдля определения гистамина [6].
Изучена зависимость ответов сенсора от ионной силы в диапазоне от 50 до 500 мМ концентрации NaCl. Максимальные отклики наблюдались в области 200 мМ раствора NaCl. Однако при 50 мМответ был немногим меньше. Следует отметить, что даже при концентрации 500 мМNaCl наблюдались большие ответы сенсора, то естьиммобилизованные клеткиM. musalis ВКМ B-2646 выдерживают высокие концентрации соли.
Градуировочная зависимость ответа от концентрации субстрата является важной метрологической характеристикой. На рисунке1 представлена градуировочная кривая зависимости ответа сенсора от концентрации метиламина.
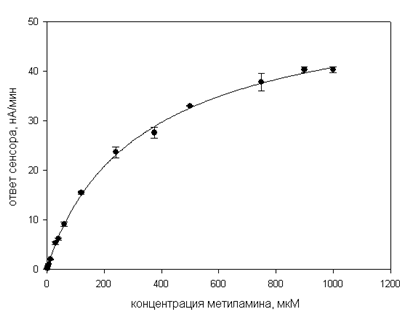
Рисунок 1. Градуировочная кривая ответа сенсора на основе иммобилизованных клеток M. musalis ВКМ B-2646 от концентрации метиламина
Следует отметить, что градуировочный график включает в себя концентрацию, равную ПДК для метиламина в воде (ПДКМА=1 мг/л или 33мкМ).
Оценку субстратной специфичности биорецептора на основе иммобилизованных клеток M.musalisВКМ B-2646провели по следующим восьми субстратам: метиламин, промежуточный продуктего деградации формальдегид,диметиламин, триметиламин, первичные алифатические спирты метанол, этанол. Кроме того использовали С6 сахара:глюкозу и фруктозу.Иммобилизованные клеткиM.musalisВКМ B-2646 давали отклики на все исследуемые субстраты. Однако самые большие величины ответов наблюдали при введении в кювету растворов формальдегида и метиламина.Полученныеданные подтверждают,что штаммM.musalisВКМ B-2646относится к факультативнымметилотрофам, которые наряду с одноуглеродными соединениямимогут использоватьполиуглеродные соединения (С6сахара глюкозу и фруктозу).
Важной характеристикой любого метода является его экспрессность, то есть быстрота проведения анализа. В данном случае при введении метиламина в кювету время отклика составляло менее 1 минуты. Со временем отклика тесно связана другая характеристика сенсора – время регенерации. Для сенсора на основе штамма M. musalisВКМ B-2646 время восстановления составляло 5-8 минут.Длительность одного измерения, включающая время отклика и время регенерации, составила 6-10 минут. Долговременная стабильность штамма M. musalisВКМ B-2646 составила 5 дней при хранении электрода с рецептором в условиях низких температур (+4° С) в 50 мМкалий-фосфатном буферном растворе рН7.5.
Таким образом,исследовано влияние метиламина на дыхательную активность иммобилизованных клеток метилобактерийMethylopilamusalis ВКМ B-2646.Полученные данные могут быть полезныдля оценки содержания метиламина в водной среде.
Список литературы
- Троценко Ю.А., Доронина Н.В., Торгонская М. Л. Аэробныеметилобактерии // Пущино: ОНТИ ПНЦ РАН. 2010. 325 с.
- Anthoni U.,Christophersen C., Gramm L., Nielsen N., Nielsen P.1. // Toxicon. 1991. V. 29. P. 1205-1212.
- Anthony C. The biochemistry of methylotrophs. // Academic Press, London. 1982.
- V, Kaparulina E.N., Bykova T.V., TrotsenkoYu.A. 2013. V.63. P.1847-1852.
- Erupe, M.E., Liberman-Martin, A., Silva, P.J., Malloy, Q.G., Yonis, Y., Cocker, Iii, D.R., Purvis-Roberts, K. // Journal of Chromatography. 2010. V. 1217.№13.P. 2070-2073.
- Zeng K., Tachikawa H., Zhu Z., and Davidson V. L. // Chem. 2000. V.72. P. 2211-2215.[schema type=»book» name=»ОКИСЛЕНИЕ МЕТИЛАМИНА ИММОБИЛИЗОВАННЫМИ МЕТИЛОБАКТЕРИЯМИ MethylopilamusalisВКМ B-2646″ description=»Рассмотрено ферментативное окислениеметиламина, осуществляемоеиммобилизованнными клеткамикультуры Methylopilamusalis ВКМ B-2646. Для этого был применён биосенсорный метод, обеспечивающий возможность регистрации потребления кислорода используемыми клетками.» author=»КувичкинаТатьяна Николаевна, Капаруллина Елена Николаевнак, РешетиловАнатолий Николаевич» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-03-14″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_30.05.2015_05(14)» ebook=»yes» ]

