Прогрессирующая деградация естественной популяции и порослевого молодняка в границах искусственного ареала каштана посевного (Castanea sativa Mill.) – ценной древесной, орехоплодной, декоративной, таннино-, витамино-, пыльце- и нектароносной лесной культуры в различных эколого-географических регионах мира, обусловлена эпифитотийным развитием рака, «некроза» или «ржавчины» коры. Возбудитель заболевания – раневой гриб Cryphonectria parasitica (Murrill) M. E. Barr., сохраняясь на растительных остатках и мертвой древесине, инфицирует поврежденные механически или насекомыми участки коры. Раком поражаются все надземные органы за исключением листьев. Вначале болезнь появляется на одной из ветвей кроны, а затем путем вторичных заражений распространяется по окружности ствола вниз дерева. Мицелий патогена, развиваясь в живой коре, камбиальном слое и тканях заболони, колонизирует сосуды. Происходит некротизация, гипертрофия, разрушение и отслаивание коры, с обратной стороны которой формируются бледно–бурые веерообразные сплетения мицелия C. parasitica. В некротических трещинах коры образуются многочисленные плодовые тела гриба в виде желтых или буровато-красных стром [10]. Существенное влияние на патогенез оказывают токсические метаболиты гриба, нарушающие водный потенциал растительных тканей и функции мембран клеток. Недостаточное водоснабжение, наряду с пробуждением спящих почек и обильным образованием «водяных побегов» по всей длине ствола, вызывает массовое отмирание кроны и боковых ветвей. Пораженное дерево погибает до момента распространения мицелия паразита в комлевую часть ствола.
Формированию новых очагов инфекции способствует вариабельность паразитических свойств и накопление агрессивных морфотипов в популяции гриба [4, с. 30; 6, с. 49]. Планетарный мониторинг микроэволюционных процессов в природных популяциях C. parasitica позволил выделить изоляты белой морфологии, содержащие в геноме плазмиды dsRNA. Гиповирулентные изоляты, отличающиеся медленным ростом, пониженной споруляцией и ослабленной агрессивностью, представляют практический интерес для биологического контроля рака коры каштана путем эволюции толерантности паразита к гиповирусу [12, с. 866]. Поскольку, варьирующий по штаммовому составу Cryphonectria hypovirus встречается в каштановых лесах спорадически, для инокуляции пораженных раком участков коры используют тестерные гиповирулентные изоляты [11, с. 378; 15, с. 200]. Успешная конверсия гиповируса возможна между вегетативно совместимыми изолятами паразита в популяциях с преобладанием бесполого типа размножения [13, с. 311; 15, с.192; 16, с. 279]. Оптимальная результативность достигается при многократной интродукции гиповируса, поскольку dsRNA в естественных популяциях паразита распространяется незначительно, а продуцируемые гиповирулентными изолятами пикноспоры формируют типичные высокоагрессивные клоны [13, с. 338; 14, с. 55].
В каштановых лесах Северокавказского региона нами обнаружены гиповирулентные изоляты C. parasitica alb–морфотипа [4, с. 30], инвазированные штаммом гиповируса CHV1-EP713 [1, с. 10, 16]. В серии скрещиваний aur – агрессивных с alb – гиповирулентными изолятами установлена несовместимая реакция барраж [3; 4, с. 31]. На этом основании сделан вывод о блокировании трансмиссии гиповируса CHV1-EP713 из alb–гиповирулентных изолятов в aur–агрессивные системой вегетативной несовместимости [4, с. 32].
Цель исследований – гибридизация и выделение вегетативно совместимых групп морфотипов C. parasitica из причерноморского ареала каштана посевного Турции как ближайшего природно-климатического аналога Северного Кавказа.
Материалы и методы
В 2010–2012гг. поэтапно скрещивали 31 число изолятов C. parasitica: Турция –21 и Северный Кавказ –10. В первой серии опытов гибридизировали изоляты, выделенные из каштана посевного на севере Турции в Бартынской (Амасрынский, Бартынский, Хасанкадынский районы) и Зонгулдакской (Алаплынский район) областях. Изоляты, полученные из Московского государственного областного университета в процессе творческих контактов [1, с. 6], дифференцировали на высокоагрессивные aur–оранжевые; среднеагрессивные lut– золотисто-желтые; гиповирулентные alb–беловатые [5, с. 46; 9]. Обозначили изоляты согласно территориально – географическим границам, в пределах которых осуществлялся сбор инфекционного материала: aur – Ba1, Ba2, Bb3, Bh4, Bh5, Sa6, Sa7, Sa8, Sa9; lut – Ba10, Ba11, Bb12, Sa13, Sa14, Sa15; alb – Bh16, Bh17, Sa18, Sa19, Sa20, Sa21. Во второй серии опытов попарно скрещивали турецкие и выделенные нами северокавказские изоляты, обозначенные начальными буквами локальных популяций (А– Адлерская, С– Сочинская, Кп– Краснополянская, Л– Лазаревская, Кр– Краснодарская) в соответствии с порядковыми коллекционными номерами: aur – А47, С32, Кп42, Л79, Кр61; lut – А12, С25, Кп14; alb – А2, А9 [2; 4, с. 29]. В опытах использовали картофельно–глюкозный агар, чашки Петри инкубировали в течение 30 сут. при 24–26°С. Типы взаимодействия изолятов классифицировали как антагонизм (барраж и бордюр), совместимость [7, с. 5–13]. Для распределения изолятов по типам взаимодействия использовали показатель частоты (p), рассчитанный от суммарного числа скрещиваемых комбинаций, принятого за 1. Частоту распределения морфотипов по анализируемым признакам оценивали с помощью индекса разнообразия Шеннона (Н) по формуле: H= – ∑pi ln pi, где pi – частота i–го морфотипа. Экспериментальные данные обрабатывали методами статистического анализа [8, с. 251] с использованием пакетов прикладных программ Excel и Statistica.
Результаты и обсуждение
Гибридизация морфотипов C. parasitica из Турции. Скрещивание изолятов выявило доминирование антагонистических реакций – барраж и бордюр. Барраж – разграничительная линия из мертвых клеток в зоне контакта двух колоний, фиксировался при сокультивировании изолятов независимо от их территориальной принадлежности. Перитеции в зонах барража не формировались, что позволило отнести тестируемые изоляты к МАТ–1 типу спаривания. Наши данные не противоречат известным сведениям об отсутствии полового размножения в популяциях C. parasitica некоторых провинций Турции [12, с. 866]. Между показателями частоты распределения (p) изолятов по типам взаимодействия и индексом разнообразия Шеннона обнаружена высокая положительная корреляционная связь (Cr=0,97±0,08; P<0,001). Частота морфотипов с реакцией барраж достигала максимального уровня (p=0,88±0,04; Н=1,44), причем оказалась относительно выше в Зонгулдакской популяции по сравнению с Бартынской (Рис. 1). В комбинациях суммарных скрещиваний изолятов из обеих выборок выявлена предельно высокая частота индивидуумов (p=0,46±0,04) с реакцией барраж, при среднем значении индекса разнообразия Шеннона (Н=0,52). Бордюр (отталкивание) – торможение роста изолятов к центру чашки Петри с отсутствием мицелия на границе между колониями, наблюдался при гибридизации изолятов из Бартынской популяции, а также в сочетаниях из обеих выборок. Вегетативная совместимость – сращивание колоний и отсутствие разграничительных линий, обнаружена в 14 сочетаниях морфотипов (p= 0,07±0,04; Н=0,37).
При гибридизации изолятов равнозначных и разнокачественных морфотипов во всех анализируемых сочетаниях формировался барраж. В комбинациях однотипных индивидуумов частота и индекс разнообразия Шеннона достигали максимального уровня среди высокоагрессивных морфотипов aur – aur (p=0,11±0,02; Н=0,35), а минимального – слабовирулентных alb–alb (Рис. 2).
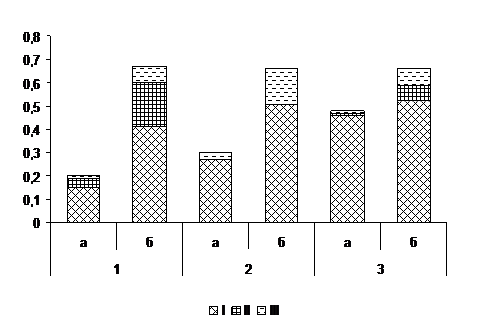
Рисунок 1. Типы реакций при гибридизации морфотипов
Cryphonectria parasitica из Турции
Условные обозначения: а – частота (p) морфотипа, б – индекс Шеннона. Реакции взаимодействия: I – барраж, II – бордюр, III – совместимость. Комбинации скрещивания морфотипов по популяциям: 1– Бартынская, 2 – Зонгулдакская, 3 – Бартынская + Зонгулдакская
В рознящихся группах морфотипов, превалировали комбинации aur – lut и aur – alb (p= 0,26±0,02; Н=0,51). Бордюр проявлялся в парах морфотипов aur – aur из обеих выборок при гибридизации изолятов Ba1+Ba2+Ba3, а также каждого из них с Bh4, Bh5 и Sa6. Совместимыми оказались сочетания морфотипов: lut–lut (Н=0,07) и alb–alb (Н=0,22). Характерно, что в комбинации морфотипов alb–alb выявлено сращивание изолятов: Bh16+Bh17 и каждого из них с Sa18; Sa18 + Sa19 с Sa20 и Sa21; Sa19 + Sa20 и Sa21; Sa20+Sa21. Можно предположить, что отсутствие совместимых комбинаций и наличие барража между некоторыми изолятами alb – морфотипа из Турции, свидетельствует в пользу их интерстерильности. Итак, линия барража предотвращает конверсию гиповирусов CHV1-EP721 и CHV1-euro7, идентифицированных в геноме Bh16 и Sa19 alb – морфотипа [1, с. 16], в aur – агрессивные изоляты C. parasitica.
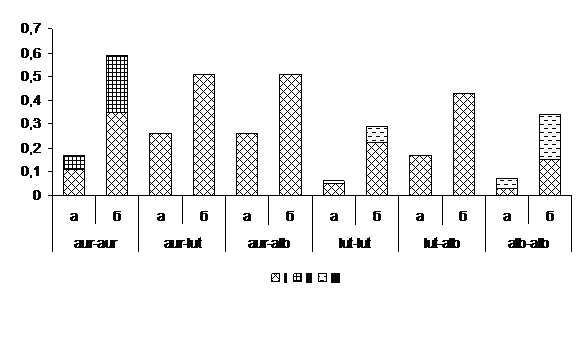
Рисунок 2. Типы реакций при гибридизации равнозначных и разнокачественных морфотипов Cryphonectria parasitica из Турции
Условные обозначения: а – частота (p) морфотипа, б – индекс Шеннона. Реакции взаимодействия: I – барраж, II – бордюр, III – совместимость
Перекрестная гибридизация морфотипов из Турции и Северного Кавказа [2]. Сокультивирование равнозначных и разнокачественных морфотипов выявило преобладание реакции барраж (p=0,90±0,03; Н=2,17). Бордюр обнаружен в сочетаниях морфотипов lut – lut и alb – alb (Рис. 3). При этом в комбинациях морфотипов lut – lut антагонизм проявили изоляты: Ba10 + А12, Ba10 + С25 и Bb12 + С25. Совместимыми оказались только изоляты Ba11, Sa13 и Sa15 с Кп14 из Краснополянской выборки. Нашими предыдущими исследованиями подтверждена вегетативная совместимость lut–lut морфотипов из северокавказской популяции [3]. Следовательно, lut – морфотипы из Турции и Северного Кавказа относятся к генетически различным индивидуумам. Не исключено, что вегетативная несовместимость обусловлена также инфицированием изолятов lut–морфотипа Cryphonectria hypovirus, не относящимися к подтипу CHV1 и ранее не обнаруженными в Европе.
Таким образом, инвазия гиповируса CHV1-EP713 из alb – морфотипов северокавказской популяции в турецкие aur – агрессивные изоляты блокируется линией барража. Конверсия гиповирулентности возможна лишь при вегетативной гибридизации alb – морфотипов А2 и А9 из Северного Кавказа со среднеагрессивными lut – Ba11, Sa13 и Sa15 и слабовирулентными alb – Sa20 и Sa21 из Турции.
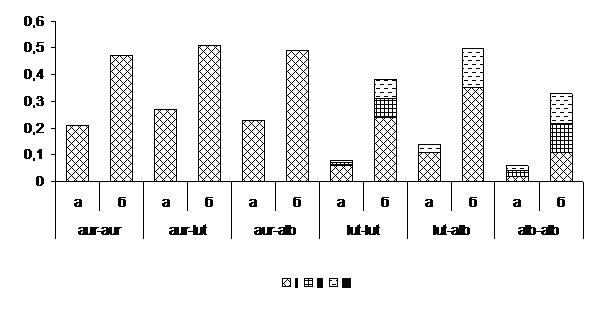
Рисунок 3. Типы реакций при гибридизации равнозначных и разнокачественных морфотипов Cryphonectria parasitica из Турции и Северного Кавказа
Условные обозначения: а – частота (p) морфотипа, б – индекс Шеннона. Реакции взаимодействия: I – барраж, II – бордюр, III – совместимость.
Анализ типов взаимодействия изолятов выявил наличие 9 VC–групп (Н=2,37) в локальных популяциях C. parasitica из Турции, среди которых вегетативно совместимыми оказались 2. Ранее, в скрещиваемых комбинациях турецких изолятов с европейскими гиповирулентными тестерами EU–1 и EU–2 выделено 2 VC–группы [11, с. 380]. Перекрестная гибридизация изолятов из Турции и Северного Кавказа подтвердила наличие 15VC–групп (Н=2,68), а совместимостью отличались 3. В локальных популяциях C. parasitica Северного Кавказа нами идентифицировано 38 мелких VC–групп, агрегированных в 6 VC–групп более высокого ранга, различающихся числом изолятов и типом вегетативной несовместимости. Варьирование числа VC–групп, вероятно, обусловлено штаммовыми различиями гиповирусов. Исследованиями подтверждена идентичность турецких и европейских штаммов CHV1–ЕР721 и CHV1–Euro7, незначительно влияющих на морфологические и паразитические признаки C. parasitica [1, с. 16; 15, с. 202]. Напротив, существенно преобразующий геном патогена высокоагрессивный гиповирус CHV1–ЕР713 [14, с. 60], обнаружен только в выделенных нами гиповирулентных изолятах alb – морфотипа на Северном Кавказе [3].
Результаты исследований объяснимы с точки зрения высокого уровня полиморфизма C. parasitica по генам вегетативной несовместимости. Функция вегетативной несовместимости у природных изолятов гриба контролируется шестью несцепленными vic – локусами, генетика которых сложна и недостаточно изучена [7, с. 112]. Определенное сочетание аллелей специфических локусов двух взаимодействующих изолятов обусловливает вегетативную несовместимость. Опытами in vitro доказано, что конверсия агрессивных штаммов в гиповирулентные обусловлена числом VC – локусов, по которым отличаются тестируемые изоляты. Различия изолятов по одной паре аллелей снижают, но не препятствуют миграции dsRNA, а по многим локусам – полностью предотвращают трансмиссию гиповирулентности. Показано, что не только географически удаленные популяции C. parasitica, но и формирующиеся на одной раковой опухоли, распадаются на значительное число вегетативно несовместимых VC– групп. Изолированность соседних колоний друг от друга обеспечивает внутривидовую дивергенцию, а накопление в геноме гиповируса [12, с. 866] препятствует половому скрещиванию изолятов паразита [7, с. 113]. В частности, азиатские популяции гриба по сравнению с европейскими и североамериканскими генетически более полиморфны, что подтверждает наличие выделенных в Японии и Китае нескольких десятков VC – групп. При этом VC– группы из Японии проявили совместимость с 64 VC– группами из Европы [16, с. 280].
Таким образом, нами впервые проведена вегетативная гибридизация морфотипов C. parasitica из Турции и Северного Кавказа. Доказано, что в турецкой популяции паразита трансмиссия гиповирусов CHV1-EP721 и CHV1-euro7 из alb–гиповирулентных в aur–агрессивные изоляты ингибируется наличием барьера вегетативной несовместимости – барраж или бордюр. Подтверждена возможность распространения фактора гиповирулентности путем конверсии штамма CHV1-EP713 из генома А2 и А9 alb – морфотипа Северного Кавказа в среднеагрессивные lut– изоляты C. parasitica Турции.
Список литературы
- Белов А.А. Внутривидовой полиморфизм фитопатогенного гриба Cryphonectria parasitica в причерноморской части ареала каштана посевного (Castanea sativa)/ А.А. Белов // Автореф. дис. … канд. биол. наук. М., 2010. – 19с.
- Гибридизация изолятов C. parasitica (Северный Кавказ # Турция) – режим доступа к изд.: https://www.facebook.com/nina.grinko/photos_albums#
- Гибридизация морфотипов Cryphonectria parasitica: Северный Кавказ – режим доступа к изд.: https://www.facebook.com/nina.grinko/photos_albums#
- Гринько Н.Н. Внутривидовое разнообразие возбудителя рака каштана съедобного на Северном Кавказе/ Н.Н. Гринько// Вестник РАСХН, 2009. – №4. – С. 29 – 33.
- Гринько Н.Н. Морфологическая изменчивость гриба Cryphonectria parasitica (Murrill) M.E.Barr. из Турции/ Н.Н. Гринько// Вісник Харьківського нац. аграр. ун–ту ім. В.В.Докучаева: сер. «Фітопатологiя та ентомологiя». – Харків, 2011. – №9. – С. 44–50.
- Гринько Н.Н. Агрессивность внутривидовых структур гриба Cryphonectria parasitica (Murrill) M.E.Barr. из Турции/ Н.Н. Гринько // Вісник Харьківського нац. аграр. ун–ту ім. В.В.Докучаева: сер. «Фітопатологiя та ентомологiя». – Харків, 2012 – №11. – С. 46–51.
- Дьяков Ю.Т. Вегетативная несовместимость у фитопатогенных грибов/ Ю.Т. Дьяков, А.В. Долгова // М.: МГУ, 1995. – 161с.
- Зайцев Г.Н. Математическая статистика в экспериментальной ботанике/ Г.Н. Зайцев// М.: Наука, 1984. – 424с.
- Полиморфизм гриба Cryphonectria parasitica: Турция – режим доступа к изд.: https://www.facebook.com/nina.grinko/photos_albums#
- Рак коры каштана (Castanea sativa) – режим доступа к изд.: https://www.facebook.com/nina.grinko/photos_albums#
- Çeliker N.M. Evalution of hypovirulent isolates of Cryphonectria parasitica for the biological control of chestnut blight in Turkey/ N.M. Çeliker, E. Onoğur // Forest Snow and Landscape Res., 2001. – Vol. 76. – № 3. – 378 – 382.
- Döken M.T. Chestnut blight and evalution of the feasibility of its biological control in the Aydin province, Turkey by using hypovirulence: I European Congress on chestnut castanea/ M.T. Döken, Açikgöz, O. Erincik //Acta Hortical, 2009. – P. 866.
- Milgroom M. G. Biological control of chestnut blight with hypovirulence: A critical analys/ M. G. Milgroom, P. Cortesi // Ann. Reviem of Phytopathol.: Palo Alto (), 2004. – Vol. 42. – P. 311 – 338.
- Robin C. Dominance of natural over released biological control agents of the chestnut blight fungus Cryphonectria parasitica in south – casters France is associated with fitness – related traits/ C. Robin, S. Lanz, A. Souteron, D. Rigling // Biol. Control., 2010. – Vol. 53. – № 1. – 55 – 61.
- Linder-Basso D. Genome analysis of Cryphonectria hypovirus 4, the most common hypovirus species in North America /D. Linder-Basso, J. N. Dynek, B. I. Hillman // Virology, 2005. –Vol. 1. – № 337. –P. 192 – 203.
- Liu Y. C. High diversity of vegetative compatibility types in Cryphonectria parasitica in Japan and China/ Y. C. Liu, M. G. Milgroom // Mycologia, 2007. – Vol. 99. – № 2. – С. 29 – 33.[schema type=»book» name=»ГИБРИДИЗАЦИЯ ТУРЕЦКИХ И СЕВЕРОКАВКАЗСКИХ МОРФОТИПОВ CRYPHONECTRIA PARASITICA (MURRIL) M.E.BARR. – ВОЗБУДИТЕЛЯ РАКА КОРЫ КАШТАНА ПОСЕВНОГО » author=»Гринько Нина Николаевна» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-03-30″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_30.04.2015_04(13)» ebook=»yes» ]

