Одним из первых полимерных материалов, исследованных в качестве электронорезистов, были негативные фоторезисты на основе поливинилциннамата и циклокаучука. Обзор этих работ представлен в [3, с. 155]. Применение в настоящее время синтетических полимеров в области микроэлектроники в качестве фото- и электронорезистов еще не в достаточной мере удовлетворяет тем требованиям, которые предъявляют этой отрасли, а именно высокая фоточувствительность, удовлетворительная разрешающая способность, устойчивость к химическим воздействиям, хорошая адгезия пленки фоторезиста к подложке и хорошие деформационно-прочностные характеристики. Этим объясняется большой интерес исследователей к получению новых типов фоточувствительных полимеров для микроэлектроники [1, с. 362; 2, с. 3; 4, с. 53; 14, с. 1993; 15, с. 58, 16, с. 11; 17, с. 115]. Решение данной проблемы осуществлялось нами путем полимеризации функциональнозамещенных циклопропилстиролов [5, с. 497; 6, с. 1577; 7, с. 183; 8, с. 101].
Интерес к получению таких полимеров был обусловлен, прежде всего, тем, что в образующихся макромолекулах содержатся реакционноспособные функциональные группы различной природы в виде подвесок в основной макроцепи. В результате сополимеризации функциональных циклопропансодержаших виниловых соединений, являющихся одним из перспективных реакционноспособных мономеров, синтезированы полимеры, содержащие циклопропановые группировки, регулярно расположенные в боковых привесках или макроцепи [9, с. 2030; 10, с. 40;].
Данная работа посвящена исследованию сополимеризации (п-винилфенил)циклопропилметилциннамата (ФЦПЦ) со стиролом и метилметакрилатом (ММА) и изучению структуры и свойств сополимеров, полученных на их основе с целью создания новых фоточувствительных сополимеров. Выбор данного мономера обусловлен тем, что концентрация двойных связей и их химическая природа, а также наличие циклопропанового кольца в сочетании с карбонильной группой в мономере в решающей степени влияют на такие важнейшие фотолитографические параметры резиста, как фоточувствительность и разрешающая способность, о чем свидетельствует накопленный к настоящему времени довольно большой экспериментальный материал.
ФЦПЦ является новым реакционноспособным мономером, формула и данные о синтезе и гомополимеризации которого приведены в работе [8, с. 101]. Выбор данного соединения для исследования сополимеризации с традиционными мономерами (стирол и ММА) обусловлен наличием в молекуле нестандартного мономера сильно поглощающих световую энергию групп (карбонильной, и циклопропановой). Для сополимеризации изучаемых систем важно выбрать условия, при которых полимеризация протекала бы только по винильной группе, а реакционноспособные фрагменты оставались бы в боковой цепи без изменений.
Экспериментальная часть
Синтез (п-винилфени)циклопропилметилового эфира коричной кислоты осуществляли по методике, описанной в работе [8, с. 101].
Сополимеризацию синтезированного циннамата со стиролом и ММА осуществляли в ампулах в растворе бензола в присутствии 0.5% динитрилазоизомасляной кислоты (ДАК) (от суммарной массы мономеров) при 70°С. Cуммарная концентрация исходных мономеров было постоянной и составляла 1,0 моль/л, а соотношение исходных мономеров менялось в концентрациях указанных в табл.1. Образовавшийся сополимер очищали двукратным переосаждением из бензольного раствора в метанол и сушили в вакууме (15-20 мм рт. ст.) при 30°С до постоянной массы. Сополимеры, представляющие собой порошок белого цвета, хорошо растворимы в ароматических и хлорированных углеводородах. Характеристическую вязкость определяли в бензоле в вискозиметре Уббелоде. Характеристическая вязкость составляло ([η] = 0.95-1.1 дл/г).
Состав сополимеров определяли по данным элементного анализа и анализа функциональных групп (определение двойных связей по бромному числу).
ИК-спектры сополимеров регистрировали на спектрометре UR-20, спектры ПМР – на спектрометре BS-487B Tesla (80 МГц) в растворе дейтерированного хлороформа.
Для исследования фотохимического структурирования сополимера были приготовлены 2-10%-ные растворы сополимеров, которые наносили на стеклянную подложку размером 60 × 90 мм. Нанесение осуществляли методом центрифугирования при 2500 об·мин-1. Толщина слоя резиста после его высушивания в течение 10 мин. при комнатной температуре и в течение 20 мин. при 25°С/10 мм рт. ст. составляла 0.15-0.20 мкм. В качестве источника УФ-облучения использовали ртутную лампу ДРТ-220 (сила тока – 2.2 А, расстояние от источника излучения – 15 см, скорость передвижной заслонки экспонометра 720 мм·ч-1, время экспозиции – 5-10 сек.). Содержание нерастворимого сополимера рассчитывали по массе остатка, как факта образования сшитого продукта.
Результаты и их обсуждение
С целью установления строения синтезированных сополимеров были проведены спектральные анализы (ИК- и ПМР-спектроскопия) синтезированных мономерных и полимерных образцов.
Ввиду того, что ФЦПЦ является полифункциональным соединением, при его радикальной сополимеризации со стиролом и ММА следовало ожидать образование новых реакционноспособных полифункциональных сополимеров.
Путем сопоставления ИК-спектров сополимеров со спектрами исходных мономеров установлено, что полосы поглощения в ИК-спектре исходного мономера при 990 и 1640-1645 см-1, относящиеся к деформационным и валентным колебаниям двойной связи винильной группы, после сополимеризации исчезают. Полосы поглощения, характерные для бензольного кольца и циклопропановой группы, сохраняются и после полимеризации. Полосы поглощения при 1720 и 1110 см-1, относящиеся к колебаниям и простой эфирной связи, соответственно, остаются незатронутыми. В спектре сополимеров присутствует также полоса 1635 см-1, которая характеризует связь коричневой кислоты.
Кроме того, в интервале частот 800-680 см-1 и при 780, 750, 730 и 680 см-1 наблюдались полосы поглощения, характеризующие монозамещенные бензолы в эфирах коричной кислоты. На рис. 1 представлен ИК-спектр сополимера ФЦПЦ со стиролом (1 a необлученная плёнка).
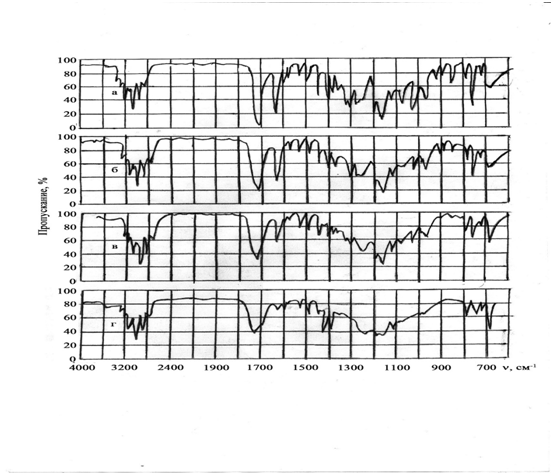
Рисунок 1. ИК-спектры пленки сополимера ФЦПЦ со стиролом: необлученной (а) и облученной в течение 1-ой (б), 3-х (в) и 4-х (г) минут.
В ПМР-спектре сополимера отчетливо проявляются резонансные сигналы, относящиеся к протонам бензольного ядра (δ = 6.60-7.30 м.д.) и циклопропанового кольца (δ = 0.65-1.66 м.д.), а сигналы, относящиеся к протонам винильной группы (δ = 5.10-6.65 м.д.) – отсутствуют. По данным спектроскопии сополимеризация ФЦПЦ со стиролом и ММА протекает только за счет раскрытия двойных связей винильных групп с сохранением остальных реакционноспособных функциональных фрагментов 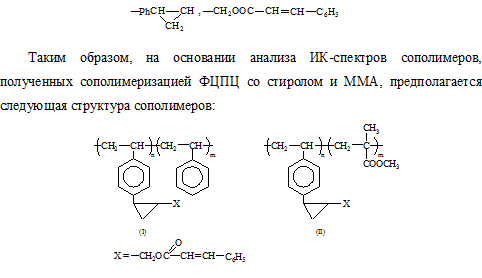
Сополимеризация осуществлялась при различных соотношениях исходных мономеров. При любом исходном соотношении мономеров всегда образуется сополимер, обогащенный звеньями ФЦПЦ (табл. 1).
Для оценки полимеризационной активности ФЦПЦ были рассчитаны значения констант относительной активности мономеров по составам исходной мономерной смеси по методу Файнмана-Росса [13, с. 38] и параметры Q-e – по Алфрею и Прайсу. Параметры микроструктуры сополимеров определяли, исходя из констант сополимеризации [12, с. 33]. Полученные данные представлены в табл. 1.
Таблица 1.
Сополимеризация ФЦПЦ (М1) со стиролом (М2) и ММА (М2).
| Состав
исходной смеси, мол.% |
Б. Ч.,
Г |
Состав
сополимеров, мол.% |
r1 | r2 | Q1 | e1 | r1·r2 |
Микроструктура сополимера |
|||||||
| М1 | М2 | m1 | m2 | LM1 | LM2 | R | |||||||||
|
ФЦПЦ–Ст |
|||||||||||||||
| 10 | 90 | 6.1 | 15.61 | 84.39 | 1.08
±0.03 |
0.56
±0.02 |
3.1
±0.01 |
-1.5
±0.02 |
0.6 | 1.12 | 6.04 | 28 | |||
| 25 | 75 | 13.12 | 33.47 | 66.53 | 1.35 | 2.68 | 50 | ||||||||
| 50 | 50 | 22.3 | 57.08 | 42.92 | 2.08 | 1.56 | 55 | ||||||||
| 75 | 25 | 30.62 | 78.12 | 21.88 | 4.24 | 1.18 | 37 | ||||||||
| 90 | 10 | 35.6 | 91.0 | 9.0 | 10.72 | 1.06 | 17 | ||||||||
|
ФЦПЦ–ММА |
|||||||||||||||
| 10 | 90 | 7.7 | 19.36 | 80.64 | 1.05
±0.03 |
0.4
±0.02 |
2.5
±0.01 |
-0.9
±0.02 |
0.42 | 1.12 | 4.60 | 35 | |||
| 25 | 75 | 15.0 | 37.90 | 62.10 | 1.35 | 2.20 | 56 | ||||||||
| 50 | 50 | 23.5 | 59.35 | 40.65 | 2.05 | 1.40 | 58 | ||||||||
| 75 | 25 | 31.1 | 78.54 | 21.46 | 4.15 | 1.13 | 38 | ||||||||
| 90 | 10 | 36.0 | 90.91 | 9.09 | 10.45 | 1.04 | 17 | ||||||||
LM1 и LM2 – средняя длина блоков звеньев мономеров; R – коэффициент блочности Харвуда
Значения констант относительной активности (табл. 1) свидетельствуют о большей реакционной способности ФЦПЦ по сравнению со стиролом и ММА, что связано с влиянием заместителя у циклопропанового кольца –CH2OOC–CH=CH–C6H5 на электронную плотность двойной связи винильной группы [11, с. 720]. Сложноэфирная группа включается в общую систему сопряжения, вызывая перераспределение электронной плотности как в мономере, так и в образующемся из него радикальном центре. В результате энергия, необходимая для возникновения переходного состояния, снижается, приводя к повышению реакционной способности мономера.
Рассчитанные значения параметров Q1 и e1 при сополимеризации как со стиролом, так и с ММА указывают на возросшее сопряжение в мономере (ФЦПЦ), связанное с влиянием заместителя – циннаматного фрагмента, обусловливающего высокую реакционную способность мономера и более низкую реакционную способность радикалов. Влияние заместителя у ФЦПЦ приводит к большему уменьшению плотности электронного облака у двойной связи винильной группы, чем у стирола, изменяя полярность радикала. С этим связана и большая, по сравнению со стиролом и ММА, реакционная способность ФЦПЦ, подтверждаемая константами сополимеризации (r1 = 1.08 и 1.05, а r2 = 0.56 и 0.4, соответственно). На основании рассчитанных констант сополимеризации были получены данные о микроструктуре сополимеров (табл. 1). Длина блоков LM1 увеличивается с увеличением доли ФЦПЦ в составе сополимера. Из таблицы видно, что R и LM1 максимальны (55 и 37; 2.08 и 4.24 единиц, соответственно) при соотношении исходных мономеров 50:50, 75:25. Отсюда следует, что подбором определенных составов мономерных смесей можно осуществить направленное формирование микроструктуры сополимеров, что является одним из наиболее перспективных путей модификации их свойств.
Наличие в звеньях макромолекулы синтезированных сополимеров реакционноспособных группировок разной химической природы вызывает интерес к исследованию фотохимического структурирования этого сополимера, т.е. сшивки под действием УФ-облучения.
Фотохимические исследования синтезированных сополимеров проводили по методике [6, с. 1577]. Благодаря наличию сильнопоглощающих световую энергию групп (циклопропановые, , –O–CO–C–) синтезированные сополимеры являются фоточувствительными и при воздействии УФ-облучением подвергаются фотохимическим превращениям, приводящим к образованию сетчатых структур. ИК-спектроскопическими исследованиями был изучен процесс структурирования полученных циклопропансодержащих сополимеров. В зависимости от продолжительности облучения (20-25 мин.) интенсивность максимумов полос поглощения, характерных для циклопропанового кольца (1030-1035 см-1), двойной связи и карбонильной группы (1720 см-1), значительно падает или полностью исчезает (см. рис. 1).
Структурирование протекает за счет раскрытия двойной связи и циклопропанового кольца, карбонильной группы в циннаматных фрагментах.
Полоса поглощения при 1720 см-1, характерная для карбонильной группы в сложноэфирном фрагменте и находящаяся в сопряжении с двойной связью, после облучения смещается до 1740 см-1, что, вероятно, связано с реакцией раскрытия двойной связи и, как следствие, нарушением сопряжения.
Таким образом, наличие в макромолекулах полученного сополимера циклопропанового кольца, циннаматных и карбонильных групп позволило создать на базе сополимера материал с высокой фоточувствительностью.
Список литературы:
| 1. | Вайнер А.Я., Дюмаев К.М., Лихачев И.А. и др. // Докл. Академии наук (ДАН). 2004. Т. 396. № 3. С. 362-365. |
| 2. | Вайнер А.Я., Дюмаев К.М. // Хим. промышленность. 1989. № 7. С. 3-6. |
| 3. | Глазштейн Л.Я., Кораблин А.С. Полимерные резисты для электронолитографии. М.: ЦНИИ «Электроника», 1972. Вып. 12. – 155 с. |
| 4. | Галактионов Д. // Пластикс. 2007. № 7-8. С. 53-54. |
| 5. | Гулиев К. Г., Пономарева Г. З., Гулиев А. М. // ЖПХ. 2006. Т. 79. № 3. С. 497-500. |
| 6. | Гулиев К. Г., Пономарева Г. З., Гулиев А. М. // Высокомолек. соед. 2007. Т. 49Б. № 8. С. 1577-1581. |
| 7. | Гулиев К. Г., Пономарева Г. З., Мамедли С. Б. // Процессы нефтехимии и нефтепереработки. 2009. 10. № 2. С. 183-186. |
| 8. | Гулиев К. Г., Алиева А. М., Гулиев А. М. // ЖПХ. 2013. Т. 86. Вып. 1. С. 101-104. |
| 9. | Гулиев К. Г. // ЖПХ. 2011. Т. 84. Вып. 12. С. 2030-2033. |
| 10. | Гулиев К. Г. // ЖПХ. 2011. Т. 84. Вып. 12. С. 2030-2033. |
| 11. | Гулиев К. Г., Пономарева Г. З., Мамедли С. Б., Гулиев А. М. // Журнал структурной химии. 2009. Т. 50. № 4. С. 720-722. |
| 12. | Зильберман Е. Н. // Высокомолек. соед. 1979. Т. 21Б. № 1. С. 33-36. |
| 13. | Кузнецов Е.В., Дивгун С.М. и др. Практикум по химии и физике полимеров. М.: Химия, 1977. – 38 с. |
| 14. | Hou H., Jiang J., Ding M. // Eur. Polym. J. 1999. V. 35. N 11. P. 1993-2000. |
| 15. | Рупышев В. Г., Иванко М. П., Козлова Г. И. и др. // Пласт. массы. 1983. № 3. С. 58-59. |
| 16. | Филичкина В.Н. // Хим. промышленность за рубежом. 1985. № 11. С. 11-27. |
| 17. | Царев П. К., Баранов В. Г., Липатов Ю. С. // Высокомолек. соед. 1970. Т . 12Б. С. 115-117. |
[schema type=»book» name=»СОПОЛИМЕРИЗАЦИЯ (П-ВИНИЛФЕНИЛ)ЦИКЛОПРОПИЛМЕТИЛЦИННАМАТА СО СТИРОЛОМ И МЕТИЛМЕТАКРИЛАТОМ» author=»Гулиев Казым Гафар оглы, Алиева Афет Мирза гызы, Пономарёва Гюльнара Зияевна, Гулиев Абасгулу Мамед оглы » publisher=»басаранович екатерина» pubdate=»2017-05-29″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_ 30.01.2015_01(10)» ebook=»yes» ]

