Введение
Ароматические амины относятся к химическим соединениям, получаемым из ароматических углеводородов (бензола, толуола, нафталина, антрацена, дифенила и т.д) заменой, по крайней мере, одного атома водорода аминогруппой –NH2. Этот класс веществ относится к токсичным соединениям, широко используемым в различных отраслях промышленности. С точки зрения профессиональной вредности одним из наиболее важных ароматических аминов является о-дианизидин (другие названия – прочный синий B, 3,3′-диместоксибензидин). Это соединение применяется в промышленности для получения большого числа диазокрасителей для шерсти, шелка, хлопчатобумажных тканей и других материалов [1, с. 87; 2, с. 156]. о-дианизидин относится к сильнейшим канцерогенам, вызывающим рак мочевого пузыря и почек, а также раздражающе действует на кожу и слизистые оболочки [3, c. 362]. Все эти факты делают проблему его утилизации (в том числе, удаления его из промышленных стоков) достаточно острой и актуальной. Задача удаления органических загрязнителей из промышленных стоков в настоящее время полностью не решена [4, c. 6]. Перспективным направлением исследований утилизации органических контаминантов водных ресурсов является использование гетерогенных катализаторов на основе иммобилизованных ферментов, прежде всего – оксидоредуктаз, способных переводить производные фенола и бензола в менее опасные полимерные продукты, выпадающие в осадок, что делает возможным их удаление из реакционной среды простым фильтрованием [5, c. 145; 6, c. 3013; 7, c. 960]. Оксидоредуктазы (К.Ф. 1; в том числе — пероксидаза, тирозиназа, лакказа, каталаза и т.д.) – наиболее распространенные и стабильные ферменты с высокой субстратной специфичностью, доказавшие свою эффективность в реакциях окисления широкого спектра субстратов органической и неорганической природы [8, c.261].
Ферменты используются в промышленности как в свободном, так и в связанном (иммобилизованном) состоянии. Их использование в промышленных процессах очень выгодно как с экономической, так и с экологической точек зрения, поскольку ферментативные реакции проходят в мягких условиях без образования побочных продуктов. При этом иммобилизация во многих случаях является единственным способом повышения эффективности биокаталитических процессов. Активность иммобилизованного фермента обычно несколько ниже его активности в растворе, однако этот недостаток компенсируется возможностью многократного использования фермента. В то же время, не существует метода иммобилизации, который был бы универсален для всех ферментов и очень часто иммобилизация вносит дополнительные проблемы и в сам процесс, и в оценку его кинетических параметров. Для создания эффективных биокатализаторов целесообразно проводить их так называемый «рациональный дизайн» с учетом различных факторов: планируемой области применения, желаемых свойств поверхности носителя, стабильности к различным воздействиям [9, c.105]. В нескольких работах исследователями была доказана возможность ковалентной иммобилизации оксидоредуктаз на носителях различной природы [10, c. 189; 11, c. 1460]. Коллективом авторов статьи также ранее уже были получены данные об эффективности катализаторов на основе иммобилизованных оксидоредуктаз в окиcлении фенола и его производных [12, c. 80].
Целью данного исследования было создание и исследование физико-химических свойств и кинетических параметров эффективных катализаторов окисления о-дианизидина на основе пероксидазы хрена, иммобилизованной на различных твердых носителях.
Строение и механизм каталитического действия пероксидазы хрена
Пероксидаза хрена (HRP, молекулярный вес ~ 40 кДа, К.Ф. 1.11.1.7) представляет собой гликопротеид, состоящий из полипептидной цепи, формирующей двухдоменную глобулу, и гемовой простетической группы с атомом железа, располагающейся между доменами [13, c.199]. Механизм каталитического действия пероксидазы хрена хорошо изучен:
| HRP + H2O2 → HRP-I | (1) |
| HRP-I + RH2 → HRP-II + RH· | (2) |
| HRP-II + RH2 → HRP + RH· | (3) |
В реакции (1) происходит окисление нативного фермента (HRP) перекисью водорода двумя электронами с получением соединения I (HRP-I), активной формы фермента, в котором Fe3+ окисляется до феррила (FeIV = O), а порфирин – до порфиринового радикала. В реакции (2) HRP-I принимает субстрат (RH2) в свой активный центр и выполняет его окисление. При восстановлении HRP-I образуется соединение II (HRP-II), содержащее оксоферрилимидазол. В реакции (3) HRP-II окисляет вторую молекулу субстрата и восстанавливается до HRP, содержащего Fe3+. Продуктами реакции окисления являются свободные радикалы RH·, которые могут самопроизвольно взаимодействовать между собой с образованием олигомеров или полимеров, выпадающих в осадок. При этом взаимодействие HRP-I c донором происходит гораздо медленнее, чем образование HRP-I, и соответственно, является лимитирующей стадией процесса [13, c. 204].
Методы и методики
Реактивы
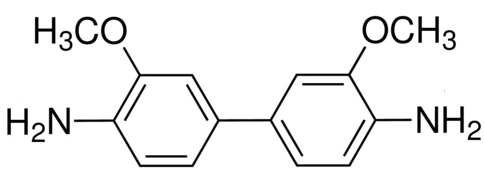
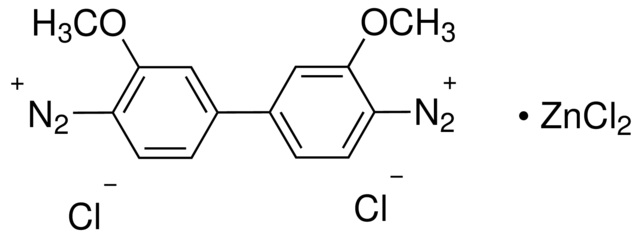
В работе использовали следующие компоненты (в скобках – условное обозначение): источником ферментативной активности был препарат пероксидазы хрена (Fluka, 900 ед/мг); в качестве носителей использовались ионообменная смола КУ 2-8 и коммерческий носитель иммобилизации ферментов Sepabeads EC-HA403 (Resindion, Италия); модификатором являлся хитозан кислоторастворимый средней вязкости (Fluka); активирующий агент — глутаровый диальдегид (DC Panreac); субстраты для окисления – о-дианизидин (Д1, прочный синий В) (рисунок 1а) и о-дианизидин соль (Д2, прочный синий В соль) (рисунок 1б).
 |
 |
|
а |
б |
|
Рисунок 1. Субстраты для окисления: а – о-дианизидин; б — о-дианизидин дигидрохлорид |
|
Оборудование и приборы
Изучение кинетики окисления о-дианизидина в присутствии нативной и иммобилизованной пероксидазы хрена осуществлялось в термостатируемом реакторе периодического действия с возвратно-поступательным качанием. Оптическая плотность реакционной смеси измерялась на Спектрофотометре СФ-2000 (ОКБ «Спектр»).
Синтез иммобилизованных биокатализаторов
Были синтезированы многослойные гетерогенные катализаторы, активный компонент которых — пероксидаза хрена — был присоединен к поверхности носителя (КУ 2-8 или Sepabeads EC-HA403). Иммобилизация пероксидазы хрена на КУ 2-8 проводилась по известной методике [12, c. 77]. Иммобилизация пероксидазы хрена на Sepabeads EC-HA403 проводилась в соответствии с сопроводительной документацией к данному носителю.
Иммобилизация проводилась в соответствии с выбранными схемами синтеза с промежуточной отмывкой дистиллированной водой от неспецифически связанных компонентов.
Методика проведения кинетических экспериментов
Для проведения кинетических экспериментов в каталитическом реакторе смешивались раствор исходного фермента (или катализатор, приготовленный из того же количества экстракта), раствор о-дианизидина (или о-дианизидина соли) необходимой концентрации, фосфатный буферный раствор (рН = 7,0) и раствор перекиси водорода (10 %-ный избыток относительно о-дианизидина) в соотношении 1:1:1:1 (об.). Первичные кинетические данные представляли собой зависимость от времени оптической плотности раствора при l = 460 нм, увеличивающейся в процессе окисления вследствие образования окрашенных продуктов. Начальная скорость реакции и другие кинетические параметры определялась методом двойных обратных координат после пересчета оптической плотности в концентрацию субстрата [14, c. 92].
Результаты и обсуждение
Определение оптимальных условий проведения процесса окисления
По результатам варьирования условий реакций окисления о-дианизидина и о-дианизидина соли при С0 = 20 ммоль/л были выявлены оптимальные условия: температура — 25ºС, интенсивность перемешивания – 300 мин-1, и рН – 7,0 , которые и использовались при изучении кинетики.
Сравнение эффективности биокатализаторов различного состава
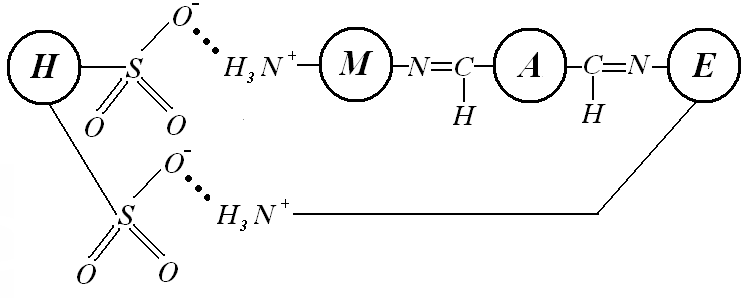
В результате иммобилизации были получены гетерогенные катализаторы «КУ 2-8 – хитозан – глутаровый диальдегид – пероксидаза» (К1) и «Sepabeads EC-HA403 – хитозан – глутаровый диальдегид – пероксидаза» (К2), схемы которых представлены на рисунке 2.
|
а |
 |
|
б |
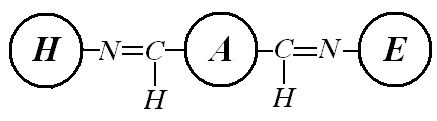 |
|
Рисунок 2. Схема разработанных гетерогенных катализаторов: а) «КУ 2-8 – хитозан – глутаровый диальдегид – пероксидаза» б) «Sepabeads EC—HA403 – хитозан – глутаровый диальдегид – пероксидаза»; обозначения: Н – носитель, М – хитозан, А – глутаровый диальдегид, Е – пероксидаза хрена |
|
Для оптимизации состава биокатализаторы на основе ионообменных смол были испытаны в реакции окисления о-дианизидина при постоянных исходных концентрациях о-дианизидина и Н2О2, рН, температуре и концентрации катализатора. Эксперименты показали, что наибольшую активность в реакции окисления фенолов показали биокатализаторы, приготовленные с использованием 0,1%-ного раствора хитозана, 25%-ного раствора глутарового диальдегида.
Для наиболее эффективных катализаторов по результатам кинетических экспериментов при варьировании начальной концентрации субстратов при оптимальных условиях реакции были получены кинетические параметры, приведенные в таблице 1. Активность катализаторов исследовалась в реакции окисления о-дианизидина и о-дианизидина соли (С0 = 20 ммоль/л).
Таблица 1.
Сравнение кинетических параметров катализаторов различного состава
| Параметр | Субстрат | Нативный фермент | Иммобилизованный катализатор | |
| К1 | К2 | |||
| Vm, ммоль/л·с | Д1 | 1.15 | 0.43 | 0.22 |
| Д2 | 1.23 | 0.34 | 0.15 | |
| Кm, ммоль/л | Д1 | 1,52 | 15,36 | 19.79 |
| Д2 | 1,78 | 17,18 | 26,54 | |
| Кcat, с-1 | Д1 | 7.30 | 2,73 | 1.75 |
| Д2 | 8.80 | 2,51 | 1.96 | |
| Активность биокатализатора,
ед. ак. (при Со=20 ммоль/л) |
Д1 | 4,51 | 1,88 | 1,31 |
| Д2 | 4,89 | 1,74 | 1,12 | |
Таким образом, более эффективными в окислении о-дианизидина являются катализаторы на основе ионообменной смолы КУ 2-8. Активность иммобилизованных катализаторов несколько ниже активности нативного фермента, что связано с гетерогенизацией фермент и затруднением доступа молекул субстрата к активным центрам фермента. Однако синтезированные катализаторы достаточно стабильны (снижают свою активность на 10-15% в последовательных экспериментах), а гетерогенизация делает фермент более удобной для применения в технологических процессах. Синтезированные биокатализаторы эффективно работают в диапазоне концентраций ароматических аминов, в котором они чаще всего встречаются в водных объектах – 1-30 ммоль/л.
Выводы
Таким образом, получены следующие результаты:
— синтезированы многослойные гетерогенные катализаторы на основе пероксидазы хрена, иммобилизованных на ионообменную смолу КУ 2-8 и Sepabeads EC-HA403, оптимизирован компонентный состав катализаторов;
— определены кинетические параметры синтезированных катализаторов, выявлено, что наиболее эффективным из синтезированных биокатализаторов является система «катионит КУ 2-8–хитозан–глутаровый альдегид–пероксидаза»;
— остаточная активность иммобилизованной пероксидазы ниже активности нативного фермента, однако катализаторы стабильны в последовательных экспериментах, а иммобилизация делает фермент более удобным для применения в технологических процессах.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований.
Список литературы
- Гурвич Я.А., Кумок М. Химия и технология промежуточных продуктов и органических красителей. М.: Высшая школа, 1968. 360 с.
- Венкатарман К. Химия синтетических красителей: В 2-х т.: т.1. Пер. с англ. Л.: ГНТИ Хим. лит., 1956. 804 с.
- Быховская М.С., Гинзбург С.Л., Хализова О.Д. Методы определения вредных веществ в воздухе (Практическое руководство). М.: Медицина, 1966. 595 с.
- Wilberg K.Q., Nunes D.G., Rubio J. Removal of phenol by enzymatic oxidation and flotation // Braz. J. of Chem. Eng. 2000. Vol. 17. P. 4-7.
- Karam J. Nicell J.A. Potential applications of enzymes in waste treatment // J. Chem. Tech. Biotechnol. Vol. 69. P. 141–153.
- Caza N., Bewtra J.K., Biswas N., Taylor K.E. Removal of phenolic compounds from synthetic wastewater using soybean peroxidase // Wat. Res. 1999. Vol. 33. P. 3012–3018.
- Cooper V.A., Nicell J. Removal of phenols from a foundry wastewater using horseradish peroxidase // Wat. Res. 1996. Vol. 30 (4). P. 954-964.
- Schmid A., Hauer B., Kiender A., Wubbolts M., Witholt B. Industrial biocatalysis today and tomorrow // Nature. 2001. Vol. P. 258-268.
- Tischer W., Wedekind F. Immobilized enzymes: methods and applications // Top. Curr. Chem. 1999. Vol. P. 95-126.
- Ensuncho L. , Alvarez-Cuenca M., Legge R.L. Removal of aqueous phenol using immobilized enzymes in a bench scale and pilot scale three-phase fluidized bed reactor // Bioprocess. Biosyst. Eng. 2005. Vol. P. 185-191.
- Bindhu L.V., Abraham Bindhu T. E. Immobilization of horseradish peroxidase on chitosan for use in nonaqueous media // J. Appl. Polym. Sci. 2003. Vol. P. 1456-1464.
- Сидоров А.И., Лакина Н.В., Сульман Э.М., Ожимкова Е.В., Манаенков О.В., Тихонов Б.Б. Очистка сточных вод от фенолов с использованием иммобилизованных оксидоредуктаз растений и грибов // Вестник Тверского государственного университета. Серия «Биология и экология». Тверь: ТвГУ, Вып. 21(№2). 2011. С. 74-81.
- Dunford H.B., Stillman J.S. On the function and mechanism of action of peroxidase // Coord. Chem. Rev. 1976. V.19. N P.187-251.
- Варфоломеев С.Д. Химическая энзимология [Текст]. М.: Academa, 2005. 472 с.[schema type=»book» name=»ОКИСЛЕНИЕ АРОМАТИЧЕСКИХ АМИНОВ ИММОБИЛИЗОВАННЫМИ ОКСИДОРЕДУКТАЗАМИ» description=»Целью исследования было создание и исследование физико-химических свойств и кинетических параметров эффективных катализаторов окисления о-дианизидина на основе пероксидазы хрена, иммобилизованной на различных твердых носителях. В результате работы были синтезированы многослойные гетерогенные катализаторы на основе пероксидазы хрена, иммобилизованной на ионообменную смолу КУ 2-8 и Sepabeads EC-HA403, оптимизирован компонентный состав катализаторов, определены кинетические параметры синтезированных катализаторов, выявлено, что наиболее эффективным из синтезированных катализаторов является система «катионит КУ 2-8–хитозан–глутаровый альдегид–пероксидаза». Кроме того, выявлено, что остаточная активность иммобилизованной пероксидазы ниже активности нативного фермента, однако катализаторы стабильны в последовательных экспериментах, а иммобилизация делает фермент более удобным для применения в технологических процессах.» author=»Тихонов Борис Борисович, Стадольникова Полина Юрьевна, Сидоров Александр Иванович» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-02-23″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_25.07.15_07(16)» ebook=»yes» ]

