Химические тесты широко используются во всех сферах деятельности человека и обеспечивают возможность простого и недорогого анализа.Тест – системы для химического анализа представляют собой простые, лёгкие и дешёвые аналитические средства и соответствующие экспрессные методики для обнаружения и определения веществ без существенной пробоподготовки, без использования сложных стационарных приборов, лабораторного оборудования, без самой лаборатории, без сложной обработки результатов, а также подготовленного персонала; в большинстве случаев применяют автономные средства однократного использования [1].
Общий принцип почти всех химических тест-методов – это использование аналитических реакций и реагентов в условиях и формах, обеспечивающих получение визуально наблюдаемого или легко измеряемого эффекта; это, например, интенсивность окраски бумаги или длина окрашенной части трубки. Реагенты и добавки используют в виде заранее приготовленных растворов (в ампулах или капельницах) или иммобилизованными на твёрдом носителе – бумаге, силикагеле, пенополиуретане и т.д. В качестве средств для тест-методов химического анализа могут быть использованы индикаторные бумаги, индикаторные порошки и трубки, таблетки и др.
Тест-методы позволяют проводить широкий скрининг проб, например, объектов окружающей среды. Пробы, давшие положительный результат, отделяют от тех, что показали отсутствие компонента. В случае образцов, для которых результат был положителен, предполагается в случае необходимости и более глубокое изучение, в том числе в лаборатории с использованием дорогостоящих приборов [1, c. 173].
Получение твёрдофазного носителя, составляющего основу тест-системы для обнаружения ионов никеля, меди и кобальта, осуществляли по схеме, представленной на рисунке 1.
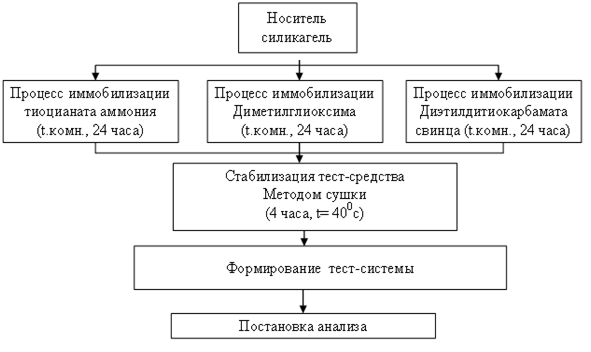
Рисунок 1. Блок-схема получения тест-системы
Блок-схема включает в себя следующие этапы: нанесение комплексообразователя на поверхность носителя, стабилизация тест-средства методом сушки и формирование тест-системы с учётом специфичности определяемых ионов.
В три химических стакана помещали навеску силикагеля массой по два грамма, приливали реактив Чугаева (10 мл), диэтилдитиокарбамат свинца в четырёххлористом углероде (10 мл) и тиоцианат аммония (10 мл), перемешивали и оставляли на 24 часа при t 20-25°С. После чего, сорбент с иммобилизованными комплексообразователями стабилизировали методом тепловой обработки 8 часов при t 30-35°С.
Для формирования тест-системы было проведено комплексное исследование влияния различных факторов на сорбционную ёмкость, специфичность и чувствительность тест-средства.
Сорбционную ёмкость определяли по количеству связавшегося с носителем определяемого иона из раствора.
Сорбционную ёмкость ионов кобальта определяли колориметрическим методом. Для этого в пять пробирок внесли по 3 мланализируемого раствора хлорида кобальта с концентрациями: 10 мг/л, 15 мг/л, 20 мг/л, 25 мг/л, 30 мг/л. В каждую пробирку прибавили по 1 мл раствора тиоцианата аммония. Голубая окраска проявлялась в течение 5 минут. На приборе ФЭК ПЭ5400 измеряли оптическую плотность полученных растворов при длине волны 540 нм и при толщине кюветы 1,040 мм. Стандартом служил раствор, содержащий 3 мл дистиллированной воды и 1 мл тиоцианата аммония. Полученные результаты представлены в таблице 1 и на рисунке 2.
Таблица 1
Оптическая плотность и процент пропускания анализируемых растворов хлорида кобальта в присутствии тиоцианата аммония
| № пробирки |
Концентрация анализируемого раствора, мг/л |
D | T, % |
| 1 | 10 | 0,165 | 69 |
| 2 | 15 | 0,130 | 75 |
| 3 | 20 | 0,120 | 76 |
| 4 | 25 | 0,115 | 77 |
| 5 | 30 | 0,05 | 90 |
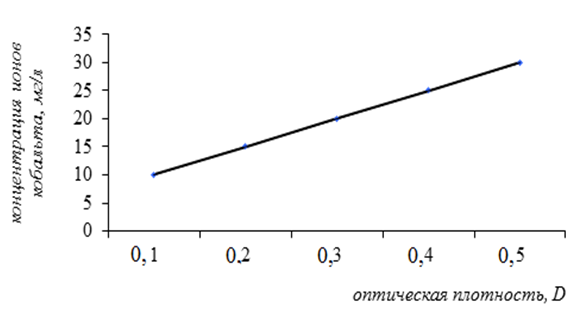
Рисунок 2. Зависимость оптической плотности раствора хлорида кобальта от его концентрации в присутствии тиоцианата аммония
Сорбционную ёмкость по ионам меди и никеля определяли атомно-абсорбционным методом. Для этого готовили растворы хлорида никеля следующих концентраций: 10,5; 12,4; 17,8; 25,3; 35,0 мг/л. Растворы сульфата меди были следующих концентраций: 11,3; 16,3; 25,4; 34,9 мг/л.
Влияние массы сорбента на сорбционную ёмкость проводили следующим образом. К навеске тест-сорбента определённой массы добавляли раствор анализируемого иона известной концентрации и оценивали величину сорбционной ёмкости. Данные представлены на рисунке 5.
Для данных кривых было получено критериальное уравнение и рассчитана вероятность степени аппроксимации.
У1 = -35,711x3 + 72,202x2 + 3,5789x + 52,813 (для ионов кобальта)
R2 = 0,9981;
У2 = -29,617x3 + 63,305x2 — 7,872x + 69,347 (для ионов никеля)
R2 = 0,9999;
У3 = 61,09x3 — 226,24x2 + 275,44x — 10,297 (для ионов меди)
R2 = 1.
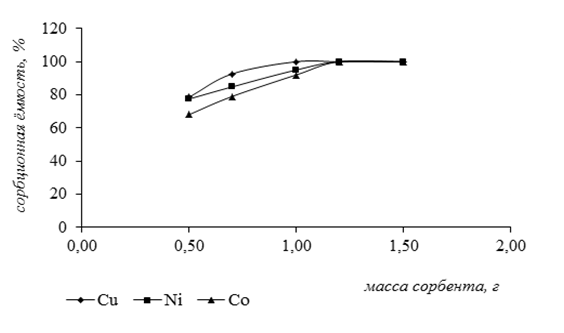
Рисунок 3. Влияние массы сорбента на сорбционную ёмкость
Из графика видно, что максимальная сорбционная ёмкость по ионам кобальта и никеля наблюдалась при массе сорбента 1,2 г, а по ионам меди – 1г. Выбор концентрации растворов исследуемых ионов для постановки данного анализа был обусловлен валовым содержанием этих элементов в объектах окружающей среды[2, c. 74].
Сорбционная ёмкость влияет на длину окрашенной зоны. В основу количественного определения элементов по величине окрашенной зоны положена особенность, связанная с равномерным распределением веществ в зоне, т.е. пропорциональная зависимость между размерами зон и концентрацией исследуемого раствора. Для этого нами было проведено исследование зависимости длины окрашенной зоны от концентрации анализируемого иона в растворе. Сорбент с иммобилизованным комплексообразователем помещали в стеклянную трубку диаметром 10 мм и длиной 100 мм. Через полученную систему пропускали раствор анализируемого иона известной концентрации. Наблюдалось развитие окраски тест-средства в результате взаимодействия комплексообразователя, закреплённого на носителе с исследуемым ионом.
Химизм реакций комплексообразования представлен на рисунке 4.
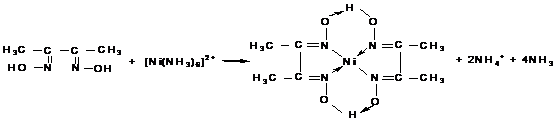
Со2+ + 6SCN— = [Co(SCN)6]4-
Рисунок 4. Реакции комплексообразования ионов кобальта, никеля и меди с соответствующими лигандами
Нами исследована специфичность тест-средства. Полученные данные представлены в таблице 2.
Таблица 2
Влияние разноимённых ионов на специфичность тест-системы
| №
п/п |
Специфичность тест-системы Cu2+-Ni2+ |
Специфичность тест-системы Cu2+ — Co2+ |
||||||||||
| Cu2+ | Ni2+ | Cu2+ | Co2+ | |||||||||
| Снач, мг/л | Скон,
мг/л |
Сорбция,
% |
Снач,
мг/л |
Скон
мг/л |
Сорбция,
% |
Снач мг/л | Скон,
мг/л |
Сорбция,
% |
Снач
мг/л |
Скон,
мг/л |
Сорбция,
% |
|
| 1 | 11,3 | — | 100,0 | 12,4 | 11,9 | 4,0 | 11,3 | — | 100,0 | 21,7 | 21,2 | 2,3 |
| 2 | 16,3 | 0,2 | 98,0 | 17,8 | 17,2 | 3,4 | 16,3 | 0,6 | 96,3 | 30,5 | 30,1 | 1,3 |
| 3 | 34,9 | 5,4 | 85,0 | 35,0 | 34,4 | 1,7 | 34,9 | 4,8 | 86,2 | 50,0 | 49,3 | 1,4 |
Проанализировав данные таблицы 2, можно сделать вывод, что отдельно взятое тест-средство отличается специфичностью, которая позволяет сформировать тест-системы следующим образом: медь-никель и медь-кобальт.
Процесс закрепления осадков на носителе основан на различных механизмах: адгезии (поверхностное взаимодействие кристаллов осадка с носителем), механическом задерживании крупных кристаллов и закреплении осадков за счёт сорбционных свойств поверхности носителя. Все эти процессы в свою очередь зависят от природы носителя, его дисперсности, природы осадителя и свойств самого осадка.
Так, природа носителя оказывает сильное влияние на закрепление осадков в колонке. Носитель должен обладать необходимой сорбционной ёмкостью по отношении к осадителю, к осадкам и к разделяемым ионам. Сорбционная ёмкость носителя должна строго контролироваться и находиться в определённых пределах, так как слишком большая ёмкость приводит к чрезмерной сорбируемости осадков и может ухудшить разделение, впрочем, как и слишком малая сорбционная ёмкость[3, c. 60-65].
Дисперсность носителя также оказывает существенное влияние на закрепление осадка. Высокодисперсный носитель лучше закрепляет осадки на своей поверхности, хотя это может привести к увеличению времени анализа, так как уменьшается скорость протекания исследуемого раствора через колонку. Целесообразнее использовать носитель с размером зёрен 0,1-0,02 мм.
Природа носителя, его способность удерживаться на носителе и по-разному взаимодействовать с разделяемыми ионами также оказывает влияние на закрепление осадка на носителе.
Для получения чётко окрашенных границ осадков нужно учитывать все факторы, влияющие на процесс закрепления осадка на носителе, подбирать соответствующие условия проведения эксперимента путём предварительных теоретических расчётов. В противном случае разделение не произойдёт. На рисунке 8 представлено распределение осадков по зонам.
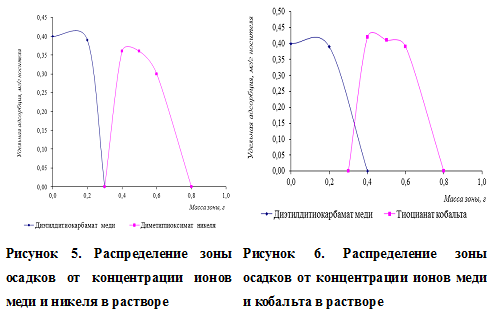
Для данных кривых было получено критериальное уравнение и рассчитана вероятность степени аппроксимации.
У1 = -12,833x2 + 2,5167x + 0,4 (для диэтилдитиокарбамата меди)
R2 = 1;
У2 = 17,925x3 — 35,143x2 + 21,261x — 3,6928 (для диметилглиоксимата никеля)
R2 = 0,9862.
Из рисунка 5 видно, что более растворимый осадок переходит в более подвижную фазу и содержание его в верхней зоне уменьшается. Теоретически разделение осадков диэтилдитиокарбамата меди и диметилглиоксимата никеля должно быть успешным, так как граница в их растворимости составляет более 103 и не зависит от концентрации анализируемых ионов.
На рисунке 6 представлено распределение окрашенных зон диэтилдитиокарбамата меди и тиоцианата кобальта.
Для данных кривых было получено критериальное уравнение и рассчитана вероятность степени аппроксимации.
У1 = -4,75x2 + 0,9x + 0,4 (для диэтилдитиокарбамата меди)
R2 = 1;
У1 = -6,958x2 + 7,5251x — 1,5816 (для тиоцианата кобальта)
R2 = 0,9188.
За счёт вторичных явлений при образовании осадков зона диэтилдитиокарбамата меди содержит незначительное количество тиоцианата кобальта. Этого избежать можно промыванием осадков водой, что позволит сделать более чёткой границу окрашенных зон за счёт перераспределения осадков на носителе.
Вышепредставленные данные легли в основу построения тест-системы по обнаружению ионов меди, никеля и кобальта.Данная тест-система использовалась для определения вышеуказанных ионов тяжелых металлов в почвах экспериментальных полей Астраханской области, расположенных вблизи аэропорта г. Астрахани.
Результаты проведенных исследований показали, что содержание тяжелых металлов в исследуемых объектах не превышает ПДК. При этом использование тест-системы позволило сократить время проведения анализа и увеличить диапазон концентраций определяемых ионов металлов. Тест-система не требует существенной пробоподготовки, использования сложных стационарных приборов, лабораторного оборудования и отличается специфичностью, чувствительностью. Определению не мешают в кратных количествах ионы Na, K, Ca, Mg, Ba, Zn, Fe(III), Mn, Cd, Al.
Разработанная тест-система представляет собой твёрдофазный носитель на основе силикагеля, на поверхности которого адсорбирован диметилглиоксим. Выбор носителя был обусловлен положительными свойствами твердой фазы. Гранулы, входящие в состав сорбента отличаются однородностью состава, механической прочностью, микробиологической устойчивостью и хорошей проницаемостью. Качественный анализ содержания никеля в объектах внешней среды предоставляет большие возможности химикам-аналитикам и ученым экологам в исследовательской деятельности. Тест-система позволит создать средства анализа недорогие лёгкие с точки зрения использования и в то же время сопоставимые по своим аналитическим характеристикам с современными инструментальными методами.
Разработанная тест-система обладает специфичностью, эспрессностью. При оценке наличия ионов никеля изменение окраски из белой в розовую свидетельствует о присутствии искомых ионов.
Список литературы:
- Алыков Н.М. Химия и окружающая среда / Н.М. Алыков, Т.В. Алыкова, В.В. Шакирова и др. — Справочник. – Астрахань, 2004. — 236с.
- Алыкова Т.В. Химический мониторинг объектов окружающей среды: Монография. Аст-рахань: Изд-во Астрах. гос. пед. ун-та, 2002. 210 с.
- Алыкова Т.В., Алыков Н.Н., Шакирова В.В., и др. Комплекс способов определения мик-роколичеств ПАВ и ингибиторов кислотной коррозии // Технологии нефти и газа. 2004. №1 (30). С.60-65[schema type=»book» name=»КАЧЕСТВЕННОЕ И КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ИОНОВ НИКЕЛЯ В ОБЪЕКТАХ ОКРУЖАЮЩЕЙ СРЕДЫ С ИСПОЛЬЗОВАНИЕМ НОВЕЙШЕЙ ТЕСТ-СИСТЕМЫ» description=»Создана тест-система для качественного и количественного определения ионов никеля в объектах окружающей среды. Разработанная тест-система обладает специфичностью, эспрессностью, при оценке наличия ионов никеля изменение окраски, что свидетельствует о присутствии искомых ионов.» author=»Садомцева Ольга Сергеевна, Шакирова Виктория Викторовна, Уранова Валерия Валерьевна, Фадеева Мария Валерьевна, Кожина Александра Дмитриевна» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-02-23″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_25.07.15_07(16)» ebook=»yes» ]

