В настоящее время аминоазолы (С-аминотриазолы, -тетразолы и др.) широко используются как полинуклеофильные реагенты в современной органической химии для построения гетероциклических систем, изучения регионаправленности, механизмов реакций и поиска возможного практического применения новых веществ, имеющих в своем составе азольный фрагмент[1]. Хорошо изученными являются реакции аминоазолов с β-диоксосединениями, α,β-непредельными кетонами, а в последние годы многокомпонентные реакции, приводящие к образованию частично насыщенных азолоазинов [2].
Нами ранее осуществлен синтез 5-арилметилиденоктагидротриазолопиримидинов двухкомпонентной конденсацией кросс-сопряженных диеноновых производных циклоалканонов с 3-амино-1,2,4-триазолом [3].
С целью использования преимуществ методологии трехкомпонентного синтеза и возможности избежания предварительного получения исходных диилиденциклоалканонов мы осуществили конденсацию циклопентанона (циклогексанона), С-аминотетразола (3-амино-1,2,4-триазола) и бензальдегида (тиофенкарбальдегида) в соотношении 1:1:2 при кипячении реагентов в ледяной уксусной кислоте. Установлено, что направление реакции определяется размером алицикла и типом аминирующего реагента. Так, в случае циклогексанона и С-аминотетразола реакция протекает полностью селективно, но, вместо ожидаемого илидензамещенного тетразологидрохиназолина А, выделен незамещенный по положению 5 9-фенил-4,5,6,7,8,9-гексагидротетразоло[5,1-b]хиназолин (1), полученный нами ранее, при трехкомпонентной циклоконденсации эквимольных соотнешений реагентов [4].
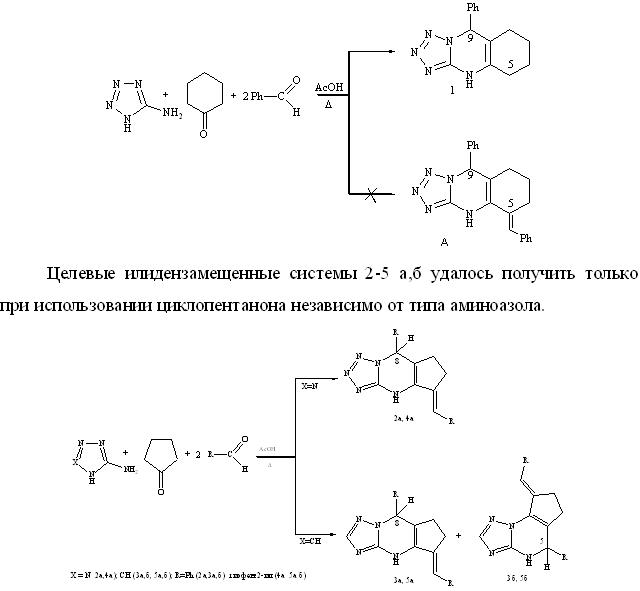
Реакция протекает селективно, с образованием 5-бензилиден(тиенилметилиден)-8-фенил(тиенил)-4,7-дигидроциклопента[1,5-a]тетразолопиримидина 2а, 4а линейного строения. Но при замене С-аминотетразола на 3-амино-1,2,4-триазол, в тех же условиях возникают наряду с линейными изомерами 3а,5а, изомеры углового строения 3б,5б.
В ЯМР 1Н спектре соединений 2а,4а присутствуют синглетные сигналы протонов NH (9.45 м.д., 10.77 м.д.), Н-8 (6.36 м.д., 6.95 м.д.), винильного протона (6.71 м.д., 7.11 м.д.), мультиплеты алифатических протонов (2.36 – 3.43 м.д.).
Ключевыми для отнесения изомеров в ЯМР 1Н спектре являются сигналы протонов Н-8 (5.52 м.д., 5.85 м.д.), Н-5 (6.14 м.д., 6.39 м.д.), NH (9.97 м.д., 8.57 м.д.) для линейных изомеров «а» и (10.14 м.д., 9.81м.д.) для угловых изомеров «б».
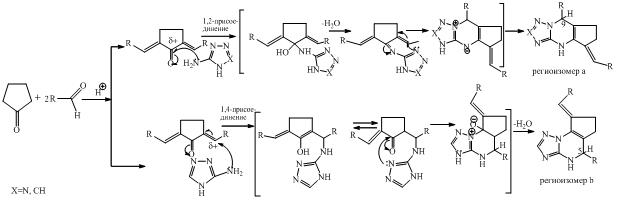
Различное строение продуктов реакции можно объяснить различными путями их образования. Формирование тетразологексагидрохиназолина 1, вероятно, протекает через азометиновый интермедиат по схеме предложенной нами ранее [5]. Из-за высокой СН-кислотности циклопентанона интремедиатом является не азометин, а α,β-непредельный кетон (2,5-диарилметилиденциклопентанон А). Образование позиционных изомеров 3,5а,б обусловлено атакой нуклеофила по двум электрофильным центрам кетона — карбонильному атому углерода с последующей азоциклизацией (региоизомеры а), либо как сопряженное 1,4-присоединение (региоизомеры б). В силу менее выраженной нуклеофильности С-аминотетразола атака осуществляется по более электрофильному карбонильному атому углерода, что приводит к изомерам линейного строения.
Косвенным подтверждением предложенной схемы является встречный синтез 8-фенил-5-бензилидентетразолодигидропиримидина 2а двухкомпонентной конденсацией 2,5-дибензилиденциклопентанона с С-аминотетразолом и образование смеси позиционных изомеров 3а и 3б при использовании 3-амино-1,2,4-триазола.
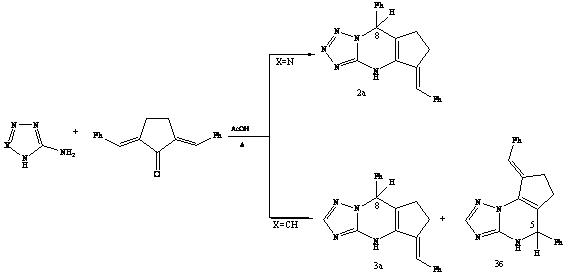
Таким образом, методология трехкомпонентной циклоконденсации может быть успешно применена только для селективного синтеза линейно построенных 5-арилметилидентетразолоциклопентапиримидинов и получения смеси изомерных триазолосодержащих аналогов с одинаковыми арильными группами.
Литература
- Dotting the i’s in three-component Biginelli-like condensations using 3-amino- 1,2,4-triazole as a 1,3-binucleophile / Yu.V.Sedash, N.V. Gorobets, V.A. Chebanov [at al.] // RSC Adv. – 2012. – 2, № 17. – P. 6719–6728.
- Chebanov, V.A. Aminoazoles as Key Reagents in Multicomponent Heterocyclizations / V.A. Chebanov, Gura K. A., S. M. Desenko// Top. Heterocycl. Chem. – 2010. – 23. — P.41-84.
- Диеновые производные циклических кетонов С5-С7 в реакциях с N- и С-нуклеофильными реагентами / А.Г. Голиков, Ю.А Фомина, А.А. Морозова, [и др.] // Тез. докл.XI Международной научно-технической конференции “Перспективы развития химии и практического применения алициклических соединений”. Волгоград. — 2008. — С. 57.
- Трехкомпонентный синтез тетразолопиримидинов, аннелированных карбоциклами С6-С8 / А.А. Матвеева, Н.О. Борисова, Н.В. Поплевина, А.П. Кривенько // ХГС. — 2012. — № 12. — С. 2000-2002.
- Синтез, пути образования и изомеризация тетразолохиназолинов / Матвеева А.А., Борисова М.Ю., Бойко В.С., Кривенько А. П. // Известия Саратовского университета. Новая серия. Серия Химия. Биология. Экология. 2013. — Т. 4. — С. 24-27.[schema type=»book» name=»АМИНОТРИ(ТЕТР)АЗОЛЫ В СИНТЕЗЕ ЗАМЕЩЕННЫХ АЗОЛОЦИКЛАНОДИГИДРОПИРИМИДИНОВ» author=»Матикенова Асель Аскаровна, Сорокин Виталий Викторович, Кривенько Адель Павловна» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-05-06″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_ 28.02.2015_02(11)» ebook=»yes» ]

