Сахарный диабет является одной из основных причин инвалидности и смерти большой части населения. Общеизвестно, что основной целью при лечении сахарного диабета является снижение содержания сахара в крови, желательно до соответствия уровню сахара здоровых людей. В качестве методов достижения этой цели используются интенсивные инсулиновые режимы. У здорового человека секреция инсулина на протяжении суток имеет дискретный характер [1]. Причем, такая дискретная секреция в ответ на повышение гликемии крови осуществляется на фоне базального высвобождения инсулина из поджелудочной железы. Введенный препарат инсулина создает «имитацию» базальной секреции инсулина, а введение инсулина короткого действия за 30 минут до еды создает дополнительный пик повышения содержания инсулина в крови, совпадающий по времени с гипергликемией. Некоторые исследователи отмечают, что хорошие результаты могут быть получены при введении препарата инсулина в определённое время суток, например, утром или вечером [2,3], хотя надежных научных данных по дискретному введению инсулина нет. В настоящее время распространенным способом лечения является метод чрезкожного введения инсулина посредством инъекций. Способ связан с наличием механической травмы, болевого синдрома, асептических проблем и, связанного с этими факторами, психологического дискомфорта. Кроме того, отмечаются аллергические реакции как в области локализации высокой концентрации препарата, так и на уровне организма в целом.
Сегодня исследователи проявляют большой интерес к разработкам новых способов введения инсулина, обеспечивающих длительное (пролонгированное) действие. Это вызвано необходимостью избавить больного от частых инъекций инсулина короткого действия (3-4 раза в день), так как каждая инъекция связана с отрицательной эмоциональной реакцией на боль, а также с определенными трудностями соблюдения условий асептики и антисептики при многократных инъекциях во вне-амбулаторных условиях. Одно из направлений в решении данной проблемы связано с разработкой не инъекционных способов доставки инсулина в организм человека. Сегодня активно разрабатываются новые способы введения инсулина перорально, ингаляторно, а также пересадки поджелудочной железы, но все они пока недостаточно эффективны и не нашли широкого применения [4,5].
Ряд способов и аппаратов основаны на безыгольном механическом введении инсулина, например, когда струя раствора инсулина впрыскивается подкожно с большой скоростью, придающей потоку жидкости способность диффундировать, т.е. проникать через кожу. Однако данный способ требует не только дорогостоящего и сложного оборудования, но, в принципе, мало отличается от обычного метода инъекций с помощью шприца и иглы. Вообще, устранение иглы является существенным фактором, повышающим комфортность процедуры введения в организм инсулина. И, исходя из этих позиций, перспективными являются новые методы трансдермальных (чрезкожных) терапевтических систем (ТТС), которые основаны на использовании диффузии раствора инсулина через кожу [5]. Диффузия жидкости может происходить без механического повреждения, через большую контактную поверхность, составляющую десятки квадратных сантиметров кожи. Основным препятствием данного метода является роговой слой, трудно проницаемый для больших молекул, в том числе молекул инсулина.. Для создания в роговом слое каналов исследователи создают микропоры, используя различные физические методы: ультразвук, лазерное излучение, электрическое и радиочастотное воздействие, а для облегчения диффузии прибегают к упаковке молекул инсулина в капсулы, обладающие повышенной проникающей способностью.
Наиболее перспективным представляется без игольный метод введения инсулина, основанный на применении нового поколения медицинских материалов – пористопроницаемых сплавов на основе никелида титана и инфракрасного (ИК) излучения.
Развитие технологии порошковой металлургии и самораспространяющегося высокотемпературного синтеза (СВС) в режиме горения, позволило создать новый класс сложных по своей структуре высокопроницаемых пористых материалов на основе никелида титана (рис.1). Данные материалы способны играть роль ёмкостей, удерживающих в пористом пространстве жидкие среды, включая раствор инсулина. За счет капиллярного эффекта и процессов диффузии, и с применением ИК излучения можно не только удерживать раствор в пористом объеме никелида титана, но и направленно выводить его из пор.

Рис.1. Высокопроницаемый пористый материал из никелида титана: а – пористая пластина; б – пористая структура никелида титана
Широкий диапазон физико-механических свойств сплавов на основе никелида титана и возможность формирования из них пористых элементов конструкций, а так же высокая интенсивность теплообмена при низком уровне теплопроводности – всё это позволяет создавать компактные аппараты для эффективной безыгольной доставки раствора инсулина в тканевую систему организма. Основой при разработке аппаратов с пористо-проницаемыми элементами из никелида титана, являются регулирующие диффузию источники инфракрасного излучения [6,7].
Под ёмкостью материала подразумевается объем пористо-проницаемого пространства материала, который является важнейшей характеристикой взаимодействия пористого материала и жидкости. Расход жидкости через пористую структуру зависит от многих факторов, включая вязкость жидкости, степень деформации стенок пор материала, смачиваемость тканевых жидкостей и т.д.
Для пористых сплавов на основе никелида титана (TiNiMoFe) взаимодействие материала и тканевых жидкостей описывается формулой(1):
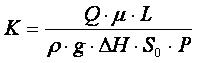 (1)
(1)
где:
К – коэффициент проницаемости, Q – расход жидкости, p – плотность жидкости, μ – вязкость жидкости, ΔH – уровень жидкости, g – ускорение свободного падения, S0 – исходная площадь сечения образца, L – длина образца, P – коэффициент пористости.
При параметрах пористости никелида титана 60 – 70% более половины объема элемента ёмкостной конструкции может занимать раствор инсулина. Процесс диффузии инсулина из пористой матрицы никелида титана зависит от всех параметров, представленных в формуле (1). Однако эта формула не учитывает влияния температуры, вернее градиента температуры ёмкостного элемента в условиях его контакта с внешней средой и площади контакта, наиболее содержательной представляется формула (2).
(2)
где:
ΔQ – скорость потока (диффузии) жидкости из пористого никелида титана, k – коэффициент диффузии, ΔТ – градиент температуры, μ- вязкость жидкости, р — плотность жидкости; Vo – исходный объем жидкости в пористом материале, S — площадь соприкосновения поверхностных пор образца с тканями, Δh – величина уровня жидкости в пористом материале, L – средняя протяженность пор образца, Р — пористость, g — ускорение свободного падения [7,8].
Изменение температурного параметра DТ (градиента температуры) в формуле (1) можно осуществлять с использованием ИК-излучения, которое позволяет регулировать скорость диффузии раствора инсулина в зависимости от мощности, длины волны излучения и времени действия.
ИК-излучение в диапазоне 780 – 1400 нм оказывает выраженное тепловое действие, в результате которого возбуждаются терморецепторы, заложенные в коже, слизистых оболочках, роговице, а также в центральной нервной системе – гипоталамусе и спинном мозге. Импульсы из терморецепторов поступают в центры терморегуляции (гипоталамус и частично спинной мозг). Возникающие вслед за этим терморегуляционные реакции приводят к расширению сосудов кожи, увеличению объема циркулирующей в них крови и усилению потоотделения. Нервно-рефлекторные реакции возникают также при воздействии инфракрасного излучения на рефлексогенные зоны кожных сегментов, непосредственно связанных с внутренними органами. В результате действия инфракрасного излучения на ткани образуются биологически активные вещества: брадикинин, каллидин и др., играющие важную роль в гуморальной регуляции местного и общего кровотока. Так, брадикинин обладает сильным сосудорасширяющим действием, которое наблюдается не только на месте облучения, но и в отдаленных участках тела.
При облучении инфракрасными лучами разработанным аппаратом (рис.2), в малых и средних дозах усиливаются процессы метаболизма, ускоряются процессы размножения клеток и ферментативные реакции, стимулирующие процессы регенерации и др.
Для приведения аппарата в рабочее состояние осуществляют: зарядку аккумулятора, насыщают пористый рабочий элемент (пластину из пористого никелида титана раствором инсулина). Далее прикладывают аппарат со стороны пористой пластины к коже и закрепляют его, после чего включают питание светоизлучающих ИК диодов. Длительность процедуры составляет 30 — 120 минут.

Рис. 2. Вид аппарата для безыгольной доставки инсулина: а – аппарат в сборке; б – аппарат в использовании
Аппарат закрепляют преимущественно в области локтевого и лучезапястного сустава. Выбор времени процедуры от 30 до 120 минут определен из результатов изменения уровня гликемии крови. Установлено, что гликемия монотонно снижается в течение первых 30 минут, с постепенным замедлением в течение следующих 30 минут и достигает стационарного уровня спустя 120 минут с начала процедуры (рис. 3).
На основании многочисленных наблюдений сделан вывод, что значимый эффект наступает не ранее, чем за 30 минут, а максимальный — не позднее 120 минут, что и послужило обоснованием для выбора интервала времени воздействия.
Основным физическим фактором, стимулирующим диффузию раствора инсулина в подкожные слои, является термофорез. Сопутствующий поверхностный нагрев кожи в контакте с увлажненной поверхностью пористой пластины аппарата, нагретой ИК излучением и пропитанной раствором инсулина, вызывает набухание кожи, что способствует стимуляции диффузии раствора инсулина в ткани.
Рис.3 Зависимость уровня гликемии от времени действия аппарата
Экспериментальные исследования показали, что для эффективной диффузии необходимо сочетание трёх факторов: первый — градиент температуры в области контакта препарата инсулина с кожей, второй — нагрев прилегающего кожного покрова, третий — прямое воздействие ИК излучения на внутренние слои кожи. Наличие этих факторов приводит к тому, что достигается направленная диффузия инсулина в организм, позволяющая получить положительный терапевтический эффект.
Под воздействием ИК излучения процесс переноса жидкости из пористого никелида титана на поверхность тканей резко ускоряется. Это связано с тем, что на влажной поверхности возникают тепловые потоки, вызванные градиентом температуры диффузионного пограничного слоя, при этом, под действием ИК излучения сквозь пористую структуру никелида титана, происходит расширение сосудов тканей, что приводит к ускорению процессов диффузии инсулина в прилежащих тканях. Набор инфракрасных диодов позволяет легко управлять потоком излучения (посредством выбора тока питания диодов). Уровень потока излучения далек от порога термомеханического повреждения рогового слоя кожи. Основной рабочий элемент аппарата — пористая пластина из никелида титана, может использоваться многократно, а для проведения очередной процедуры достаточно вновь пропитать ее раствором инсулина.
Таким образом, совокупное использование ИК излучения и пористо-проницаемого никелида титана – в виде пластин (TiNiMoFe), открывают перспективу разработки новых безыгольных аппаратов трансдермального введения инсулина в организм, пролонгированного действия.
Список литературы:
- Колуэлл, Дж. А. Новое в лечении и профилактике сахарного диабета. пер с англ. М.В. Шестаковой, М.Ш. Шамхаловой — М.: БИНОМ. Лаборатория знаний, 2007. — 288 с
- Питерс-Хармел Э. Сахарный диабет: диагностика и лечение. пер. с англ. под ред. Н. А. Федорова. — М.: Практика, 2008. — 496 с.
- Эндокринология. гл. ред. И. И. Дедов, Г. А. Мельниченко; Рос. ассоц. эндокринологов. — М.: ГЭОТАР-Медиа, 2008. — 290 с.
- Разработка и исследование трансдермальных систем доставки инсулина /Автореферат диссертации на соискание ученой степени кандидата биологических наук. Кузнецова Е. Г, М. 2005 — 32 с.
- Клиническая эндокринология. Руководство / Н.Т. Старкова. — издание 3-е, переработанное и дополненное. — Санкт-Петербург: 2002. — 576 стр.
- Медицинские материалы и имплантаты с памятью формы. В 14 Т, Медицинские материалы с памятью формы Том 1/ под ред. д.т.н., проф., засл. деят. науки Гюнтера В.Э. Томск 2011. — 534 с.
- Гюнтер С.В., Дамбаев Г.Ц., Старченков Д.Д., Вотяков В.Ф. Аппарат для доставки инсулина при лечении сахарного диабета с использованием инфракрасного излучения / Биосовместимые материалы и новые технологи в стоматологии. г. Красноярск 2012 – С. 196 – 200.
- Гюнтер С.В., Старченков Д.Д., Дамбаев Г.Ц. Разработка аппарата для лечения сахарного диабета с использованием ИК излучения и пористых материалов на основе никелида титана / Научно-практический журнал // Имплантаты с памятью формы. г.Томск:, 2012 – С. 5 – 11.[schema type=»book» name=»СПОСОБ БЕЗЫГОЛЬНОЙ ДОСТАВКИ ИНСУЛИНА ПРИ САХАРНОМ ДИАБЕТЕ » author=»Гюнтер Сергей Викторович, Дамбаев Георгий Цыренович» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-03-27″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_30.04.2015_4(13)» ebook=»yes» ]

