Введение
В настоящее время остро стоит проблема переработки вторичного белок-содержащего сырья, образующегося при производстве пищевых продуктов. Это послужило предпосылкой к изучению применения малоценных белков путём включения их в состав биодеградируемых и съедобных упаковочных материалов для пищевых продуктов. Для улучшения структурно-механических свойств белковых плёнок используются различные способы, в том числе сшивка полимерных цепей белка. Внутри- и межмолекулярные сшивки белков осуществляются как химическими агентами, так и путём биокатализа.
Одним из перспективных подходов для модификации структуры белковых компонентов упаковочного материала может служить использование ферментных препаратов, среди которых особое место занимает ТГ. ТГ (протеин-глутамин-γ-глутамилтрансфераза, (КФ 2.3.2.13), – распространённый в живой природе фермент, участвующий в жизненно важных биологических функциях [1]. ТГ катализирует реакции ацильногопереноса между γ-карбоксиамидной группой пептид-связанных остатков глутамина (ацильный донор) и различными первичными аминами, в том числе ε-аминогруппой остатков лизина (ацил-акцептор). Это сшивание может быть как внутри-, так и межмолекулярным, что в последнем случае приводит к увеличению молекулярной массы белковых молекул. Реакция протекает по схеме:
R1-Glu-CO-NH2 + H2N-R2 —ТГ__> R1-Glu-CO-NH-R2 + NH3.
Получаемые в промышленных масштабах препараты микробной ТГ применяют в технологиях переработки молока, мяса и других видов пищевого сырья [4]. Имеются сведения об использовании препаратов ТГ в технологии производства пищевых плёнок. В зависимости от используемого белка в составе пленок, а также наличия в них таких композитных материалов как, например, хитозан, катализ с участием ТГ приводил к различнымизменениям свойств исследуемых образцов. Однако практически во всех случаях наблюдалось повышение барьерных и механических характеристик плёнок, а также снижение их прозрачности. Так, в случае использования концентрата сывороточного белка, соевого изолята и их смесей в различных соотношениях, наблюдалось снижение проницаемостиплёнок как для кислорода, так и для водяного пара, однако удлинение образцов при разрыве в этих условиях увеличивалось [5]. Паропроницаемость модифицированного с помощью ТГ материала в некоторых случаях снижалась при использовании смеси желатина и казеина [3]. Снижение паропроницаемости, а также уплотнение полимерной структуры наблюдались и при обработке препаратом ТГ пленок, созданных на основе казеината натрия [2].
В настоящей работе проведено исследование влияния ТГ на прочность и эластичность материала для изготовления пищевых пленок на основе горохового белка.
Состав пленок
В работе использован состав плёночного материала, содержащий гороховый белок и глицерин. На предварительном этапе было апробировано несколько сочетаний компонентов, из которых впоследствии был отобран состав, обеспечивший наиболее высокие органолептические (прозрачность, прочность, эластичность) и механические характеристики материала. Фермент вносился в соответствии с технологическими рекомендациями компании-поставщика (1,075 ед./г белка). Поскольку белковые пленки обладают повышенной хрупкостью, для придания эластичности в их составы вносят пластификаторы, чаще всего полиолы. В настоящей работе в качестве такого пластификатора использовался глицерин. Состав исследуемого материала приведен в табл. 4.
Таблица 4
Состав исследуемого материала (в %)
| Компонент | Опыт | Контроль |
| Изолят горохового белка | 6 | 6 |
| Глицерин | 2 | 2 |
| ТГ, ед. | 6,45•10-2 | 0 |
| Вода | до 100 мл | |
Приготовление пленок
Изолят горохового белка тщательно растворяется в воде при температуре 35…40 оС, после чего выдерживается в термостате в течение 90 минут при 37 оС. После этого полученный раствор центрифугируется при 6000 об/мин, затем в полученный супернатант вносят глицерин в качестве пластификатора. Смесь тщательно перемешивается. После этого в опытные образцы вносится препарат мТГ, смесь перемешивается и помещается в термостат на 60 минут при 37 оС. Полученный раствор объемом 40 мл равномерно распределяется по поверхности, покрытой полиэтиленом, S = 17х17 см. Пленки сушатся при комнатной температуре и относительной влажности 50…60 % в течение 18 часов.
Исследования механических характеристик
Перед испытанием проводились измерения толщины пленки не менее чем в 10 точках общей площади с точностью до 1 мкм.
Исследования механических характеристик пленок, а именно разрывного усилия и удлинения при разрыве, выполняли на разрывной машине ИР 5071-01С (ООО «Точприбор-Сервис») в стандартных условиях:
– расстояние между зажимами 50 ± 1мм;
– размер образцов: ширина 15±1мм, длина 100…150мм;
– скорость движения подвижного зажима относительно неподвижного составила 250 мм/мин;
– предел измерения от 0 до 10 кг (100Н).
Испытания проводились в сухом состоянии образца, разрывное усилие определялось в продольном направлении образца. Разрывное усилие (Qmax) и удлинения при разрыве (Lmax) рассчитывалось по следующим формулам:
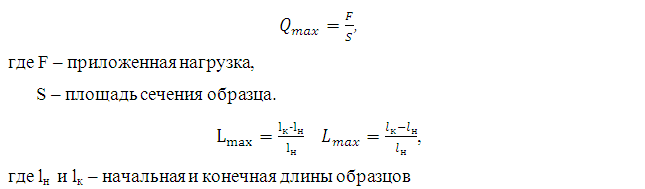
Результаты и их обсуждение
В ходе экспериментов были получены данные о разрывном усилии и удлинении при разрыве для пленок различных составов. Результаты измерения были сравнены, изменения механических характеристик в процентном соотношении приведены на рис. 1.
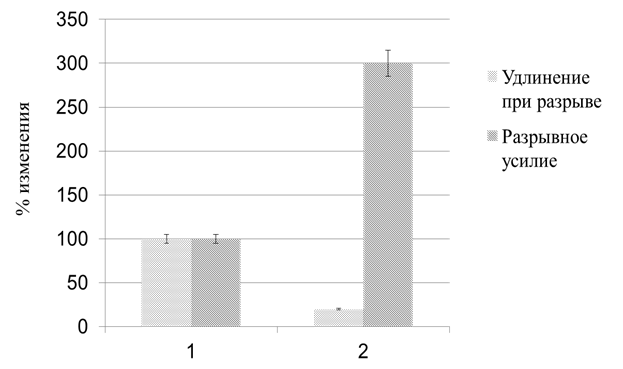
Рис. 1. Изменение механических характеристик желатиновых пленок, вызванных применением мТГ. 1 – контрольный образец; 2 – образец с мТГ
Результаты и их обсуждение
Наблюдается увеличение разрывного усилия, определяемого удлинением при разрыве в случаях применения фермента, наряду со снижением эластичности. На наш взгляд, данные изменения происходят как раз из-за образования сшивок между полимерными цепями белка, вследствие чего их подвижность относительно друг друга внутри полимерной сетки снижется, отсюда происходит падение эластичности и увеличение прочности.
Литература
- 1. Шлейкин А.Г., Данилов Н.П. Эволюционно-биологические особенности трансглутаминазы. Структура, физиологические функции, применение //Журнал эволюционной биохимии и физиологии, 2011. Т. 47, № 1, с. 3 – 14.
- Bruno M. et al. Engineering Properties of Edible Transglutaminase Cross-Linked Caseinate-Based Films // Food and Biopr. Tech., 2008. № 1 (4). pp. 393-404
- Chambi H., Grosso C. Edible films produced with gelatin and casein cross-linked with transglutaminase // J. Food Res. Int., 2006. № 39 (4). pp. 458-466
- Shleikin A.G., Krasnikova L.V., Danilov N.P. Substrate specificity of transglutaminase. Influence of transglutaminase on milk whey proteins cross-linking. In: Food technology operations. New Vistas. Мonography, ed. W. Kopec, M. Korzeniowska, Wroclaw, 2009, 317 p.
- Su G. et al. Formation of Edible Soybean Films //Food Technol. Biotechnol, 2007. № 45 (4) p. 381–388[schema type=»book» name=»ИССЛЕДОВАНИЕ ВЛИЯНИЯ ТРАНГЛУТАМИНАЗЫ НА МЕХАНИЧЕСКИЕ ХАРАКТЕРИСТИКИ БИОДЕГРАДИРУЕМОГО СЪЕДОБНОГО ПОЛИМЕРНОГО ПОКРЫТИЯ » description=»В работе исследовано влияние микробной трансглутаминазы (ТГ) на механические свойства (разрывное усилие и удлинение при разрыве) гороховых плёнок. Установлено, что внесение в рецептуру образцов исследуемого материала препарата ТГ увеличивает их прочность. Одновременно выявлено снижение эластичности пленок, полученных из материала, модифицированного с помощью ТГ.» author=»Шаталова Александрина Сергеевна, Шаталов Иван Сергеевич, Шлейкин Александр Герасимович, Бурова Татьяна Евгеньевна» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-01-05″ edition=»euroasia-science.ru_29-30.12.2015_12(21)» ebook=»yes» ]

