Известно, что своевременная и эффективная эмпирическая антибактериальная терапия хирургического сепсиса позволяет в 1,5 — 2 раза снизить летальность и предотвратить развитие септического шока у пациентов [1]. Поэтому изучение структуры и динамики антибиотикорезистентности микроорганизмов, выделяемых при микробиологическом исследовании материалов, полученных от септических больных, является актуальным.
Нами проведен ретроспективный анализ 363 историй болезни пациентов с хирургическими инфекциями, госпитализированными в «МУЗ городская клиническая больница» (корпус 1 и 3) г. Благовещенска и ГАУЗ АО «Амурская областная клиническая больница» с 1985 по 1996 гг. и с 1997 по 2014 гг., получавших лечение в хирургическом, урологическом и реанимационном отделениях, а также архивных материалов бактериологической лаборатории.
В анализ включены верифицированные во время операции и подтвержденные микробиологическими методами хирургические инфекции, соответствующие диагностическим критериям сепсиса [3,4].
Нами была выделена группа пациентов с хирургическим сепсисом (ХС), внутри которой изучались причины и локализация его возникновения, с учетом тяжести септического процесса, особенностей бактериального компонента и его антибиотикорезистентности, а также времени начала антибактериальной терапии, схем ее проведения, общей продолжительности. Из исследования были исключены случаи местного или распространенного перитонита, если очаг внутрибрюшной инфекции был ликвидирован в ходе первой операции у пациентов, течение заболевания которых не соответствовало критериям диагностики сепсиса.
В ходе анализа микробиологическому исследованию подвергались: перитонеальный экссудат, желчь (пузырная и протоковая), отделяемое по дренажам, кровь, раневое отделяемое, моча, ткани и др. Посев материала производился на чашки с 5% кровяным агаром, ЖСА, агаром Эндо и Сабуро. Для выделения гемокультуры использовали двойную среду. Выявление облигатных анаэробов проводилось на среде Вильсона-Блера и агаре Цейслера. Протоковую желчь засевали при разведении 1:10, 1:100, 1:1000 в посевной дозе 0,1 мл. Инкубацию проводили при температуре 37°С в течение 24-48 часов, с последующим подсчетом числа колоний и определением титра выделенных микроорганизмов в КОЕ/г(мл). Идентификацию микроорганизмов осуществляли с учетом данных микроскопии, культуральных свойств, оксидазной и каталазной активности, а также общепринятых биохимических тестов. Антибактериальную чувствительность микроорганизмов изучали с помощью имеющихся антибактериальных дисков и уровнем подавления роста микробных колоний.
Статистическая обработка полученных результатов исследования проводилась с использованием программы «Statistica 6.0 for Windows».
Основными нозологическими причинами абдоминальной хирургической инфекции явились: инфицированные формы деструктивного панкреатита (48 случаев), перфоративные язвы желудка и двенадцатиперстной кишки (30 случаев), острый аппендицит (20 случаев), ишемия кишечника вследствие кишечной непроходимости (24 случаев), деструктивный холецистит (22 случаев), несостоятельность ХДА (8 случая), желчеистечение в свободную брюшную полость (32 случаев), острый гнойный обтурационный холангит (119 случаев); причинами мочевой инфекции — острый пиелонефрит, хронический пиелонефрит, мочекаменная болезнь (МКБ), доброкачественная гиперплазия предстательной железы (ДГПЖ) 2-3 стадии, больные с нефростомой и (или) эпицистостомой (60 человек).
С 1985 года значительно изменилось соотношение грамположительных и грамотрицательных микроорганизмов. По результатам микробиологического исследования раневого материала с 1985 по 1996 гг. в качестве этиологического фактора грамотрицательные микроорганизмы преобладали только при интестинальной форме абдоминального сепсиса и осложненной мочевой инфекции (Еscherichia coli — 62,5%, Pseudomonas aeruginosa — 24,8%). К 1997 году в этиологической структуре хирургического сепсиса частота выявления грамотрицательных микроорганизмов возросла. В 2008 г. отмечено почти равное соотношение частоты выявления грамположительной и грамотрицательной флоры. С 2009 по 2014гг. зарегистрировано увеличение этиологической значимости грамотрицательных микроорганизмов. Доля грамотрицательных микроорганизмов возросла за счет увеличения частоты выделения из раневого содержимого и других биологических жидкостей Pseudomonas aeruginosa, которая заняла 2 место в структуре возбудителей после Еscherichia coli, бактерий Proteus spp. с 5,5% в период до 2004 года, до 16,8% и более к 2014 году, а также частоты обнаружения грибов рода Candida до 6%.
Рисунок 1.
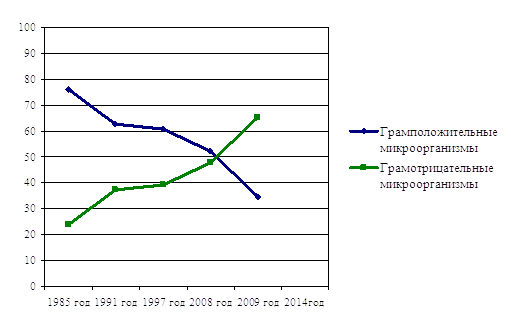
Динамика изменений микробного пейзажа и соотношение грамотрицательных и грамположительных микроорганизмов, выделенных из биологических жидкостей больных хирургическим сепсисом. Отмечается рост грамотрицательной и снижение доли грамположительной микрофлоры.
Отмечено увеличение числа микст – инфекций: в период с 1985 по 2000 гг. частота их выделения варьировала от 1,7 до 2,5%, к 2007 г. возросла до 4,6% случаев и в 2014 г. составила 16,1%. Чаще обнаруживались ассоциации Е.сoli с Staphylococcus aureus — 7,7%.
В посевах отделяемого из брюшной полости, полученного при первой операции, доминировала также грамотрицательная флора (Е.сoli — 34,5%, Proteus spp.(в основном vulgaris, mirabilis) -16,5%). При повторных операциях в посевах из брюшной полости зарегистрирован преимущественный рост Pseudomоnas aeruginosa (37,2%), Klebsiella pneumoniae (26,3%), Staphylococcus aureus (26,5%).
Бактериологическое исследование протоковой желчи, полученной интраоперационно и эндоскопически, выявило наличие бактериохолии у 92,7% обследованных больных. Наиболее часто выявляли Е.coli, Pseudomоnas aeruginosa, Klebsiella pneumoniae в виде монокультуры (20,2%), либо в виде микст — инфекции (73,8%) чаще всего в сочетании с Staphylococcus aureus. Содержание бактерий варьировало от 1,8х103 до 1,27х108 КОЕ/г.
Наибольшая бактериальная обсеменённость и разнообразие микробного пейзажа обнаружены у больных с желчнокаменной болезнью, осложненной холедохолитиазом, острым гнойным обтурационным холангитом, механической желтухой и тяжелым билиарным сепсисом (60 случаев). Микрофлора протоковой желчи практически всегда соответствовала пузырной желчи, монокультуры были выделены всего в 18,0% случаев. Анаэробная флора была обнаружена в 1 случае (Clostridium perfringens) у больной флегмонозным калькулезным холециститом, осложненным холедохолитиазом с рубцовым папиллостенозом и гнойным обтурационным холангитом. Наиболее частыми представителями бактериальной микрофлоры желчи у больных тяжелым билиарным сепсисом были (как и у других больных с абдоминальным сепсисом) грамотрицательные бактерии: Escherichia сoli, Pseudomоnas aeruginosa, Klebsiella pneumoniae. Аналогичные результаты получены у больных с мочевой инфекцией. Монокультуры были выделены в 21,0% случаев. Ассоциации Е.сoli с Pseudomоnas aeruginosa – 10%, с грибами рода Candida — 6.8%, Klebsiella – 7%. Данный микробиологический пейзаж выявлялся в моче у больных преимущественно с мочекаменной болезнью (коралловидным нефролитиазом), нарушениями уродинамики верхних и нижних мочевых путей, после инструментальных и оперативных вмешательств на мочевой системе, особенно при длительном дренировании мочевой системы.
При посевах крови на стерильность результаты были положительны у 28% больных, наиболее часто идентифицирована грамотрицательная флора: Escherichia coli (28,6%), Pseudominas aeruginosa (25%), Klebsiella pneumoniae (14,0%). Во всех случаях лечение проводилось по всем правилам гнойной хирургии [8,9,10].
Нами были проанализированы антибиотикограммы выделенных возбудителей в 1997 г. и 2014г. Чувствительность изучалась у штаммов микрофлоры с приготовлением инокулюма к отдельным антибактериальным препаратам, применявшимся в отделении для лечения внебольничных и внутрибольничных гнойно-септических инфекций. Значительная часть штаммов была устойчива к большинству применяемых антибиотиков, что отражает общую тенденцию в отделениях гнойной хирургии и урологии [6].
По результатам анализа выявлено, что наибольшую полирезистентность показали грамотрицательные микроорганизмы: Escherichia coli, Pseudomоnas aeruginosa и Klebsiella pneumoniae. Полирезистентность штаммов Е. сoli возросла с 73,0% в 1997 г. до 89,6% в 2014 г., а Ps. аeruginosa с 80,4% до 87,0% соответственно. Устойчивость изученных штаммов распространялась на применяемые ранее антибактериальные препараты: ампициллин, оксациллин, гентамицин, цефазолин. В связи с чем, с 2009 года данные препараты были исключены из применения у септических больных.
В последние десятилетия отмечены значительные изменения антибиотикорезистентности и у грамположительных микроорганизмов. В 2004 году стафилококки и энтерококки были высоко чувствительны к ванкомицину, карбапенемам и амикацину, при этом отмечена высокая резистентность стафилококков к левомицетину. С 2009 г. отмечено повышение устойчивости стафилококков к цефалоспоринам, фторхинолонам (особенно ципрофлоксацину), амикацину, эритромицину. Максимальная чувствительность сохранялась только к препаратам группы карбапенемов. К цефалоспоринам III-IV поколения оказались чувствительны 70,3% выделенных штаммов стафилококков. В отношении стрептококков (Streptococcus haemolyticus) также наиболее эффективными оказались цефалоспорины III-IV поколения, тогда как к ампицилину, ципрофлоксацину, эритромицину они проявляли высокую резистентность. Препаратами выбора для этой группы стали карбапенемы и фторхинолоны (кроме ципрофлоксацина), к ним выявлена чувствительность у 86,0% выделенных штаммов.
Наиболее эффективными в настоящее время в отношении псевдомонад оказались цефалоспорины III-IV поколения и карбапенемы. Энтеробактерии чувствительны к цефалоспоринам III-IV поколения, карбапенемам и амикацину, высокая резистентность энтеробактерий зарегистрирована к цефалоспоринам I-II поколения и гентамицину.
Таким образом, бактериальный пейзаж в этиологии хирургического сепсиса в современный период характеризуется превосходством грамотрицательных бактерий, увеличением частоты микробных ассоциаций и чувствительностью возбудителей, в основном, к препаратам группы карбапенемов и цефалоспоринов III — IV поколения.
Список литературы:
- Галкин, Д.В. Оптимизация антибактериальной терапии сепсиса в многопрофильных стационарах: автореф. дис…. канд. мед. наук / Д.В. Галкин. — Смоленск, 2005. — 26 с.
- Гостищев, В.К. — Инфекции в хирургии. Руководство для врачей / В.К. Гостищев. — Издательская группа «ГЭОТАР — Медицина», 2007. — 761 с.
- Конференция «Стандарты диагностики и лечения в гнойной хирургии». Раздел 3. «Стандарты классификации, диагностики и лечения хирургического сепсиса» // Хирургия. — 2002. — №8. С. 67 – 68.
- Молчанов, И.В. Сепсис 2008: клинические рекомендации / И.В. Молчанов, Т.К. Болякина, А.В. Власенко // Клиническая анестезиология и реаниматология. — 2008. — Т.5, №2. — С. 17 – 23.
- О санитарно – эпидемиологической обстановке в Российской Федерации в 2007 году: Государственный доклад. – М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2008. – 397 с.
- Сажин, В.П. Ранняя диагностика внутрибольничной инфекции на основе мониторинга раневой микрофлоры в отделении гнойной хирургии / В.П. Сажин, А.Л. Авдовенко, Н.Г. Бодрова // Хирургия. — 2007. — № 10. — С. 32-35.
- B.H. Горленко, С.И. Лежнин, К.А. Ковтунов и др. Роль хронического простатита в развитии осложнений после ТУР//Всероссийский пленум урологов. Саратов-2003// Сборник тезисов
- Гельфанд Б.Р., Бурневич С.З., Гельфанд Е.Б. Антибактериальная терапия абдоминального сепсиса // Вестн. интенс. тер.: Сб. Антибактериальная терапия. — М., 2008. — 32-38.
- Перити П., Маццеи Т. Новые критерии для выбора правильного антимикробного лечения тяжелого сепсиса и септического шока // Int. Дж Antimicrob. — 2010. — 12; 2. — 97-106.
- Bone R.C., Балк R.A.B., Серра F.B. и другие. Американский колледж пульмонологов / Общество Critical Care Medicine согласительной конференции: Определения сепсиса и полиорганной недостаточности и основных принципов для использования инновационных методов терапии при сепсисе // Crit. Care Med. — 2009. — 20; 6. — 864-874[schema type=»book» name=»Устойчивость патогенной микрофлоры к антибактериальной терапии у пациентов с хирургическим сепсисом» description=»Цель. Изучить в динамике антибиотикорезистентность микрофлоры биологических жидкостей у больных хирургическим сепсисом. Метод. Проведен ретроспективный анализ 363 историй болезни пациентов с хирургическими инфекциями, госпитализированными в «МУЗ городская клиническая больница» (корпус 1 и 3) г. Благовещенска и Амурской Областной клинической больницы за период 1985 по 1996 гг. и 1997 по 2014 гг., а также архивных материалов бактериологических лабораторий. Результат. Изучен спектр микроорганизмов, выделяемых при микробиологическом исследовании материала от хирургических и урологических больных. Выявлена этиологическая роль грамотрицательных бактерий у больных с хирургическим сепсисом. Возросла роль микробных ассоциаций (кишечной палочки с золотистым стафилококком, с эпидермальным стафилококком и бактериями рода Proteus); увеличилась доля синегнойной палочки в 1,4 раза и грибов рода Candida в 1,6 раза. Возросло число микст — инфекции до 16,9% случаев. Выводы. По результатам анализа антибиотикограмм выделенных возбудителей сделан вывод о применении для эмпирической антибактериальной терапии хирургического сепсиса препаратов группы карбапенемов (меропенем, имипенем, дорипенем) и цефалоспоринов III — IV поколения (цефоперазон, цефепим, цефпиром).» author=»Гребенюк В.В., Ковтунов К.А., Назаров А.А., Чумаченко И.В.» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-01-30″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_31.10.15_10(19)» ebook=»yes» ]

