Использование трансмиокардиальной реваскуляризации (ТМЛР) по идее основоположников метода предполагало перфорацию миокарда с целью достижения прямого кровотока из левого желудочка (ЛЖ) в миокард. Однако, несмотря на эффективность ТМЛР[1-3], сегодня большинством исследователей идея проходимых каналов отвергнута [4,6,8].Отсюда совершенно очевидно, что за эффективность ТМЛР могут отвечать иные механизмы, инициированные в процессе перфорации миокарда. В работе проанализированы различные аспекты взаимодействия лазерного излучения и миокарда и изучено влияние различных форм этого взаимодействия на клинические исходы ТМЛР.
Материал. В работе приведены материалы, поясняющие изменения в миокарде на основе эффекта взаимодействия лазерного излучения с миокардом (с моделью миокарда) и проанализированы различия, обусловленные физическими характеристиками лазеров [СО2, Ho:YAG, Er:YAG, Nd:YAG( с длиной волны 1,44мкм и 1,06мкм), полупроводникового и XeCl ]. Кроме того, мы попытались оценить форму воздействия лазерного излучения на биоткани, визуальные проявления тепловых и механических эффектов взаимодействия лазерного излучения и модели миокарда и изучили динамику изменений в лазерных каналах после лазерного воздействия с помощью различных лазеров в течение 24 после операции и в динамике по срокам исследования от 0 до 15 дней и более.
В работе использованы материалы гистологического исследования сердец пациентов умерших после ТМЛР(28 препаратов сердец) и по данным эксперимента (на мини-свиньях – 6 экспериментов). Для изучения представленных эффектов нами использованы :
А) Данные гистологического исследования.
Б) Желатиновые модели.
В) Биомодели на основе экспериментов с мини-свиньями .
Кроме того, в работе представлены иллюстрации из экспериментов, проведенных ранее с помощью других низкоэнергетических лазеров (Nd:YAG c длиной волны 1,06мкм, Er:YAG и полупроводникового лазера)
Результаты.
Процесс формирования глубокого канала (перфорации ткани) под действием высокоинтенсивного лазерного излучения (ЛИ) сопровождается разрушением ткани в области воздействия излучения, тепловым и ударно-волновым (механическим) повреждением окружающих канал тканей. Схема современных представлений о биофизике взаимодействия лазерного излучения и биоткани приведена на рис 1а.
Согласно данным, приведенным на рисунке лазерное излучение взаимодействует с тканью через термическое повреждение (Т0) и ударную волну (Р). При этом полагают, что при воздействии на ткань То до 65°С формируется зона карбонизации (рис.1а). Далее вокруг этой зоны (под воздействием Т 37°С) формируется зона теплового некроза (рис.1а). Дальше от канала под воздействием акустического удара может сформироваться зона механической деструкции (рис.1а). Каково распространение этих зон, различаются ли они при различных лазерах и каков креативный, либо негативный вклад этих зон в успех ТМЛР только из законов биофизики установить невозможно.
Визуальные проявления взаимодействия лазерного излучения и биоткани (тепловых и механических эффектов) различаются .
При попадании лазерного излучения на поверхность миокарда и в его толщу, ширина зоны термического повреждения в этих областях многократно возрастает. Это может быть следствием конвективного теплопереноса на поверхность миокарда и в просвет канала При этом при воздействии одних лазеров (СО2) вход в канал имеет форму эллипса , окруженного зоной термического повреждения, при воздействии других(Er:YAG)- иррегулярную, “рванную” форму. Различается по форме и сам канал. В одних случаях он гладкостенен(СО2 лазер – рис.2а,б), в других — имеет зигзагообразную форму(Er:YAG лазер, рис.2в), в третьих – заметные разрывы в виде трещин в миокарде (рис.2г). На рис.3 приведены данные гистологического исследования препаратов сердец после ТМЛР, выполненной с помощью различных лазеров. Как на продольных, так и на поперечных срезах визуализируются трещины в миокарде в направлении, перпендикулярном оси канала. Как видно из рисунка, отроги могут распространяться вглубь миокарда на расстояние, превышающее просвет канала.
Независимо от типа использованного лазера, все каналы, сформированные в процессе перфорирования миокарда, характеризуются термическим повреждением, различающегося по толщине (рис.4,5).При этом соотношение диаметра просвета канала к толщине термически поврежденного миокарда ниже при применении СО2 лазера и выше при применении низкоэнергетических лазеров (исключение составляет гольмиевый лазер, при котором толщина термического повреждения миокарда выше, чем при СО2 лазере) .И, наоборот, — толщина поврежденного миокарда (стенки канала) при СО2 лазере выше (рис.5а) чем при диодном лазере (рис.5в).На фотографиях с желатиновыми моделями термическое повреждение стенок канала визуализируется в виде неравномерной белесоватой «окантовки» канала (зоны коагуляции) с «факелами», направленными вдоль волокон мышцы. (на рис.4) В нашем исследовании просвет (диаметр) канала при длительности импульса 50 мс для СО2 лазера составил 500-1200 мкм, при ширине зоны термического некроза -1000-1200 мкм(соотнощение 1:1).Для Nd:YAG лазера при длине волны 1,44мкм диаметр канала составлял 300-350мкм при ширине зоны термического поражения в среднем 50-150 мкм (соотношение 2:1).Иными словами, при применении СО2 лазера ширина канала и зоны термического поражения были равными. Ширина термического поражения при неодимовом лазере была меньше просвета канала и, что самое главное, — значительно меньше (в 10 раз!) ширины зоны термического повреждения при СО2 лазере. Таким образом, основная находка при использовании инфракрасных лазеров – выраженное термическое повреждение миокардаОсновным эффектом воздействия импульсов низкоэнергетических лазеров (Er:YAG, Nd:YAG и XeCl) является механическое повреждение окружающих канал тканей, выражающееся в разрывах стенок канала .
Характер и степень повреждения миокарда при использовании различных лазеров сильно разнятся. При использовании СО2 лазера определяется 2-3 слоя некротизированных кардиомиоцитов и контрактурное повреждение 2-3 слоев миокарда, окружающих канал.
При использовании низкоэнергетических лазеров под воздействием ударной волны и “взрывов”, сопровождающих перфорацию миокарда отмечается массивное поражение миокарда с формированием боковых трещин и выраженного повреждения окружающего канал миокарда (рис.3 и 4). При этом при применении низкоэнергетических лазеров перпендикулярное к оси канала механическое повреждение миокарда может на порядок превышать как собственно диаметр канала, так и значения термически поврежденного миокарда. Так, при применении СО2 лазера соотношение параллельного и перпендикулярного (оси канала) повреждений миокарда не превышает 1:1, а при применении низкоэнергетических лазеров может приближаться к 1:5.
Таким образом, для исследованных тканей характерна асимметричная картина термомеханических повреждений вдоль и поперек мышечных волокон. При этом ЛИ инфракрасного спектра (СО2) характеризуется значительным термическим повреждением миокарда, а ультрафиолетового (и близкого к инфракрасному) спектра (Nd:YAG) – выраженным механическим повреждением миокарда.
Оценке проходимости каналов посвящено значительное число исследований. тепловых и механических эффектов лазерного воздействия на модели в течение первых 24ч. после создания каналов представлены на рис.6а.
Как следует из визуальных проявлений представллазерного воздействия на биоткань ( миокард) , уже в течение первых 6 часов после лазерного воздействия канал фрагментируется и закрывается на протяжении и через 24ч полностью «схлопывается». Как свидетельствуют данные гистологических исследований в эксперименте канал уже через 2 часа после операции заполнен массами фибрина и лейкоцитов ,а через 2 недели остатки канала полностью облитерированы
Обсуждение.
Как свидетельтвуют данные, представленные выше, каналы закрываются вскоре после их формирования . Поскольку теория функционирующих каналов отвергнута, очевидно за эффективность ТМЛР отвечают другие механизмы, формирующиеся в процессе ТМЛР.
Как свидетельствуют представленные материалы в результате воздействия ЛИ на сердечную мышцу, происходит взрывное испарение воды(вапоризация) и удаление фрагментов клеточных и тканевых структур(аблация) за пределы ткани, в результате чего формируется так называемая зона аблации (зона разрушения, канал). Как следует из результатов исследования гистологических препаратов миокарда в результате воздействия ЛИ, формируются 2 зоны поражения: термическая и механическая(рис.1б).
Степень и характер повреждений определяются только типом использованного лазера и его физическими харктеристиками. Из инфракрасных лазеров Но:YAG лазер вызывает большее термического повреждение, чем СО2 лазер [5]. Клинически при применении СО2 лазера в нашем Центре выявлено достоверное улучшение перфузии в зонах лазерного воздействия как при изолированных вмешательствах, так и при выполнении сочетанных операций .
Но при применении низкоэнергетических лазеров улучшение перфузии в литературе не подтверждено. Это при том, что улучшение неоваскуляризации наиболее выражено при применении гольмиевого лазера.Объяснение этому факту очевидно кроется в значительном повреждении (и термическом, и механическом) миокарда при применении гольмиевого лазера. Так, как следует из подсчетов, проведенных К Kadipasaoglu и соавт.[7] при значительном комплексном повреждении миокарда при гольмиевом лазере (и термическом, и механическом), на сопоставимое с СО2 лазером улучшение перфузии можно рассчитывать если увеличение неоваскуляризации при нем будет в 6 раз(!) превышать увеличение неоваскуляризации при СО2 лазере.
Взрывы пара при низкоэнергетических лазерах формируют акустические волны, которые распространяются вдоль мышечных волокон и кроме собственно термокоагуляции((в отличие от СО2 лазера) вызывают обширную структурную травму миокарда. Несмотря на очень низкую энергию и очень короткую длительность импульса XeCl лазер приводит к очень высоким уровням пиковой мощности и поэтому характеризуется “эффектом попкорна”, со взрывами, сопровождающими практически каждую перфорацию миокарда. Сказанное в полной мере касается и других низкоэнергетических лазеров . СО2 лазер с энергией импульса 20-30 J/пульс и длительностью импульса 25-45мсек не вызывает взрывной аблации и при его использовании протяженность структурного повреждения миокарда весьма ограничена . При использовании низкоэнергетических лазеров на кончике аппликатора формируются пузырьки пара и удаляемых остатков разрушенного материала, а их взрыв ведет к значительному разрушению миокарда в перпендикулярном к каналу направлении . В соответствии с размерами трещин, появляющихся в результате взрыва, различается объем повреждения и невосстановимого миокарда.СО2 лазер практически не формирует боковые отроги(трещины миокарда) и тем самым предотвращает безвозмездную утерю сократительного элемента. И, наоборот, фиброз миокарда после применения низкоэнергетических лазеров значителен, и поэтому, возможность полноценного восстановления функции миокарда в этих случаях сомнительна. Кроме того, поскольку провоцирование ангиогенеза в основном определяется термическим повреждением миокарда , при использовании лазеров с низкими показателями термического повреждения рассчитывать на инициацию значительного роста неососудов очевидно не следует.
- S. Estvold и соавт. [4], сравнивавшие в эксперименте результаты применения СО2 и Ho:YAG лазеров нашли, что при применении Ho:YAG лазера имеет место достоверно больший индекс фиброза миокарда, обусловленный механическим повреждением миокарда вокруг канала. Это позволяет объяснить отсутствие улучшения сократимости миокарда после применения Ho:YAG лазера
Литература к статье И.И. Беришвили и соавт.:
Основы биофизики и гистопатология лазер-индуцированных повреждений миокарда при трансмиокардиальной лазерной реваскуляризации.
- Bridges CR, Horvath KA, Nugent B, et al., “Society of Thoracic Surgeons Practice Guideline: Transmyocardial Laser Revascularization”, Ann Thorac Surg (2004);77: pp. 1484–1502.
- Cheng D, Diegleler A, Allen K, et al. Transmyocardial laser revascularization: a meta-analysis and systematic review of controlled trials. Innovations. 2006;1:295–313.
- Diegeler A, Cheng D., Allen K.,Weisel R.,Lutter G.,Sartori M., Asai T.,Aaberge L., Horvath K., Martin J. Тransmyocardial Laser RevascularIzation: A Consensus Statement of the International Society of Minimally InvasIve Cardiothoracic Surgery (ISMICS) 2006 Innovations 2006; l: 314 — 322
- Estvold SK, Mordini F, Horvath K.A., Does Laser Type Impact Myocardial Function Following Transmyocardial Laser Revascularization? Laser Surg Med 2010,V. 42,I.10: 746-751
- А.Hughes, G. C., Kypson, A. P., St Louis, J. D. et al, Improved
perfusion and contractile reserve after transmyocardial laser
revascularization in a model of hibernating myocardium. Annals
of Thoracic Surgery, 1999, 67, 1714-1720. - Jansen E.D., Whittaker P. Laser-tissue interaction. In. Bridges C.R., Horvath K.A.,Chiu R.C. eds. Myocardial laser revascularization Ch 2. Blackwell, Futura, 2006,pp.16-30
- Kadipasaoglu K.A.,Sartori M., MasaiT.,Cihan H.B., Clubb H.B., Conger J.L.,Frazier O.H.Intraoperative arrhythmias and tissue damage during transmyocardial laser revascularization. Ann thorac surg 1999,V.67,I.2: 423-431.
- Whittaker P.,Jansen E.D. The biology of laser-tissue interactions: in vivo comparisions and consequences. In Bridges C.R., Horvath K.A.,Chiu R.C. eds. Myocardial laser revascularization Ch 3. Blackwell, Futura, 2006,pp.31-47
Рисунки к статье И.И. Беришвили и соавт.:
Основы биофизики и гистопатология лазер-индуцированных повреждений миокарда при трансмиокардиальной лазерной реваскуляризации.
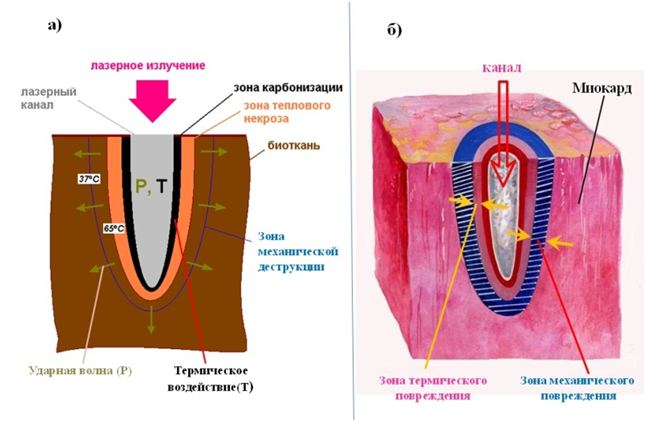
Рис. 1. Взаимодействие лазерного излучения с биотканью
А)теоретические представления о биофизике взаимодействия лазерного излучения и биоткани Б)схема изменений в миокарде по данным гистопатологического исследования
Обозначения: зелеными стрелками на фрагменте А показано распространение акустических волн, синей линией ограниченавидимая зона механической деструкции ткани. Желтыми стрелками на фрагменте Б ограничены реально определяемые зоны термического и механического повреждений миокарда.

Рис.2 Трещины в миокарде в результате воздействия ударных волн. Микрофотографии Гемтаоксилин и эозин. Ув. ок. 10 об. 10[schema type=»book» name=»Основы биофизики и гистопатология лазер-индуцированных повреждений миокарда при трансмиокардиальной лазерной реваскуляризации» author=»Беришвили Илья Иосифович, Артюхина Тамара Владимировна, Семенов Марат Хызырович» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-05-22″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_ 30.01.2015_01(10)» ebook=»yes» ]

