Хроническая и рецидивирующая бронхолегочная патология стабильно занимает третье место в структуре заболеваемости подростков и нередко приводит их к инвалидности. Ухудшение экологической ситуации и техногенная нагрузка, климатические условия, а также приверженность подростков вредным привычкам, особенно табакокурению, играют заметую роль в увеличении распространенности хронических заболеваний органов дыхания [1].
При табакокурении среди подростков легочная патология выявляется в 2,6 раза чаще, нарушения со стороны функции органов дыхания выявлены даже при малом (<5 лет) стаже курения [2].
В результате хронического воздействия табачного дыма формируется неуклонно прогрессирующая бронхиальная обструкция, ведущая к формированию хронической обструктивной болезни легких (ХОБЛ) [3].
ХОБЛ в основном болеют люди старше 40 лет – около 6 % мужчин и 3% женщин (у лиц старше 55 лет этот показатель достигает 10%). Однако, поскольку в течение 10-15 лет болезнь протекает бессимптомно, ее начало может приходиться на подростковый возраст [4] .
В основе патогенеза ХОБЛ лежит хроническое воспаление дыхательных путей, структурное ремоделирование стенки бронхов и разрушение альвеолярной стенки.
Получены многочисленные данные о том, что хронический, длительно протекающий воспалительный процесс приводит к необратимым морфологическим изменениям в виде резкого утолщения базальной мембраны с нарушением микроциркуляции и развитием склероза стенки бронхов. Глубокие трофические нарушения характеризуются гипертрофией гладких мышц, усиленным образованием новых сосудов, сопровождающимся застоем, гиперплазией и метаплазией бокаловидных эпителиальных клеток, увеличением подслизистых желез и отложением коллагена в lamina reticularis (уплотнение базальной мембраны) и, как следствие, перестройкой (ремоделированием) стенки бронхов.
В процессах ремоделирования дыхательных путей участвуют различные биологически активные вещества — факторы роста, цитокины, эндотелины, поддерживающие, кроме того, и процесс воспаления [5].
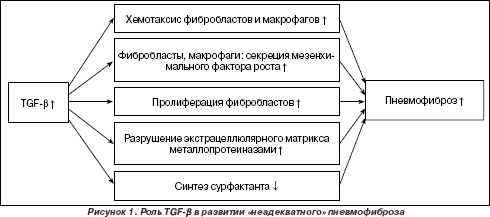
Трансформирующий фактор роста β (TGF-β) — мультифункциональный фактор роста, регулирующий процессы пролиферации, дифференциации и миграции клеток, а также ангиогенез и ремоделирование эндоплазматического ретикулума посредством влияния на синтез белков экстрацеллюлярного матрикса, прежде всего, коллагена I и III типов и фибронектина, а также протеогликанов, и снижает синтез протеиназ. Под действием факторов роста соединительной ткани TGF-β способствует превращению фибробластов в миофибробласты. Его рассматривают как один из основных факторов индукции фиброза в дыхательных путях и потенцирования апоптоза бронхиальных эпителиальных клеток. TGF-β индуцирует хемотаксис целого ряда клеток, в том числе макрофагов, Т-лимфоцитов[6].
Доказано, что табачный дым повышает секрецию TGF-β. В исследованиях Ryder M. I., Saghizaden M., Ding Y. (2002) проведенных in vitro, воздействие табачного дыма на мононуклеарные клетки периферической крови в течение 1-5 минут, вызывало повышение уровня TGF-β. Причем, уровень TGF-β был выше у курильщиков по сравнению с некурящими. Однако, Pons и соавт. (2006) установили, что у пациентов с ХОБЛ макрофаги продуцировали значительно меньше TGF-β, чем курильщиков с нормальной легочной функцией и некурящих, что, вероятно, соответствует уменьшению активности фибропластических процессов, уже приведших к развитию необратимых процессов [7, 8].
После инициации воспаления в норме происходит восстановление, при дисрегуляции репарации происходит прогрессирование «неадекватного» пневмофиброза (рис. 1). Наличие повторных воспалительных процессов с повреждением эпителиальной ткани в конечном счете истощает способность к реэпителизации, развивается неадекватный процесс заживления, ослабляется внеклеточный матрикс, происходит чрезмерное перемещение фибробластов в пораженные участки. В норме в эндотелии бронхов фактор не определяется, появление его во внеклеточном пространстве эндотелия является прогностическим критерием патологического фиброза. При обследовании взрослых с хроническими бронхитами определено, что TGF-β присущ полиморфизм, существуют генотипы, не предрасполагающие к фиброзу [9, 10]. Этим можно объяснить, что только четверть хронических курильщиков болеют ХОБЛ.
Поэтому целью данного исследования явилось определение экспрессии TGF-β в эндотелиальной ткани бронхов, ее корреляции с уровнем в сыворотке крови для определения новых, ранних, доступных в практической пульмонологии маркеров прогрессирования пневмофиброза, для выделения групп риска по развитию ХОБЛ среди курящих подростков и проведения ранней профилактики инвалидизации.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Обследовано 47 пациентов в возрасте 10–18 лет с хроническими (ХБ) и рецидивирующими бронхитами (РБ) в периоде клинической ремиссии с использованием рентгенографии, спирографии, компьютерной томографии, диагностической эндобронхоскопии, биохимического и цитохимического анализа крови, мочи. Исключались дети с сопутствующей хронической патологией других органов (например, гломерулонефритом, гепатитом), которая может сопровождаться фиброзом.
Материал для иммуноцитологического исследования получали при браш-биопсии слизистой бронхов во время диагностической бронхоскопии. Для иммуноцитологического исследования материал наносился эндоскопической щеткой на адгезивное стекло (Super Frost Plus) с последующей фиксацией соответственно принятым стандартам. В качестве первичных антител использовали β-фракцию TGF (регуляторный полипептид β-тип рецепторов, лиофилизат NCL-TGF-β, фирма NovoCastra). Параллельно у этих же детей методом иммуноферментного анализа определяли уровень сывороточного TGF-β. Использовали тест-системы DRG TGF-β1 ELISA (США). Показатели оптической плотности образцов измеряли на фотометре ELM-3000 фирмы DRG (США) и выражали в нанограммах на миллилитр. Статистическая обработка данных проводилась с использованием компьютерных программ Statgraf 2.1, Spida 5.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
При отборе детей в группы исследования учитывались основные диагностические критерии рецидивирующего и хронического бронхитов, отраженные в современной отечественной классификации заболеваний органов дыхания у детей. У всех детей были исключены врожденные пороки развития, муковисцидоз, бронхиальная астма, дефицит альфа-1-антитрипсина. Средний возраст в группе с РБ составил 11,5 ± 0,5 года, стаж болезни 5,3 ± 1,8 года. В группе с ХБ средний возраст — 17,2 ± 1,4 года, стаж болезни — 6,7 ± 1,9 года.
Цитологический анализ материала, полученного при браш-биопсии слизистой бронхов, дал возможность оценить качество бронхиального эпителия, наличие его дистрофии и метаплазии, активность и характер воспаления. Спектр цитологических нарушений достоверно отличался в группах детей с РБ и ХБ. При РБ в биоптате преобладали клетки цилиндрического и плоского эпителия с признаками пролиферации, нейтрофилы. При ХБ преобладали клетки плоского и цилиндрического эпителия с менее выраженными признаками пролиферации, лимфоциты, большинство эпителиальных клеток бронхов (> 80 %) имели признаки дистрофических процессов, что коррелировало с визуальной эндоскопической картиной (блестящая или «зеркальная» слизистая бронхов).
У четверти детей при иммуноцитологическом анализе был идентифицирован трансформирующий фактор роста TGF-β в эндотелиальной ткани бронхов. Само наличие данного фактора в эндотелии являлось серьезным прогностическим критерием развития «неадекватного» фиброза, что может приводить к необратимым ремоделирующим процессам в бронхах. Достоверного отличия по частоте выявляемости фактора среди больных с РБ и ХБ не было (p > 0,1). Интенсивность экспрессии TGF-β была более выражена у детей с РБ, что свидетельствовало об активности фиброзирующих процессов в бронхах без явных клинико-рентгенологических признаков хронического процесса. В группе детей с ХБ экспрессия данного маркера была суммарно слабее, что, вероятно, соответствует уменьшению активности фибропластических процессов, уже приведших к гисторемоделингу. Уровень TGF-β в крови детей, имеющих его положительную экспрессию в эндотелии бронхов, по иммуноцитохимическому анализу (n = 14 чел.) был достоверно выше, чем в группе детей (n = 33 чел.), у которых данный фактор не был идентифицирован (56,2 ± 6,6 и 33,1 ± 3,9 нг/мл; р < 0,01), а также в сравнении со здоровыми детьми (n =11; 24,2 ± 4,5 нг/мл, р < 0,01).
Была установлена сильная корреляционная связь (r=0,89, р<0,001) между положительным TGF-β в слизистой оболочке бронхов и отягощенной наследственностью по ХНЗЛ, причем как в группе с ХБ, так и в группе с РБ. Корреляционная связь TGF-β с табакокурением была недостоверной (р>0,05). Это подтверждает данные других исследователей об отсутствии влияния экзогенных факторов на TGF-β.
Таким образом, результаты проведенного исследования подтверждают диагностическую значимость трансформирующего фактора роста у подростков- курильщиков с РБ и ХБ для определения группы риска по развитию необратимых морфофункциональных изменений в легких. Полученные данные, вероятно, помогут в будущем улучшить качество ранней диагностики, хронизации бронхолегочного процесса в детском и подростковом возрасте, проводить первичную профилактику ХОБЛ взрослых.
Список литературы:
- Трунцова Е.С., Сагитова Г.Р., Хасьянов Э.А. Проблемы хронических заболеваний у подростков//Вестник современной клинической медицины. 2009. Том 2, вып.3. C. 37-39.
- Скачкова М.А., Никитина О.В., Чайникова И.Н. Курение как фактор риска формирования заболеваний органов дыхания у детей и подростков// Оренбургский медицинский вестник. 2015. Том III, №2. C. 35-38.
- Мокина Н.А. Оценка распространенности и статуса табакокурения среди студентов старших курсов медико-профилактического и лечебного факультетов СамГМУ// Саратовский научно-медицинский журнал. 2011. Том 7, №2. C. 497-501.
- Батаев Х., Дадаев М. Хронический обструктивный бронхит: патогенез, факторы формирования, фармакотерапия// Врач.2013. №11. с. 22-24.
- Чернышева О.Е. Маркеры ремоделирования дыхательных путей при бронхолегочных заболеваниях//Здоровье ребенка. 2014. № 7 (58). с. 80–83.
- Суркова Е.А., Кузубова Н.А., Сесь Т.П. Роль TGF-β в сыворотке крови и бронхоальвеолярном лаваже больных хронической обструктивной болезнью легких// Медицинская иммунология. 2008. Том 10, №1. с. 93-98.
- Ryder MI, Saghizadeh M. Effects of tobacco smoke on the secretion of interleukin-1beta, tumor necrosis factor-alpha, and transforming growth factor-beta from peripheral blood mononuclear cells// Oral Microbiol Immunol. 2002. Vol. 17. P. 331-336.
- Alessia Comandini, Paola Rogliani. Biomarkers of lung damage associated with tobacco smoke in induced sputum// Respiratory Medicine. 2009. Vol. 103, Issue 11. P.1592–1613.
- Bartram U., Speer C.P. The Role of Transforming Growth Factor b in Lung Development and Disease // Chest. 2004. Vol. 125. P. 754-765.
- Green F.H.Y. Overview of Pulmonary Fibrosis // Chest. 2002. Vol. 122. P. 334-339.[schema type=»book» name=»ЗНАЧЕНИЕ УРОВНЯ СЫВОРОТОЧНОГО ТРАНСФОРМИРУЮЩЕГО ФАКТОРА РОСТА В РЕМОДЕЛИРОВАНИИ БРОНХОВ У ПОДРОСТКОВ-КУРИЛЬЩИКОВ » description=»Цель. Определение значения сывороточного трансформирующего фактора роста в ремоделировании бронхов у подростков-курильщиков с рецидивирующими (РБ) и хроническими бронхитами (ХБ). Метод. Обследовано 47 пациентов в возрасте 10–18 лет с ХБ и рецидивирующими бронхитами РБ в периоде клинической ремиссии с использованием клинико-анамнестических данных, рентгенографии, спирографии, компьютерной томографии, диагностической эндобронхоскопии, биохимического и цитохимического анализа крови, мочи. У обследуемых детей в браш-биоптате слизистой оболочки бронхов иммуноцитохимическим методом определяли уровень TGF-β. Параллельно у этих же детей методом иммуноферментного анализа определяли уровень сывороточного TGF-β. Статистическая обработка данных проводилась с использованием компьютерных программ Statgraf 2.1, Spida 5. Результат. Средний возраст в группе с РБ составил 11,5 ± 0,5 года, стаж болезни 5,3 ± 1,8 года. В группе с ХБ средний возраст — 17,2 ± 1,4 года, стаж болезни — 6,7 ± 1,9 года. У четверти детей при иммуноцитологическом анализе был идентифицирован трансформирующий фактор роста TGF-β в эндотелиальной ткани бронхов. Достоверного отличия по частоте выявляемости фактора среди больных с РБ и ХБ не было (p > 0,1). Интенсивность экспрессии TGF-β была более выражена у детей с РБ, чем с ХБ. Уровень TGF-β в крови детей, имеющих его положительную экспрессию в эндотелии бронхов, по иммуноцитохимическому анализу был достоверно выше, чем в группе детей, у которых данный фактор не был идентифицирован, а также в сравнении со здоровыми детьми. Была установлена сильная корреляционная связь (r=0,89, р<0,001) между положительным TGF-β в слизистой оболочке бронхов и отягощенной наследственностью по ХНЗЛ. Корреляционная связь TGF-β с табакокурением была недостоверной (р>0,05). Выводы. Таким образом, результаты проведенного исследования подтверждают диагностическую значимость трансформирующего фактора роста у детей с РБ и ХБ для определения группы риска по развитию необратимых морфофункциональных изменений в легких. Полученные данные, вероятно, помогут в будущем улучшить качество ранней диагностики, хронизации бронхолегочного процесса в детском и подростковом возрасте.» author=»Ильченко Светлана Ивановна, Фиалковская Анастасия Александровна, Иванусь Светлана Георгиевна» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-01-30″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_31.10.15_10(19)» ebook=»yes» ]

