Препараты рекомбинантных альфа2-ИФН известны как эффективные профилактические и лекарственные средства [1]. ИФН являются иммунокорректорами при различных патологиях вирусного и бактериального происхождения. Патогенез пандемического вируса гриппа А (H1N1) pdm09 активно изучается, но его механизмы во многом неясны [2,9]. В исследованиях на животных показано, что пандемический вирус размножается в клетках респираторного тракта активнее сезонного [12]. Пандемический вирус гриппа 2009 г. имеет реассортантную природу, происходит из свиного и распространился в человеческую популяцию [2-4,19]. Генетические отличия пандемического вируса от сезонного делают применение разработанных противогриппозных вакцин малоэффективным [9]. Значимость препаратов ИФН особенно возрастает в условиях отсутствия эффективных вакцин. Основное место репликации вирусов гриппа эпителиальные клетки, но клетки крови моноциты/макрофаги и другие лейкоциты также могут быть инфицированы вирусом [10,18]. В узнавании вирусов гриппа участвуют рецепторы врождённого иммунитета RIG1, TLR3, TLR4 и TLR7 [13,14, 16]. Идущие с этих рецепторов сигналы приводят к активации генов ИФН, антивирусных и апоптозных белков. Вирусы гриппа нарушают этот процесс с помощью различных механизмов, в первую очередь направленных на подавление сигнальных путей врождённого иммунитета [9, 20]. ИФН типа 1 интерферируют с вирусной репликацией, активируют иммунные клетки и делают окружающие клетки резистентными к вирусу [15,17]. Значимость препаратов ИФН особенно возрастает в условиях отсутствия эффективных вакцин. Исследования с вирусом Карельской лихорадки в клетках крови, проведенные нами ранее, показали высокую чувствительность альфавируса к препарату рекомбинантного альфа-2 ИФН (Реаферон «Вектор» Россия) [7]. Индуктор ИФН – препарат «Рибонуклеат натрия» усиливает действие инактивированных гриппозных вакцин, стимулируя гены сигнальных TLRs и RLRs рецепторов, ИФН и антивирусных ферментов [5,6].
В настоящей работе впервые исследовано влияние препарата альфа-2 ИФН («Фармапарк» Россия) на вирус гриппа A/Moscow/IIV01/2009 (H1N1) на уровне транскрипции генов рецепторов врожденного и адаптивного иммунитета. Полученная информация о действии вируса на уровне сигнальной трансдукции дополняет имеющиеся знания о молекулярных механизмах патогенеза. Действие пандемического вируса гриппа и рекомбинантного альфа-2 ИФН на сигнальные реакции иммунитета исследовано в клетках крови доноров. Сравнили регуляцию вирусом и ИФН группы генов TLRs и RIG1рецепторов, влияние на внутриклеточные уровни вирусных РНК и продукцию воспалительных цитокинов ИЛ1-бета и ФНО-альфа.
МЕТОДИКА ИССЛЕДОВАНИЯ
Вирус гриппа A/Moscow/IIV01/2009 (H1N1) получен из лаборатории физиологии вирусов НИИ вирусологии им. Д.И. Ивановского, размножен в культуре клеток MDCK в присутствии трипсина TPCK 1 мкг/мл (титр 104 ТЦД50 ), хранили при -80°С в аликвотах по 0,5 мл.
Препарат Реаферон (рекомбинантный альфа2-ИФН) 108 МЕ/мл фирмы «Фармапарк», Россия. В настоящее время используется для приготовления препарата «Виферон».
Постановка опытов на клетках крови. Свежевзятую венозную кровь 2-х доноров исследовали параллельно. 10 мл крови каждого донора разводили в 3 раза питательной средой RPMI-1640 c 10% сыворотки эмбрионов коров и антибиотиком гентамицин и разливали по 3 мл в стерильные пробирки с крышками. Варианты анализа: 1) контроль (без обработки); 2) альфа-2 ИФН; 3) альфа-2 ИФН + вирус гриппа; 4) вирус гриппа. К пробам добавляли рекомбинантный препарат альфа2ИФН в 2-х дозах 104 и 103 МЕ/мл и затем сразу вносили вирус гриппа A/Moscow/IIV01/2009 (H1N1) в количестве 20 мкл с титром 104 ТЦД50. Инкубацию продолжали 24 ч при 37°С.
Образцы центрифугировали 5 мин при 3000 об\мин. К осадкам клеток
добавляли 0,8 мл реагента Trizol («Invitrogen»,США), пипетировали и
замораживали при -80° С для выделения РНК. Супернатант собирали для
определения цитокинов методом ИФА.
ПЦР-праймеры к консервативному 7 сегменту РНК вирусов гриппа описаны в литературе [8]. Праймеры взаимодействовали с РНК гена белка М1 вируса гриппа A/Moscow/IIV01/2009 (H1N1) (Генбанк NCBI accession GQ219584.1 L’vov D.K., Prilipov A.G., Sadykova G.K., Usachev E.V.). Праймеры к мРНК B2M опубликованы нами ранее [5]. Праймеры к мРНК TLR7 и мРНК RIG1 расcчитаны в программе Primer 3 Blast (NCBI GenBank) и приведены ниже: TLR7 прямой 5-AGATGCCTTCCAGTTGCGAT; обратный 5-AACCACACAGCATCACAGGT.TLR8 прямой 5-CCTCGTCTCGAGTTGCTTGA; обратный 5-GAAAGCCAGAGGGTAGGTGG. RIG1 прямой 5-CCAGAGAACCAGTTG GGCTT; обратный 5-TCTCCACCATCTCTGGACACC. Все праймеры синтезированы фирмой Синтол (Россия).
Процедуры выделения РНК и проведение ОТ-ПЦР в реальном времени подробно описаны в работах [5-7]. Количественную ПЦР в реальном времени ставили на приборе CFX-96 (“Bio-Rad”, США) с готовой 2х-кратной смесью SsoFast EvaGreen Supermix. К разведенной 1/3 или 1/9 кДНК добавляли пары специфических праймеров (прямого и обратного).
Полученные ПЦР-продукты, соответствовали расчётным по Т-плавления и подвижности в агарозном геле. Относительная оценка экспрессии генов (дельтаCq) сделана в программе CFX Manager «Gene expression analysis» в автоматическом режиме.
Определение цитокинов ИЛ1-бета и ФНО-альфа в культуральной жидкости выполнено с помощью ИФА-наборов фирмы «Вектор-бест» согласно прилагаемой инструкции. Количественное измерение оптической плотности и расчёт средних концентраций 2-х повторных образцов в пг/мл выполнен на Микропланшетном фотометре модель «Anthos 2010» в программе ADAP+ (Biochrom, Великобритания).
Статистическая обработка результатов сделана в программе Medcalc с применением t-tests при p< 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Гриппозная инфекция у человека характеризуется быстрым воспалительным ответом, который проявляется наиболее сильно в клетках дыхательных путей [11]. Взаимодействие вирусов гриппа с иммунокомпетентными клетками вызывает продукцию цитокинов и это способствует распространению вируса в организме человека. Наиболее восприимчивы к вирусу гриппа макрофаги и дендритные клетки и стимулированные моноциты, которые в основном формируют иммунный ответ [18]. Имеются данные о позитивном влиянии на чувствительность к вирусу факторов клеточной дифференцировки [10]. Пока нет однозначного мнения о возможности вирусов гриппа размножаться в клетках крови. Однако, даже инактивированный УФ-лучами, неинфекционный вирус гриппа сохраняет цитокин индуцирующие активности, взаимодействуя с рецепторами врождённого иммунитета.
На рисунке представлено действие пандемического вируса и альфа-2 ИФН при раздельном и совместном добавлении к клеткам крови 2-х доноров.
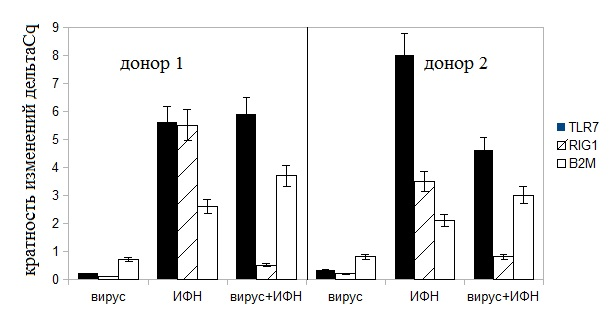
Рисунок. Действие вируса A/Moscow/2009 (H1N1), альфа2-ИФН и комбинации альфа2-ИФН + вирус на экспрессию генов сигнальных рецепторов иммунитета в клетках крови.
По оси ординат — кратность изменений генной активности (дельтаCq) относительно контроля, принятого равным 1. Доза альфа-2 ИФН 104 МЕ/мл.
Сделана количественная оценка уровней экспрессию 3-х генов: эндосомального рецептора TLR7, цитоплазматического рецептора RIG1 и B2M – ко-рецептора главного комплекса гистосовместимости MHC, участвующего в адаптивном иммунном ответе. Видно подавление вирусом транскрипции генов TLR7 и RIG1 в клетках крови 2-х доноров. Ингибирование пандемическим вирусом H1N1 экспрессии гена RIG1 уже было описано ранее [20]. По нашим данным вирус дополнительно негативно регулирует экспрессию гена TLR7. Рекомбинантный альфа-2 ИФН в дозе 104 , напротив, стимулирует активность генов рецепторов TLR7, RIG1и B2M. Одновременное добавление к клеткам крови вируса и ИФН мало изменяет картину генной экспрессии, индуцированную одним ИФН. Поэтому ингибирующее действие вируса на ген TLR7 устраняется добавлением рекомбинантного альфа-2 ИФН.
В таблице суммированы результаты действия альфа-2 ИФН в дозе 104 МЕ на содержание вирионной РНК в клетках крови.
Таблица
Содержание РНК вируса H1N1 и продукция цитокинов
в клетках крови
|
Показатели |
Способ воздействия |
|||
| Вирус H1N1
|
Вирус H1N1+
альфа-2 ИФН*** |
альфа-2 ИФН | Контроль клеток | |
| *ОТ-ПЦР ген М1
РНК вируса |
1±0,08 | 0,3±0,05 | 0 | 0 |
| **ИФА
ИЛ1-бета пг/мл |
46 | 58 | 118 | 15 |
| ФНО-альфа пг/мл | 9 | 10 | 11 | 3 |
*Относительные изменения генной экспрессии дельтаСq±SD. **Средние арифметические 2-х повторных измерений.
***Доза альфа-2 ИФН 104 МЕ/мл.
После 24 ч контакта с вирусом внутриклеточный уровень вирионной РНК достоверно снижается приблизительно в 3 раза. В ответ на вирус и ИФН возрастает продукция клетками крови ИЛ1-бета и незначительно ФНО-альфа.
Таким образом показано, что вирус гриппа А (H1N1)pdm09 вызывает подавление активности генов RIG1 и TLR7 в клетках крови людей. Рекомбинантный альфа-2 ИФН повышает экспрессию генов рецепторов врождённого иммунитета в клетках крови человека и снижает в них содержание вирионной РНК вируса гриппа А. Дополнительно, альфа-2 ИФН устраняет негативное влияние вируса гриппа H1N1 на экспрессию гена рецептора TLR7 — основного сигнального рецептора в дендритных клетках. Снижение содержания вирусных РНК в клетках крови может быть вызвано активацией ИФН-регулируемой РНК-азы и индуцированных процессов аутофагии в зараженных клетках.
Таким образом, наши результаты ex vivo на клетках крови, с вирусом гриппа А H1N1 (Москва, 2009) подтверждают выводы зарубежных исследователей на больных гриппом. Полученные данные характеризуют пандемический вирус гриппа 2009 как чувствительный к антивирусному действию ИФН и как слабый индуктор цитокинов в макрофагах и дендритных клетках человека [15]. Нарушения транскрипционного ответа, вызываемые вирусами в генах сигнальных рецепторов клеток крови, и возможности их коррекции препаратами рекомбинантных ИФН являются важными показателями при выборе тактики лечения.
СПИСОК ЛИТЕРАТУРЫ:
- Ершов Ф.И. Антивирусные препараты: справочник (2-е изд.). М.: Геотар Медиа. 2006. — 312 с.
- Киселёв О.И. Геном пандемического вируса гриппа А/H1N1v-2009. С-П-М.: Компания «Димитрейд График групп» — 2011.
- Львов, Д.К. Изоляция 24.05.2009. и депонирование в Государственную коллекцию вирусов (ГКВ № 2452 от 24.05.2009) первого штамма А/VII-Moscow/01/2009 больного в Москве / Д.К. Львов, Е.И. Бурцева, А.Г. Прилипов и др.// Вопросы вирусологии. – 2009. – Т. 54 — № 5. – С. 10-14.
- Львов, Д.К. Распространение нового пандемического вируса гриппа А(H1N1)v в России / Д.К. Львов, Е.И. Бурцева, М.Ю. Щелканов и др.// Вопросы вирусологии. – 2010. – Т. 55. — № 3.- С. 4-9.
- Соколова, Т.М. Стимуляция экспрессии генов сигнальных рецепторов и индукция синтеза цитокинов в клетках крови человека при действии препарата «Рибонуклеат натрия» и его комбинаций с гриппозными вакцинами in vitro / Т.М Соколова, А.Н. Шувалов, В.В. Полосков, И.М. Шаповал, М.П. Костинов // Молекулярная медицина. – 2015. — № 1. – С.12-17.
- Соколова, Т.М. Препарат «Ридостин» индуцирует транскрипцию широкого спектра генов системы интерферона в клетках человека / Т.М. Соколова, А.Н. Шувалов, М.В. Телков, Л.В. Колодяжная, Ф.И. Ершов // Бюллетень экспериментальной биологии и медицины. – 2013. – Т. 156. — № 8. – С. 179-182.
- Соколова, Т.М. Подавление рекомбинантным альфа-2 интерфероном репродукции вируса Карельской лихорадки в клетках крови человека / Т.М. Соколова, А.Н. Шувалов // Вопросы вирусологии. – 2011. – Т. 57. — № 2. — С. 27-31.
- Fouchier, R. A. M. Detection of influenza A viruses from different species by PCR amplification of conserved sequences in the matrix gene / R. A.
- Fouchier, T. M. Bestebroer, S. Herst, L. van der Kemp, G. F. Rimmerlzwaan et al. // J. of Clinical Microbiology. – 2000. – V. 38. — N 11. — P. 4096-4101.
- Hale B.G. Innate immune evasion strategies of influenza viruses / B.G. Hale, R.A. Albrecht, A.Garcia-Sastre // Future Microbiol. – 2010. — N 5. – P. 23- 35.
- Hoeve, M.A. Influenza virus A infection of human monocyte and macrophage subpopulations reveals increased susceptibility associated with cell differentiation / M.A. Hoeve, A.A. Nash, D. Jackson et al. // Plos One. – 2012. – V. 7. – N 1. — e29443.
- Julkunen, I. Inflammatory responses in influenza A virus infection / I. Julkunen, K. Melen, Nyqvist et al. // Vaccine. – 2000. – V. 19. — S32-37.
- Kwon, D. Replication and pathogenesis of the pandemic (H1N1) 2009 influenza virus in mammalian models / D. Kwon, K. Shin, S. Kim et al. // J. Microbiol. – 2010. – V. 48. – P. 657- 662.
- Lee, N. Role of human Toll-like receptors in naturally occurring influenza infections / N. Lee, C.K. Wong, D.S. Hui et al. // Influenza other Respir. viruses. – 2013. – V. 7. – N 5. – P. 666-675.
- Liu, Y. Antiviral role of Toll-like receptors and cytokines against the new 2009 H1N1 virus infection / Y.Liu, H.Chen, Y. Sun, F.Chen // Mol. Biol. Rep. – 2012. – V. 39. – N 2. – P. 1162-1172.
- Osterlund, P. Pandemic H1N1 2009 influenza A virus induces weak cytokine responses in human macrophages and dendritic cells and is highly sensitive to the antiviral actions of interferons / P. Osterlund, J. Pirhonen, N. Ikonen et al. // J. Virol. – 2010. — V. 84. N 3.
- Rehwinkel, J. RIG1 detects viral genomic RNA during negative-strand RNA virus infection / J. Rehwinkel, C. P. Tan, D.Goubau et al. // Cell. – 2010. – V. 140. P. 397- 408.
- Ronni, T. Regulation of IFN-alpha/beta, MxA, 2`,5`-oligoadenylate synthetase, and HLA gene expression in influenza A-infected human lung epithelial cells / T. Ronni, S. Matikainen, T. Sareneva, K. Melen, J. Pirhonen et al. // J. of Immunology – 1997. – V.158. – P. 2363-2374.
- Short, K.R. The fate of influenza A virus infection of human macrophages and dendritic cells / K.R. Short, A.G. Brooks, P.C. Reading et al. // J. General Virology. – 2012. – V. 93. – P. 2315-2325.
- Smith, G.J. Origins and evolutionary genomics of the 2009 swine origin H1N1 influenza A epidemic / G.J. Smith, D. Vijaykrishna, J. Bahl et al. // Nature. – 2009. — V. 459. – P. 1122-1125.
- Wu, W. Influenza A (H1N1)pdm09 virus suppresses RIG1 initiated innate antiviral responses in the human lung / W. Wu, W. Zhang, J.L. Booth, J.P. Metcalf J.P. et al. // PLOS ONE. – 2012. – V. 7. N11. e49856.[schema type=»book» name=»ДЕЙСТВИЕ РЕКОМБИНАНТНОГО АЛЬФА-2 ИНТЕРФЕРОНА НА ВИРУС ГРИППА H1N1 (МОСКВА 2009): АКТИВНОСТЬ ГЕНОВ ВРОЖДЁННОГО И АДАПТИВНОГО ИММУНИТЕТА И ВОСПАЛИТЕЛЬНЫХ ЦИТОКИНОВ» description=» Цель. Оценка антивирусного действия рекомбинантного альфа-2 ИФН («Фармапарк», Россия) в экспериментах с вирусом гриппа А H1N1 (Москва 2009) на клетках крови здоровых доноров. Метод. Определение уровней экспрессии генов сделано методом ОТ-ПЦР в реальном времени (CFX-96, «Био-рад»). Продукция цитокинов ИЛ1-бета и ФНО-альфа измерена с помощью ИФА-наборов фирмы «Вектор-бест» на Микропланшетном фотометре модель «Anthos 2010» в программе ADAP+ (Biochrom, Великобритания). Вирус гриппа А H1N1 (Москва 2009) был приготовлен к.м.н. И.А. Рудневой (Лаборатория физиологии подразделение «НИИ вирусологии им. Д.И. Ивановского»). Результат. Вирус гриппа А H1N1 (Москва 2009) с инфекционным титром 104 ТЦД50/мл подавляет активность генов рецепторов TLR7 и RIG1 при добавлении к клеткам крови здоровых доноров на срок 24 ч при 37°С. Альфа-2 ИФН стимулирует транскрипцию генов рецепторов врождённого — TLR7 и адаптивного — B2M иммунитета. Антивирусное действие препарата альфа-2 ИФН в дозе 104 МЕ/мл проявляется при совместном внесении с вирусом: устраняется негативное действие вируса на ген рецептора TLR7 и достоверно снижается содержание вирусных РНК в клетках. Вирус гриппа А H1N1 (Москва 2009) вызывает слабую воспалительную реакцию в клетках крови, увеличивая продукцию сигнального воспалительного ИЛ1-бета и ФНО-альфа. Выводы. Представленные данные показывают, что препарат рекомбинантного альфа-2 ИФН («Фармапарк», Россия) оказывает антивирусное действие на вирус гриппа А H1N1 (Москва 2009), активируя транскрипцию гена рецептора TLR7 и подавляя уровень вирусных РНК в клетках. Экспрессия генов TLRs, RLRs и B2M рецепторов и секреция ИЛ1-бета клетками крови могут быть использованы как информативные молекулярные маркёры эффективности ИФН-терапии при гриппозной инфекции.» author=»Соколова Татьяна Михайловна, Шувалов Александр Николаевич, Полосков Владислав Васильевич » publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-02-16″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_29.08.2015_08(17)» ebook=»yes» ]

