Введение.
Развитие патологических изменений в печени сопровождается изменениями процессов апоптоза-регенерации-репарации [1,2,3]. Цирроз печени это дегенеративный процесс, который развивается вследствие гибели гепатоцитов и образования фиброзной ткани. В начале заболевания возникает компенсаторная регенерация, которая впоследствии снижается с преобладанием фиброзной ткани в печени [1,2,4]. Это ведет к изменениям органоспецифических аутоантигенов и сопровождается адаптивной реакцией иммунной системы в виде изменений продукции аутоантител (АТ) к антигенам гепатоцитов [5,9,7].
Для стимуляции регенерации цирротически измененной ткани печени, мы применяли высококонцентрированный раствор фибриногена полученный криопреципитатией. В состав криопреципитата входят фибриноген, фибринстабилизирующий фактор FXIII, фибронектин, плазминоген, альбумин и глобулярные фракции, а также иммуностимулирующий комплекс. В эксперименте криопреципитат вызывает изменения состава острофазных белков, наблюдается кратковременная активация секреции провоспалительных, а затем противовоспалительных и иммунорегуляторных цитокинов [3,4].
С целью определения дегенеративных процессов в цирротической ткани печени, до и после введения криопреципитата, мы провели исследование продукции ауто-АТ к антигенам гепатоцитов (гепатотест) и желудочно-кишечного тракта. Выявление стойких аномалий в сывороточном содержании маркерных ауто-АТ к антигенам гепатоцитов и желудочно кишечного тракта дает возможность проанализировать характер изменений в органе и более обоснованно подойти к назначениям лекарственных препаратов, оценить эффективность и адекватность проводимой терапии [5,6,8,7].
Материалы и методы.
На кафедре факультетской хирургии №1, лечебного факультета, Первого МГМУ им. И.М.Сеченова, с апреля 2010г по сентябрь 2011г находилось 16 пациентов с циррозом печени, сыворотку крови которых исследовали с помощью метода гепатотеста. Исследование гепатотеста проводили с помощью твердофазного иммуноферментного анализа, используя одноименные наборы иммунореагентов, с помощью которых проводили сравнительное полуколичественное определение в сыворотке крови обследуемых антитела-маркеров, изменения которых могут быть индикаторами патологических процессов не только в печени, но и в органах желудочно-кишечного тракта [5,6,8,7]. Оценка общего состояния печени производилась нами по сывороточному содержанию ауто-АТ к растворимым цитоплазматическим (HeS-08) и мембранным митохондриальтным антигенам гепатоцитов (НММР). Гепатотест позволяет оценить имеющиеся или начинающееся заболевания печени аутоиммунного, инфекционного, токсического или опухолевого генеза и наблюдать за ним в динамике. Нормальные значения ауто-АТ варьирует в пределах -20.…+10. Повышение продукции ауто-АТ к цитоплазматическим антигенам (HeS-08) обычно свидетельствует о нарушениях функционального характера. Повышение ауто-АТ к митохондриальным антигенам (НММР) часто указывает на дегенеративные процессы. Развитие обширного диффузного склероза (цирроза), как исхода, ранее имевшего место активного патологического процесса, сопровождается снижением продукции таких ауто-АТ [5]. Мы также исследовали антитела к печеночному тубулину и актину, повышение которых свидетельствует о хроническом процессе в печени [5,6,8,7]. Кроме того, определяли уровень ауто-АТ к коллагену, соответствующий рубцово-спаечному процессу в организме. Мы проанализировали маркеры активации апоптоза ауто-АТ к ДНК. Повышение уровня аутоантител к цитоплазматическим антигенам (HeS-08) и ауто-АТ к ДНК свидетельствуют об активности вирусных гепатитов и аутоиммунных процессов в печени [8,7].
Для выявления патологии со стороны желудочно–кишечного тракта мы исследовали следующие антигены: GaM и GaS — антигены стенки желудка, ItM — антиген стенки тонкой кишки, SCМ — антиген стенки толстой кишки [6,8]. Повышение указанных аутоантител, указывает на воспаление в желудочно-кишечном тракте.
Полученные данные сопоставляли с клинико-лабораторными исследованиями по классификации Child-Pugh. Цирроз класса А по Child-Pugh был диагностирован у 3 пациентов, класс В – у 7 пациентов, класс С — у 6. У 6 из 16 пациентов цирроз был смешанной (вирусной и токсической) этиологии, у 10 – алкогольной. Мужчин было 9, женщин — 7. Возраст больных составлял от 25 до 60лет.
Исследование гепатотеста проводили до введения криопреципитата в ткань печени под контролем УЗИ и после его введения (через 3 и 12 месяцев). Криопреципитат вводили чрескожно под контролем УЗИ в ткань печени, по 1,5-2мл в каждый сегмент [4].
Статистическая обработка материала выполнена с помощью программы STATISTIKA Six Sigma 7.
Результаты и их обсуждение.
Исследуя сывороточные показатели ауто-АТ маркеров воспалительных и дегенеративных изменений печени (HMMP, ауто-АТ к тубуллину и актину печени) до введения криопреципитата в цирротическую ткань печени, мы выявили повышение уровня ауто-АТ к митохондриальным антигенам печени (HMMP) у 4 (из16) больных и снижение уровня таких ауто-АТ у 1 больного (рис.1). Уровень ауто-АТ к тубуллину и актину печени (маркеры хронических заболеваний печени) у всех 16 больных не выходили за пределы нормальных значений (рис.2).
Через 3 месяца после введения криопреципитата в печень мы отметили положительную динамику показателей ауто-АТ к митохондриальным антигенам печени (HMMP) (рис.1). Ранее повышенные показатели таких ауто-АТ соответствовали норме у двух из четырех больных с циррозом печени (р=0,07). Проводя корреляцию с клинико-лабораторными данными, мы определили, что данная положительная динамика соответствует снижению активного процесса в цирротической ткани печени, особенно у больных с вирусными гепатитами [1]. У 2 (из 16) больных мы выявили снижение уровня ауто-АТ к тубулину и актину (рис.2), это доказывало стимулирующее влияние криопреципитата на регенерацию печени (р>0,05). При морфологическом исследовании биоптата печени, у данных больных, мы подтвердили преобладание признаков регенерации.
Через 12 месяцев, после введения криопреципитата, у большинства пациентов показатели HMMP были в пределах нормы (рис.1), повышенный уровень ауто-АТ к митохондриальным антигенам гепатоцитов (HMMP) был у одного больного,. По клинико-лабораторным данным у данного больного, с декомпенсированным циррозом класса С по Child-Pugh вирусной этиологии, мы наблюдали положительную динамику — снизился общий билирубин, повысился общий белок и альбумин, регрессировали или отсутствовали асцит и периферические отеки. У одного больного определили повышение показателей ауто-АТ к тубулину и актину (рис.2), что свидетельствовало о переходе активного патологического процесса в печени в хроническую форму заболевания (р=0,04) [9,10].
Исследуя маркеры активации апоптоза (ауто-АТ к ДНК) и ауто АТ к цитоплазматическим антигенам гепатоцитов (HeS-08), до введения криопреципитата в печень, мы выявили, что у 4 (из16) больных эти показатели были выше нормы и у 1 ниже нормы (рис.2, рис 3). Повышение или отклонение указывало на активность вирусного поражения печени. Через 3 и 12 месяцев после введения криопреципитата, мы определили снижение исходно повышенных ауто-АТ к ДНК и ауто АТ к цитоплазматическим антигенам печени (HeS-08) у 2 (из16) больных (рис.2, рис3). По клинико-лабораторным данным, у данных больных с вирусным поражением, мы отметили положительную динамику, так как снизилась активность гепатита. У двух других больных снижение ауто-АТ к ДНК и ауто АТ к цитоплазматическим антигенам печени (HeS-08), было обусловлено переходом заболевания в хроническую форму (р>0,05) [10,11].
У большинства больных, несмотря на то, что они длительно страдали циррозом печени, аутоантитела к антигенам печени (HMMP, HeS-08, ауто-АТ к ДНК, ауто-АТ к тубулину и актину) были в пределах нормы (рис.1, рис.2, рис.3). После стимуляции регенерации цирротической ткани печени криопреципитатом, количество больных с нормальными показателями аутотел к антигенам печени увеличилось. Это свидетельствует о снижении активного процесса в цирротической ткани печени [7]. У 2 из16 больных, после стимуляции цирротической ткани печени криопреципитатом, активный процесс не только снизился, но и перешел в хроническую форму заболевания.
При исследовании маркеров рубцово-спаечных изменений (ауто-АТ к коллагену) мы выявили нормализацию показателей маркерных ауто-АТ через 12 месяцев после введения криопреципитата у 2 (из16) больных, а у 4 отметили снижение уровня ауто-АТ к коллагену ниже нормы (р>0,05). При морфологическом исследовании, у данной группы пациентов с циррозом печени, увеличения разрастания соединительной ткани мы не наблюдали. У большинства (у 12 из 16) пациентов указанные маркеры были в пределах нормы (рис.5) через 12 месяцев.
Следует отметить, что одной из причин смерти у пациентов с циррозом печени является кровотечение из слизистой желудка — при развитии портальной гипертензионной гастропатии [1]. Частота выявления портальной гипертензионной гастропатии у больных с циррозом печени варьирует по данным различных авторов от 36 до 100% [2]. Прогностические факторы развития гастропатии изучены недостаточно. С целью выявления и динамического исследования патологии со стороны желудочно-кишечного тракта мы определяли аутоантитела к антигенам желудка, тонкой и толстой кишок [7].
Исследуя маркеры воспалительных и дегенеративных изменений органов желудочно-кишечного тракта, до введения криопреципитата в цирротическую ткань печени, мы отметили повышение ауто-АТ к антигенам желудка (GaМ и GaS) у 6 из 16 больных. Оценивая данные эндоскопического исследования желудка у данных пациентов, мы выявили эрозии в антральном отделе желудка у 2 больных, и явления гастропатии — у 4 больных. Через 3 месяца, после введения криопреципитата в ткань печени, существенной положительной динамики маркеров воспалительных изменений в желудке мы не выявили, несмотря на проводимую противоязвенную терапию. При эндоскопическом исследовании желудка отметили положительную динамику, а именно, эпитализацию ранее выявленных эрозий желудка и двенадцатиперстной кишки и исчезновение явлений гастропатии. Через 12 месяцев после введения криопреципитата в печень мы отметили положительную динамику маркеров воспалительных изменений в стенке желудка – показатели маркерных ауто-АТ к GaМ и GaS снизились в 2 раза (р=0,13).
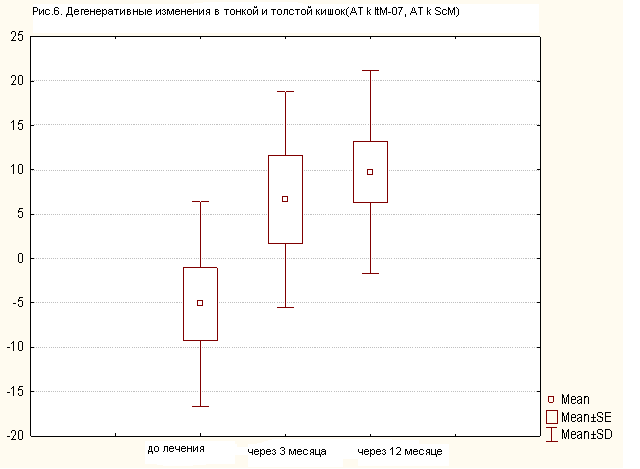
У 3 из 16 больных, страдающих циррозом печени токсической этиологии, мы выявили изменения показателей ауто-АТ к антигенам тонкой (ItM) и толстой кишок (ScМ). До введения криопреципитата в печень показатели ауто-АТ к антигенам ItM (тонкой кишки) и ScМ (толстой кишки) были выше нормы у 6 из16 больных (р=0,13) (рис.6). При этом клинически выраженных проявлений воспаления толстой или тонкой кишки мы не наблюдали. Через 3 и 12месяцев повышение сывороточных уровней маркеров нарушений в стенках тонкой и толстой кишок (ауто-АТ к антигенам ItM и ScМ) было у 10 из 16 больных (рис.6). Клинических проявлений воспаления в тонкой и толстой кишках мы не наблюдали.
Таким образом, снижение уровня ауто-АТ к антигенам GaМ и GaS (маркеров воспалительных изменений в стенках желудка), после введения криопреципитата в цирротическую ткань печень, было у больных с ранее подтвержденными признаками воспалительных изменений в стенке желудка. Данной группе пациентов была назначена противоязвенная терапия, после которой воспалительные явления в желудке уменьшились [2]. В период наблюдения за больными с циррозом печени, которым мы вводили криопреципитат в печень, мы отметили воспалительные изменения в стенке толстой и тонкой кишки через 3 месяца у 6 из 16 больных, через 12 месяцев – у 10, не достигающие, однако, уровня клинически значимых проявлений (р=0,07). Данным больным была назначена терапия пробиотиками.
Заключение.
Исследуя количество сывороточного содержанию ауто-АТ к антигенам гепатоцитов (HMMP, HeS-08, ауто-АТ к ДНК, ауто-АТ к тубулину и актину, к коллагену), до и после введения криопреципитата в цирротическую ткань печень, мы установили, что у большинства больных, несмотря на то, что они длительно страдали циррозом печени, данные маркеры были в пределах нормы (рис.1, рис.2, рис.3). Прогрессирование дегенеративных процессов в печени, которое мы наблюдали у 4 из16 пациентов с токсическим циррозом печени, снизилось через 3 и 12 месяцев, после введения криопреципитата, и было у 1 больного. Это подтверждает стимулирующее действие криопреципитата на регенерацию цирротической ткани печени, что подтверждено нами при морфологическом исследовании. У 3 из 16 пациентов с активным циррозом печени вирусной этиологии (гепатит С и В), через 3 месяцев после введения криопреципитата в печень, было снижение активности процесса (рис.3, рис.4), а через 12 месяцев у 2 из этих больных патологический процесс перешел в хроническую форму заболевания. По-видимому больным с декомпенсированным циррозом печени класса С по Child-Pugh, особенно вирусной этиологией, целесообразно рекомендовать повторное введение криопреципитата в печень через 3 месяца.
Анализируя изменения аутоантител, отражающих интенсивность рубцово-спаечных изменений, в большинстве случаев мы выявили положительную динамику в ответ на введение криопреципитата в цирротически измененную печень (рис.5). При морфологическом исследовании прогрессирования разрастания соединительной ткани мы не отметили.
С помощью исследований аутоантител к антигенам желудка, до и после введения криопреципитата в цирротически измененную ткань печени, вирусного, алкогольного или токсического генеза, мы наблюдали снижение или полную нормализацию аутоантител воспалительных изменений в стенке желудка у 8 из 16 больных через 12 месяцев. Характерно, что данные гепатотеста коррелировали с результатами гастродуоденоскопии (исходно у них воспалительные процессы в стенке желудка , в последующем снижение их выраженности или полное исчезновение).
Через 12 месяцев после введения криопреципитата в печень, мы выявили маркерные признаки воспалительных процессов в стенке тонкой и толстой кишках у 10 из 16 больных (рис.6), однако очевидных клинических проявлений воспаления тонкой и толстой кишок мы не выявили, возможно, в силу слабой интенсивности процессов воспаления.
Таким образом, полученные нами данные свидетельствуют о том, что криопреципитат, введенный в ткань печени под контролем УЗИ, у большинства больных страдающих циррозом печени, снижает активность дегенеративных и воспалительных процессов в печеночной ткани, уменьшает рубцово-спаечный процесс, воспаление в стенке желудка. При преобладании дегенеративных процессов в печени после введения криопреципитата, необходимо повторное его введение в печень через каждые три месяца.
Литература.
1.Мардарьева С.В. Портальная гипертензионная гастропатия как проявление портальной гипертензии при циррозе печени (клинико-лабораторные и инструментальные корреляции и особенности терапии). Автореф. Дисс…….. канд. мед. наук. М. 2006; 26
2.Нартайлаков М.А., Пышкин С.А., Цирятьевой С.Б. Регенеративная хирургия хронических гепатитов и циррозов печени. Уфа 2008;46-48.
3.Хоробрых Т.В. Фибриновый клей в неотложной абдоминальной хирургии Автореферат Дисс.. докт..мед..наук. Москва 2005.34-38.
4.ЧерноусовА.Ф., Хоробрых Т.В., Карпова Р.В. Криопреципитат в лечение больных с циррозом печени. Материалы научно-практической конференции «Актуальные проблемы гастроэнтерологии». М.; 2011; 88-83.
5.Арапов Н.А., Полетаев А.Б. О перспективах развития новой концепции профилактической медицины. Глав. Врач.2007;6: 72-76.
6.Полетаев А.Б., Новые подходы к раннему выявлению патологических изменений в организме человека. Методические рекмендации для врачей. М.: 2011; 62-64.
7.Полетаев А.Б. Иммунологический гомункулус в норме и патологии. Биохимия. 2002, 67( 5): 721-731.
8.Полетаев А.Б., Данилов А.Н. Иммунофизиология. Естественный аутоиммунитет в норме и патологии. Сб. материалов 2-й Московской международной конференции. М., 2008;67-68.
9.Parnes O. From interception to incorporation: degeneration and promiscuous recognition as precursors of a paradigm shift in immunology. Mol. Immunol. 2004; 40: 985-991.
10.Plotz PH. The autoantibody repertoir: searching for order. Nature Reviews, Immunology. 2003; 3: 73-78.
11.Pradeu T, Carosella ED. On the definition of a criterion of immunogenicity. PNAS. 2006; 103: 17858-17861.


 [schema type=»book» name=»Анализ действия криопреципитата на гепатотест у больных с циррозом печени» description=»Исследуя стимулирующее влияние криопреципитата на цирротическую ткань печени, мы обследовали у 16 больных страдающих циррозом печени, токсической и вирусной этиологии (гепатит В и С). У данной группы больных исследовали продукцию аутоантител к антигенам гепатоцитов (гепатотест) и желудочно-кишечного тракта. Полученные нами данные свидетельствуют о том, что криопреципитат, введенный в ткань печени под контролем УЗИ, у большинства больных страдающих циррозом печени, снижает активность дегенеративных и воспалительных процессов в печеночной ткани, уменьшает рубцово-спаечный процесс, воспаление в стенке желудка. У 18,75% больных циррозом печени вирусной этиологии, через 12 месяцев, был отмечен переход патологического процесса в хроническую форму заболевания, что потребовало повторного введения криопреципитата в печень. Мы выявили повышение маркерных признаков воспаления в тонком и толстом кишечнике через 3 и 12 месяцев после введения криопреципитата в печень, без клинически значимых проявлений. » author=» Р.В.Карпова, А.Ф. Черноусов, Т.В. Хоробрых,» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-05-22″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_ 30.01.2015_01(10)» ebook=»yes» ]
[schema type=»book» name=»Анализ действия криопреципитата на гепатотест у больных с циррозом печени» description=»Исследуя стимулирующее влияние криопреципитата на цирротическую ткань печени, мы обследовали у 16 больных страдающих циррозом печени, токсической и вирусной этиологии (гепатит В и С). У данной группы больных исследовали продукцию аутоантител к антигенам гепатоцитов (гепатотест) и желудочно-кишечного тракта. Полученные нами данные свидетельствуют о том, что криопреципитат, введенный в ткань печени под контролем УЗИ, у большинства больных страдающих циррозом печени, снижает активность дегенеративных и воспалительных процессов в печеночной ткани, уменьшает рубцово-спаечный процесс, воспаление в стенке желудка. У 18,75% больных циррозом печени вирусной этиологии, через 12 месяцев, был отмечен переход патологического процесса в хроническую форму заболевания, что потребовало повторного введения криопреципитата в печень. Мы выявили повышение маркерных признаков воспаления в тонком и толстом кишечнике через 3 и 12 месяцев после введения криопреципитата в печень, без клинически значимых проявлений. » author=» Р.В.Карпова, А.Ф. Черноусов, Т.В. Хоробрых,» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-05-22″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_ 30.01.2015_01(10)» ebook=»yes» ]

