Каротиноиды наравне с черно-коричневыми меланинами являются наиболее распространенными природными пигментами [1, с. 40]. Каротиноиды – это биологически активные вещества (БАВ), характеризующиеся структурным разнообразием и обширным спектром биологического действия, например, антиоксидантной, антиканцерогенной, иммуномодулирующей, провитаминной активностями [5, с. 4-6, 6, с. 5-6]. Эти БАВ синтезируются бактериями, водорослями, растениями и грибами, накоплением каротиноидов обусловлена окраска гидробионтов и оперения птиц [1, с. 52-59].
Эволюционно человек приспособлен противостоять окислительному стрессу, однако на фоне усугубления неблагоприятной экологической обстановки эндогенные механизмы защиты без диетических антиоксидантов, в частности, каротиноидов, не способны полностью поддерживать защитные силы организма. Среди всех каротиноидов астаксантин является наиболее мощным природным антиоксидантом. В литературных источниках опубликованы рекомендуемые среднесуточные нормы потребления астаксантина в различных странах, например, в Японии – это 6 мг в сутки, в США – 5 мг в сутки и 4 мг в сутки в странах Европы [12, с. 2].
В связи с этим задача выделения астаксантина из природных источников продолжает быть актуальной.
Цель исследования – выделение астаксантина из панцирей креветок.
Объекты и методы. В качестве источника астаксантина были использованы панцири креветок (сем. Crangonidae L.). Учитывая растворимость этого каротиноида [7, с. 121], в качестве экстрагентов были выбраны спирт этиловый 96%, хлороформ и ацетон. Гексан в эксперименте как экстрагент не использовали в связи с его достаточно высокой токсичностью [2, с. 116].
Выделения астаксантина было осуществлено методом жидкостной экстракции [4, с. 95].
Идентификацию выделенного каротиноида проводили методом ТСХ. На линию старта хроматографической пластинки 10х15 см «Sorbfil» наносили 5 мкл раствора астаксантина в гексане. Далее образцы хроматографировали восходящим способом в соответствующей подвижной фазе.
Составы подвижных фаз: I – петролейный эфир-диэтиловый эфир-кислота уксусная (85:15:1); II – диэтиловый эфир-петролейный эфир (3:1); III – петролейный эфир-бензол (10:1) IV – гексан-ацетон (6:2).
После продвижения подвижной фазы до края пластинки, пластинку вынимали и сушили.
Детекцию зон адсорбции проводили визуально по их окраске (астаксантин – красно-розовое окрашивание; β-каротин – оранжево-желтое окрашивание). Далее пластинки опрыскивали 10% раствором фосфорномолибденой кислоты с последующим нагреванием до 60°С в течение 2 мин. Зоны адсорбции всех каротиноидов окрашивались в ярко синий цвет.
Идентификацию осуществляли по величинам коэффициентов подвижности, сравнивая их с опубликованными в периодической литературе коэффициентами подвижности для использованных в эксперименте хроматографических условий [3, с.267, 8, с. 369, 9, с. 378, 13. с. 558].
Дополнительно идентификацию проводили методом спектрофотометрии. Для растворов астаксантина в спирте этиловом 96%, хлороформе и ацетоне измеряли оптическую плотность при длине волны 478±2 нм, используя в качестве раствора сравнения спирт этиловый 96%, при 485±2 нм используя в качестве раствора сравнения хлороформ, и при 480±2 нм используя в качестве раствора сравнения ацетон.
Результаты и их обсуждение. В ходе предварительных испытаний были установлены оптимальное время для одного этапа экстрагирования – 30 мин. и объем порции растворителя для одного этапа выделения, составляющий 50 мл.
Экстрагирование астаксантина вели поэтапно, добавляя новые порции растворителей до полного обесцвечивания сырья. Контроль над полнотой выделения астаксантина осуществляли спектрофотометрически. Изолирование прекращали, если оптическая плотность не изменялась в двух последних измерениях и была минимальная.
Спектры поглощения и величины оптических плотностей при 481 нм для пяти извлечений на примере экстракции ацетоном представлены на рисунке 1.
Рисунок 1 – Спектры поглощения ацетоновых экстрактов
из панцирей креветок
Как следует из рисунка 1, при добавлении четвертой и пятой порций экстрагента оптическая плотность полученного экстракта оставалась неизменной и находилась около 0,002, т.е. последующее добавление порции экстрагента было нецелесообразным. Кроме того, необходимо отметь, что после проведения пятого этапа экстракции исходное сырье практически обесцветилось.
Таким образом, по результатам эксперимента установлено, что оптимальное число этапов выделения астаксантина для всех трех экстрагентов: спирта этилового 96%, хлороформа и ацетона, составило 5 порций по 50 мл. Изучение влияния температурного режима на полноту выделения астаксантина не проводилось, т.к. известно, что каротиноиды являются термолабильными соединениями, способными к изомеризации под действием температуры, поэтому выделение астаксантина проводилось при комнатной температуре.
В ходе ТСХ-анализа полученных образцов астаксантина установлено, что при использовании систем растворителей I, II, III, IV в полученных образцах были обнаружены астаксантин и β-каротин. В тоже время система растворителей I позволила разделить в анализируемых образцах еще два не идентифицированных соединения каротиноидной природы.
Результаты ТСХ-анализа подтвердили необходимость проведения дополнительной очистки методом колоночной хроматографии, после проведения которой на хроматограммах были обнаружены по одной зоне адсорбции с коэффициентами подвижности 0,067 (система I), 0,352 (система II), 0,04 (система III), 0,870 (система IV), соответствующими астаксантину [11, с.396-399 , 13, с. 559].
Дополнительно идентификацию астаксантина проводили методом спектрофотометрии в видимой области в интервале длин волн от 360 до 780 нм. Спектры поглощения регистрировали для растворов астаксантина в спирте этиловом 96%, хлороформе и ацетоне. Пример спектра поглощения образца астаксантина в хлороформе представлен на рисунке 2.
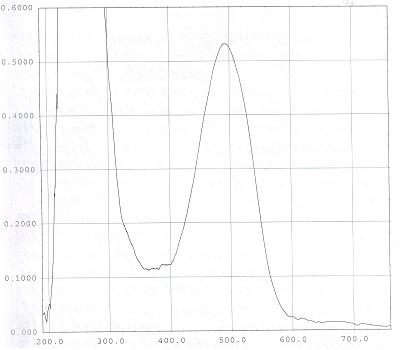
Рисунок 2 – Спектр поглощения образца астаксантина в хлороформе
Как показали результаты спектрофотометрического анализа выделенного образца астаксантина, в его спектре поглощения в хлороформе был зафиксирован максимум оптической плотности при 487 нм, что соответствует положению максимума поглощения астаксантина в этом растворителе – 485±2 нм [11, с. 396-399].
В результате эксперимента установлено, что электронный спектр раствора образца астаксантина в ацетоне имел максимум оптической при 481нм, что соответствует данным литературы – 480±2 нм [11, с. 396-399].
На следующем этапе подтверждения подлинности выделенного каротиноида был изучен УФ-спектр поглощения выделенного образца в спирте этиловом 96%, для которого установлен один максимум поглощения при 479 нм, что соответствует литературным сведениям – 478±2 нм [11, с. 396-399].
Выводы. Таким образом, в ходе исследования установлено, что спирт этиловый 96%, хлороформ и ацетон могут использоваться в качестве экстрагентов для выделения астаксантина.
Оптимальным является пятикратная экстракция порциями растворителей по 50 мл и временем изолирования на каждом этапе – 30 мин.
Результаты ТСХ-анализа в четырех различных системах растворителей и спектрофотометрического анализа подтвердили, что в ходе эксперимента из панцирей креветок методом жидкостной экстракции был выделен индивидуальный каротиноид – астаксантин.
Литература:
- Бриттон, Г. Биохимия природных пигментов. М.: Мир, 1986. – 422 с.
- Государственная фармакопея Российской Федерации XII, Ч.1., М.: Научный центр экспертизы средств медицинского применения, – С. 115 – 118.
- Дороднева, В.И. Идентификация каротиноидов листьев грецкого ореха (Juglans regia L.) методами спектрофотометрии и тонкослойной хроматографии / В.И. Дороднева // Растительные ресурсы. – 1967. – №2. – С. 266-268.
- Курегян, А.Г. Способ получения каротиноидов из растительного сырья / А.Г. Курегян, С.В. Печинский // Современная медицина актуальные вопросы: материалы ХХI междунар. заоч. науч.-практ. конф. (29 июля 2013), Новосибирск. С. 94 – 99.
- Печинский, С.В. Влияние каротиноидов на иммунитет / С.В. Печинский, А.Г. Курегян // Хим.-фармац. журн. – 2013.– Т. 47. – №10. – С. 3 – 8 (4).
- Печинский, С.В. Структура и биологические функции каротиноидов / С.В. Печинский, А.Г. Курегян // Вопросы биологической, медицинской и фармацевтической химии. – 2013. – № 9. – С. 4-15.
- Писарев, Д.И. Разработка экспресс-метода определения каротиноидов в сырье растительного происхождения / Д.И. Писарев, О.О. Новиков, Т.А. Романова // Научные ведомости БелГУ Серия Медицина. Фармация. – 2010. – № 22 (93). – Вып. 12/2. – С. 119 – 122. (121)
- Сергеева, Н.В. Качественное и количественное изучение каротиноидов в некоторых галеновых препаратах / Н.В. Сергеева, Н.Д. Захарова // Фармация. – 1977. – №1. – С. 34-38.
- Усмонова, Ш.Х. Каротиноиды семян Bunium persicum (Boiss.) B. Fedtsch., произрастающего в Таджикистане / Ш.Х. Усмонова, Д.Э. Ибрагимов, Ш.Х. Халиков // Доклады академии наук Республики Таджикистан. 2010. №5. С. 377-381.
- A guide to carotenoid analysis in foods, Delia B. Rodriguez-Amaya , Washington, 2001. – Р. 14 – 19.
- Britton G., Liaaen-Jensen S., Pfander Carotenoids Handbook, Basel.: Springer Basel AG, 2004. – 646 р.
- Pilbrow, J. Carotenoid-binding proteins; accessories to carotenoid function / J. Pilbrow, D. Garama, Carne // Paper in Press. – 2012. – V.59. – № 190. – P. 1-3.
- Waksmundzka-Hajnos, М. Thin Layer Chromatography in Phytochemistry / M. Waksmundzka-Hajnos, J. Sherma, T. Kowalska, Boca Raton, London, New York .: CRC Press Taylor & Francis Group. – 2008. – Р. 558-566.[schema type=»book» name=»ВЫДЕЛЕНИЕ АСТАКСАНТИНА ИЗ ПАНЦИРЕЙ КРЕВЕТОК» description=»В статье приведены результаты выделения астаксантина из панцирей креветок методом жидкостной экстракции. Астаксантин был идентифицирован методом ТСХ с использованием четырех различных подвижных фаз. Спектрофотометрический анализ полученного образца каротиноида позволил идентифицировать в нем астаксантин.» author=»Курегян А.Г., Печинский С. В., Горошко М.В.» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-02-27″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_25.07.15_07(16)» ebook=»yes» ]

