Введение. Гидротехнические сооружения, суда, технические плавсредства, эксплуатирующиеся в морских условиях, имеют повреждения вследствие коррозионно-механических разрушений. Экономический ущерб складывается из следующих факторов: стоимости утраченных корпусных конструкций и оборудования, затрат на его ремонт и восстановление корпуса, убытков от простоя в работе в течение ремонта и многих других. В случае нарушения целостности танков и резервуаров морских судов с нефтью, газогидратами и иным сырьем для энергоресурсов, вероятно загрязнение окружающей среды. Существуют различные способы защиты морских судов и сооружений от коррозии, однако они не обеспечивают ее полное предотвращение и мало защищают от локальных разрушений [1].
Защитный потенциал является основным параметром, наиболее распространённой, электрохимической защиты наложенным током, который задается путем подачи тока на металлическую поверхность, а именно на корпус судна, понтона и колонн различных буровых установок. Однако приведенные меры оправдывают себя лишь на поверхности металла, степень защиты локальных дефектов, а именно свежеобразованной поверхности (СП) их вершин (поверхности без оксидной пленки), не известна.
Цель работы – исследование эффективности электрохимической защиты металла наложенным током от разрушения в местах локальных дефектов.
В задачи исследования входило:
-изучение влияния поверхностных оксидных пленок на потенциал стали 09Г2;
-хронопотенциометрические исследования — определение потенциала стали 09Г2 в локальных дефектах при подаче постоянного тока (аналогичного системе катодной защиты) в течение времени;
-разработка рекомендаций по значению защитного потенциала в системах электрохимической защиты наложенным током морских судов и сооружений.
Методика. Для экспериментов применяли модельный раствор (NaCl в дистиллированной воде), имитирующий морскую воду. Изучение влияния поверхностных оксидных пленок на потенциал стали 09Г2 (углеродистой качественной заэвтектоидной стали 09Г2 с содержанием 0,09% углерода и 2% марганца) проводили в 1,8%-ном растворе NaCl, что соответствует концентрации соли в морской воде Черного моря, и 3,0%-ном растворе NaCl, что соответствует концентрации соли в океанической воде.
В первой части эксперимента исследуемый образец погружался в ячейку с модельным раствором, так как при выдержке в морской воде металлы покрываются толстым слоем непрочных продуктов коррозии. Таким образом, было изучено влияние коррозии на потенциал металла с оксидной пленкой. Экспериментальные изменения потенциала металла в морской воде без оксидной пленки, то есть «внутри» локального дефекта, стало возможным благодаря установке для создания СП образца (рис. 1). Поэтому вторая часть эксперимента заключалась в снятии поверхностных пленок с образца. Затем происходило восстановление поверхностных и оксидных пленок. На протяжении всего эксперимента осуществлялось измерение потенциала, и строились зависимости изменения потенциала.
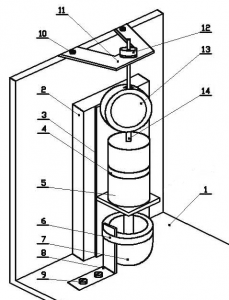 1 — основание;
1 — основание;
2 — стальная станина;
3 — стальные полозья;
4 — хомут;
5 — двигатель Д-25-1;
6 — кольцо-держатель;
7- электрохимическая ячейка;
8 — крепежный уголок;
9 — болт М10;
10 — болт М6;
11- кронштейн;
12 — крепежная шайба;
13 — индикатор нагрузки
часового типа;
14- шпилька.
Рисунок 1. Установка для создания свежеобразованной поверхности
Методика хронопотенциометрических исследований (ХПИ) основана на определении зависимости потенциала от времени при заданном значении тока [2]. Для проведения ХПИ лаборатория укомплектована следующими приборами: установкой для создания СП; вольтметром – DigitalMultimeterDT-838, в режиме DCV до 2000 мВ, для контроля значения потенциала на поверхности металла; источником постоянного тока LabTools 30V/15А – импульсным преобразователем сетевого напряжения в постоянном выходном регулируемом напряжении; полярографом универсальным ПУ-1; рабочим электродом: сталь 09Г2, хлорсеребряный электрод, вспомогательный электрод. Схема подключения приборов в лаборатории представлена на рис. 2.
Особенность установки для создания СП состоит в возможности определения потенциала металла без оксидной пленки (на СП металла, которая имитирует состояние вершины локального разрушения) в течение всего опыта, в отличие от известных из литературы попыток определить потенциал металла в краткий момент времени [2], в которых из-за быстрого образования оксидных пленок точность результатов была не высокая.

Рисунок 2. Схема подключения приборов.
1 – полярограф универсальный типа ПУ-1; 2 – вспомогательный электрод;
3 – электрохимическая ячейка; 4 – установка для создания свежеобразованной поверхности образца; 5 – источник постоянного тока LabTools 30V/15А; 6 – рабочий электрод, который исследуется в ходе эксперимента; 7 – хлорсеребряный электрод; 8 –вольтметр
С помощью полярографа универсального ПУ-1 на рабочий электрод подавался постоянный ток в течение времени (аналогичного системе катодной защиты). Рабочий электрод изготовлен из стали 09Г2, широко применяемой в судостроении. Изготовленные образцы для проведения исследований представляют собой диск диаметром 25 мм (0,002 м2) и толщиной 3-4 мм, с прикрепленной к ним соединительной ножкой и контактной клеммой. Торцевая и нижняя поверхности образца изолированы от электролита. Перед опытом рабочая поверхность зачищалась, шлифовалась и обезжиривалась [1].
Потенциал стали измерялся относительно электрода сравнения, имеющего в морской воде стабильный во времени потенциал, а именно – хлорсеребряного электрода сравнения [3], потенциал которого по отношению к водородному электроду при комнатной температуре равен + 200 мВ.
Результаты. Влияние поверхностных оксидных пленок на потенциал стали 09Г2.Изучение влияния поверхностных оксидных пленок на потенциал стали 09Г2, проведенное в растворах NaCl с концентрацией 1,8% и 3,0%, показало, что с увеличением солености модельного раствора значение потенциала незначительно возрастает, при этом на образцах без поверхностной оксидной пленки это выражено больше. Полученные значения потенциалов представлены в табл. 1 и на рис. 3.
Таблица 1.
Влияние поверхностных оксидных пленок на потенциал стали 09Г2.
| Модельный раствор
NaCl, % |
Значение потенциала стали 09Г2, мВ |
|
| образец с поверхностной оксидной пленкой | образец без поверхнос-тной оксидной пленки | |
| 1,8 | — 557,0 | — 528,0 |
| 3,0 | — 469,0 | — 486,0 |
После окончания снятия поверхностных и оксидных пленок потенциал образцов стремится принять первоначальное значение вне зависимости от раствора. Это объясняется повторной адсорбцией ионов хлора из электролита на поверхность металла, поступлением кислорода и образованием обновленного двойного электрического слоя на границе металл-электролит.
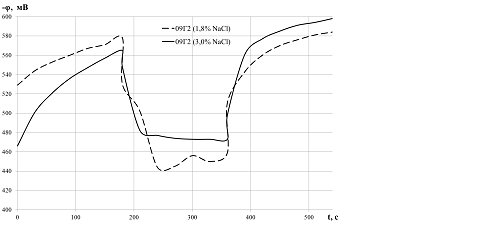
Рисунок 3. Изменение электрохимических потенциалов образцов стали марки 09Г2 в 1,8 % и 3,0 % растворах NaCl
При появлении свежеобразованной поверхности в процессе снятия поверхности с образца металл начинает активно взаимодействовать со средой. Непрерывное снятие поверхностных и оксидных пленок с образцов стали 09Г2 вызывает смещение электродного потенциала в положительном направлении, что можно объяснить торможением окислительного процесса на поверхности, а также механическим удалением адсорбента с поверхности металла.
Хронопотенциометрические исследования стали 09Г2. Были проведены ХПИ при постоянном значении тока в модельном растворе для сталей, применяемых в судостроении. Электрохимические характеристики металла в данных условиях характеризуют тенденцию его поведения при катодной защите металлических корпусных конструкций морских судов и сооружений. Результаты показаны на рис. 4.
Рассматривая рис. 4, можно сделать вывод о том, что и при катодной поляризации металла имеется разница в значении потенциала с пленкой и без поверхностной пленки, составляющая смещение потенциала на 100…700 мВ в катодную область.
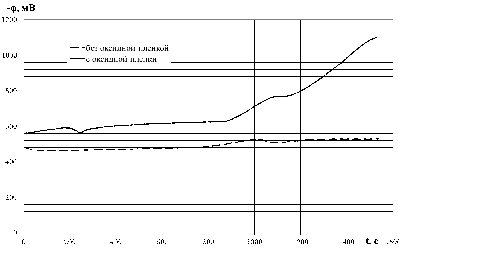
Рисунок 4. Результаты хронопотенциометричеcких исследований
на примере стали 09Г2.
Значительное смещение потенциала образца с оксидной пленкой в катодную область (порядка 600 мВ) свидетельствует об изменении процессов, происходящих в электрохимической ячейке. С начала опыта и до 1160 с его продолжения наблюдается кислородная деполяризация. В период времени 1150…1170 с на кривой виден перелом, который может свидетельствовать об установлении потенциала незаряженной поверхности стали на уровне 765…786 мВ относительно хлорсеребряного электрода сравнения. Далее происходит водородная деполяризация, которая может провоцировать выделение водорода и развитие локальных дефектов с последующим разрушением металла.
Потенциал образца со свежеобразованной поверхностью без оксидной пленки на протяжении всего эксперимента колеблется в пределах 463…529 мВ и характеризуется непрерывным обновлением поверхности, поэтому оксидная пленка не успевает образовываться. Следовательно, влияние катодной поляризации минимально сказывается на свежеобразованную поверхность. Однако, образующийся при водородной деполяризации газообразный водород может негативно воздействовать на локальные дефекты и способствовать их ускоренному разрушению.
Выводы. Проведенные исследования показывают, что изменение потенциала металла в отсутствии поверхностных пленок в значительной мере обусловлено адсорбцией ионов из раствора электролита. В момент появления свежеобразованной поверхности адсорбция заряженных частиц из раствора затруднена, и электродный потенциал металла не меняется.
Исходя из вышесказанного, чрезвычайно важно устанавливать защитный потенциал в системах катодной защиты морских судов и сооружений на уровне потенциала незаряженной поверхности. Таким образом, обеспечивается минимальная электростатическая адсорбция агрессивных ионов из морской воды, а также не допускается выделение газообразного водорода. Металл оказывается незаряженным, приостанавливаются процессы коррозии и растрескивания, наблюдается отсутствие эффекта Ребиндера.
Список литературы:
- Дамаскин Б.Б., Петрий О.А. Введение в электрохимическую кинетику. М.: Высш. школа, 1975. 416 с.
- Ожиганов Ю.Г. Коррозионная усталость металлов, применяемых в судовом машиностроении. Автореферат дисс. д-ра техн.наук, Севастополь. 43 с.
- Ожиганов Ю.Г., Ожиганов О.Ю., Лебедь Е.К., Иванова О.А. Способ изготовления пористого хлорсеребряного электрода сравнения. Патент № 93240, Украина. Заявл. 17.11.2008г., опубл.25.01.2011 г.[schema type=»book» name=»ХРОНОПОТЕНЦИОМЕТРИЧЕСКИЕ ИССЛЕДОВАНИЯ ПОВЕРХНОСТИ СУДОСТРОИТЕЛЬНОЙ СТАЛИ 09Г2 В МОРСКОЙ ВОДЕ» author=»Родькина Анна Владимировна, Жданова Галина Владимировна, Ковальчук Юлия Лукинична» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-03-30″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_30.04.2015_04(13)» ebook=»yes» ]

