Известно, что оксидативный стресс или неконтролируемое усиление продукции активных формы кислорода (АФК) и свободных радикалов является важным патогенетическим фактором развития многих заболеваний человека: сердечно-сосудистых, бронхолегочных, онкологических, ревматических, нейродегенеративных и т.д. [7]. В результате активации свободнорадикальных процессов происходит окислительная модификация различных биомолекул (липидов, белков, нуклеиновых кислот и др.), что, в конечном итоге, приводит к повреждению и гибели клеток отдельных тканей и органов [2].
В норме регуляция продукции АФК и свободных радикалов в тканях и органах человека осуществляется многоуровневой антиоксидантной системой [4]. Однако, несмотря на высокую эффективность антиоксидантной системы, она не всегда способна защитить организм человека от развития оксидативного стресса. В связи с этим большое внимание уделяется разработке новыхспособов изучения антиоксидантного потенциала организма человека для оценки его функциональных возможностей.
В настоящее время для оценки функционального состояния антиоксидантной системы человека наряду с определением содержания отдельных антиоксидантов в плазме и клетках крови используют показатель, обозначаемый как антиоксидантная активность (АОА) плазмы крови. АОА плазмы (сыворотки) крови – это интегральный показатель, отражающий ее способность противодействовать развитию свободнорадикальных реакцийв какой-либо модельно системе[3]. Основными компонентами таких модельных систем являются система генерации радикалов и субстрат (или молекула-мишень), который подвергается свободнорадикальному окислению. Инициирование образования радикалов в модельных системах может осуществляться различными способами, например, с помощью ионов металлов переменной валентности, УФ-облучения, азосоединений, ферментов, смеси метмиоглобина с Н2О2. В качестве субстрата окисления могут выступать гомогенаты тканей и органов, суспензии модельных и биологических мембран, эмульсии ненасыщенных жирных кислот, красители [3, 11]. Добавление в модельную систему плазмы крови, содержащей различные водо- и жирорастворимые антиоксиданты, приводит к уменьшению образования радикалов и торможению окисления субстрата,которое регистрируется с помощью различных методов: хемилюминесценции (ХЛ), спектрофотометрии, флуориметрии, полярографии и т.д.[3, 4,11]. Для количественной оценки величины АОА плазмы крови ее выражают через концентрацию стандартного антиоксиданта. В качестве стандартного антиоксиданта часто используется тролокс (6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновая кислота) – водорастворимый структурный аналог витамина Е или какой-либо другой антиоксидант [9].
Существуетмного способов определения АОА плазмы крови. Один из распространенных подходов для определения АОА плазмы крови основан на генерации водорастворимых пероксильных радикалов (RO2•). В качестве источника RO2• обычно применяют водорастворимые азосоединения, например, 2,2’-азобис(2-амидинопропан) дигидрохлорид (АБАП). При добавлении АБАП в водную среду он подвергается термическому распаду с постоянной скоростью реакции. Возникающие в результате этого процесса радикалы взаимодействуют скислородом, с образованием RO2•. Последние индуцируют окисление люминола, которое сопровождается ХЛ. В присутствии плазмы крови наблюдается ингибирование ХЛ люминола и появление латентного периода, длительность которого прямо пропорциональна АОА или радикалперехватывающей активности образца [9].
Используя описанный подход, J.T. Uotilaи соавт. [14] установили, что процентный вклад отдельных антиоксидантов визмеряемую величину АОА плазмы кровидля здоровых людей составляет: урата- 43±5% , аскорбата- 1±1%, витамина Е — 3±1%, SH-групп белков — 19±6%, неидентифицированных антиоксидантов — 34±4%. Авторы работы обнаружили, что развитие преэклампсии у беременных женщин сопровождается значительным увеличением АОА их плазмы крови, которое обусловлено повышением содержания в ней мочевой кислоты и неидентифицированных антиоксидантов. E.J. Jarenoи соавт. [8] выявили уменьшение АОА сыворотки крови у детей с синдромом приобретенного иммунодефицита по сравнению со здоровыми детьми. Понижение АОА сыворотки крови коррелировало с повышением содержания в ней уровня продуктов пероксидного окисления липидов. Уменьшение АОА плазмы кровитакже обнаружено у добровольцев после продолжительного вдыхания сигаретного дыма [15].
Другая известная система для определения АОА плазмы крови включает метмиоглобин, Н2О2 и 2,2’-азинобис(3-этилбензтиазолин-6-сульфокислоту) (АБТС) в виде диаммонийной соли [11]. Взаимодействие метмиоглобина с Н2О2 приводит к образованию радикалов феррилмиоглобина. В результате реакции радикалов феррилмиоглобина с АБТС они восстанавливаются до метмиоглобина, а АБТС окисляется с образованием катион-радикала АБТС (АБТС•+), имеющего максимумы поглощения в длинноволновой области спектра при 660, 734 и 820 нм. Введение в систему плазмы крови сопровождается уменьшениемобразования(поглощения) катион-радикалов и появлением латентного периода в процессе окисления АБТС. Установлено, что вклад отдельных антиоксидантов плазмы крови в ее общую АОА, определяемую с помощью данной модельной системы, составляет: альбумина — 43%, урата- 33%, аскорбата- 9%, a-токоферола — 3%, билирубина — 2% и остальных антиоксидантов — 10%. Обнаружено понижение АОА плазмы крови у пациентов с хронической обструктивной болезнью легких (ХОБЛ) и курильщиков [10], что связывают с уменьшением содержания в ней отдельных ингибиторов — аскорбиновой кислоты, витамина Е, b-каротина и др. Описаны модификации этого метода, в которых для получения АБТС•+ вместо метмиоглобина и Н2О2 используется персульфат калия.
Несмотря на большую популярность способов определения радикалперехватывающей активности плазмы крови с использованием АБАП и АБТС, указанные подходы, по-видимому, не являются в полной мере адекватными, поскольку взаимодействие сRO2• и АБТС•+ не отражает способность антиоксидантов плазмы крови защищать субстрат окисления от физиологически важных активных форм кислородаи азота,липидных радикалови т.д., которые являются одними из инициаторовсвободнорадикальных реакций invivo.
Нами для определения АОА плазмы крови предложена хемилюминесцентная модельная система, основными компонентами которой являются гемоглобин (Hb), пероксид водорода и люминол (система Hb-H2O2-люминол) [5]. Взаимодействие гемоглобина и Н2О2 в этой системе приводит к частичному разрушению гема и образованию радикалов-инициаторов. Основными радикалами-инициаторами окисления люминола в указанной модельной системе являются радикалы феррилгемоглобина и гидроксильные радикалы. Величину АОА плазмы крови выражают через концентрацию антиоксиданта сравнения, в качестве которого используется аскорбиновая кислота.
С помощью модельной системы Hb-H2O2-люминол зарегистрировано изменение АОА плазмы крови при ряде заболеваний, сопровождающихся усилением свободнорадикальных реакций. Так, например, понижение АОА плазмы крови наблюдалось при ХОБЛ в стадии обострения и ремиссии (рис. 1).
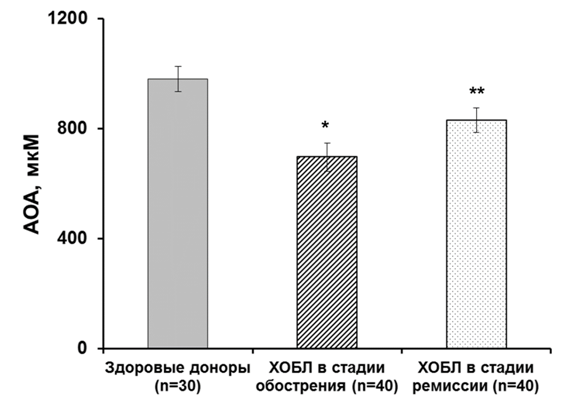
Рисунок 1. АОА плазмы крови у больныхХОБЛ. * —p<0,001; **—p<0,05 по отношению к группе здоровых доноров.
Важным направлением современной медицины является использование антиоксидантов для коррекции антиоксидантного статуса организма. При этом особое значение приобретает исследование динамики АОА плазмы крови, которая в некоторых случаях позволяет судить, насколько быстро антиоксидант поступает в кровоток и насколько долго сохраняется антиоксидантный эффект. С помощью системы Hb-H2O2-люминол была исследована динамика АОА плазмы крови при введении в организм человека некоторых антиоксидантов [1, 5]. В частности, обнаружено, что после перорального приема добровольцами 2 г аскорбиновой кислоты максимальное увеличение АОА плазмы крови наблюдалось через 1 ч и составило 77%. Кроме того, было изучено влияние на АОА плазмы крови добровольцев однократного и длительного приема антиоксидантной пищевой добавки «МагнумС» (ЗАО «Витамакс-ХХI Век», Россия), которая в качестве основных антиоксидантных компонентов содержит витамин С в этерифицированной форме и смесь биофлавоноидов. Установлено, что в случае длительного приема этого препарата (по 1 капсуле два раза в день в течение 30 дней) максимальное увеличение АОА плазмы крови наблюдалось на 14-е сутки. После прекращения приема препарата происходило постепенное снижение этого показателя до исходного уровня. Таким образом, изучение динамики АОА плазмы крови может оказаться полезным при выборе доз и определении оптимальных сроков для профилактического или лечебного применения антиоксидантов и биологически активных добавок к пище с антиоксидантными свойствами.
Наибольший практический интерес представляет применение антиоксидантов при различных патологических процессах, сопровождающихся развитием оксидативного стресса. В частности, при доклинических испытаниях биофлавоноидного препарата «Диквертин»(НПО«Вилар», Россия) с использованием экспериментальных моделей свободнорадикальнойпатологии — внешнего общего g-облучения мышей и тетрахлорметанового гепатита крыс – было обнаружено следующее. Развитие оксидативного стресса сопровождалось не только повышением содержания продуктов липидной пероксидации в плазме крови и печени животных, но и понижением АОА плазмы крови. Введение дигидрокверцетина приводило к уменьшению уровня этих продуктов и повышению АОА плазмы крови [12, 13]. Клиническая апробация диквертина как антиоксидантного средства проводилась при лечении больных острой пневмонией [6]. Были выделены три группы больных острой пневмонией: 1-я — контрольная, получавшая стандартную терапию; 2-я – группа сравнения, получавшая стандартную терапию и антиоксидантный комплекс (АОК) -a-токоферола ацетат и тиосульфат натрия в течение двух недель; и 3-я — опытная, которая на фоне основной терапии получала диквертин. Обнаружено, что в острый период заболевания (1–3-е сутки) содержание продуктов ПОЛ в плазме крови у больных всех трех групп было более высоким, чем у здоровых людей. Включение в комплексную терапию больных 2-й и 3-й групп антиоксидантов приводило к снижению содержания продуктов липидной пероксидации до уровня нормы уже в подострый период заболевания (10-14-е сутки), в то время как у больных 1-й группы оно оставалось выше нормы. На рис. 2 приведены результаты изучения АОА плазмы крови.
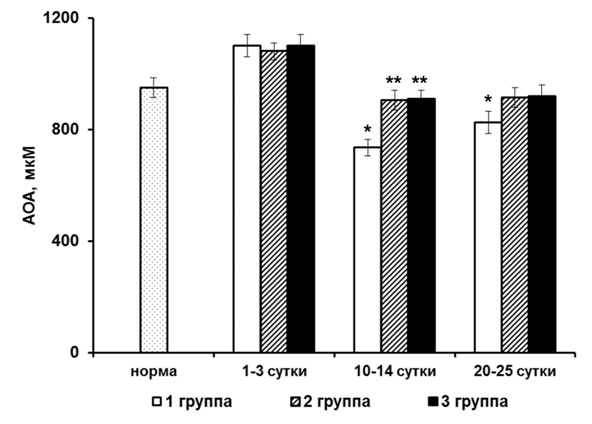
Рисунок 2. АОА плазмы крови у больных острой пневмонией. * —p<0,05 по отношению к норме; ** —p<0,05 по отношению к больным 1-й группы в соответствующем периоде заболевания.
Несмотря на проводимое лечение, у больных 1-й группы, не получавших антиоксиданты, АОА плазмы крови была снижена в подострый период заболевания и в фазу клинического выздоровления (20-25-е сутки). У больных, получавших антиоксиданты, АОА плазмы крови была в пределах нормы в течение всего периода наблюдения, что свидетельствует об увеличении способности их организма противостоять оксидативному стрессу.Важно отметить, что у больных 2-й и 3-й групп, также наблюдалось более быстрое исчезновение клинических признаков легочного воспаления, чем у больных 1-й группы.
Таким образом, представленные результаты показывают, что АОА плазмы крови является важным показателем для контроля за функциональнымсостоянием антиоксидантной системы и эффективностью антиоксидантной терапии.
Список литературы:
- Бабенкова И.В. Влияние антиоксидантного препарата на основе биофлавоноидов и витамина С на антиоксидантную активность плазмы крови /И.В. Бабенкова, Ю.О.Теселкин, А.В.Асейчев, Б.Х. Ягмуров // Вопр. питания. – 1999. — № 3. – С. 9-
- Владимиров Ю.А. Свободные радикалы и клеточная хемилюминесценция / Ю.А.Владимиров, Е.В. Проскурнина // Успехи биол. хим. 2009. — Т.49. — С.341–388.
- Клебанов Г.И. Антиоксидантная активность сыворотки крови / Г.И. Клебанов, Ю.О.Теселкин, И.В. Бабенкова, О.Б.Любицкий, Ю.А. Владимиров // Вестн. РАМН. — — Т. 99, № 2.- С. 15-22.
- Попов И.Н. Антиокислительный гомеостаз человека: методы изучения, критерии оценки (обзор литературы) / И.Н.Попов, Г.Левин, А.К.Аносов, А.А.Маркин, Б.В.Моруков // Вестник РГМУ. – 2013. – № 2. – С. 69-
- Теселкин Ю.О. Определение антиоксидантной активности плазмы крови с помощью системы гемоглобин-пероксид водорода-люминол / Ю.О. Теселкин, И.В.Бабенкова, О.Б.Любицкий, Г.И. Клебанов, Ю.А. Владимиров // Вопр. мед. химии. — — Т. 44, № 1. — С. 70-76.
- Теселкин Ю.О. Использование нового антиоксидантного средства Диквертина при лечении больных острой пневмонией /Ю.О.Теселкин, И.В.Бабенкова, В.Г.Новоженов, В.К. Колхир, В.А. Быков, Н.А. Тюкавкина, И.А. Руленко, Ю.А. Колесник // Вопр. биол., мед. и фарм. химии. – 1999. – № 1. – С. 36-
- Менщикова Е.Б. Окислительный стресс: патологические состояния и заболевания/ Е.Б.Менщикова, Н.К.Зенков, В.З.Ланкин,И.А. Бондарь, В.А.Труфакин– Новосибирск: АРТА, 2008. — 284 с.
- Jareno E.J.Serum malondialdehyde in HIV seropositive children/ E.J.Jareno, F.Bosch-Morell, R.Fernandez-Delgado,J. Donat, F.J.Romero // Free Radic. Biol. Med. —V. 24, № 3.- P. 503-506.
- Magalhaes L.M. Methodological aspects about in vitroavaluation of antioxidant properties /L.M. Magalhaes, M.A.Segundo, S.Reis, J.L.F.C. Lima // Anal. Chim. Acta. – 2008. – V. 613, № 1. – P. 1-
- Rahman I.Role of oxidants/antioxidants in smoking-induced lung diseases/ I. Rahman, W.MacNee // Free Radic. Biol. Med. — — V. 21, № 5. -P. 669-681.
- Rice-Evans C. Total antioxidant status in plasma and body fluids/ C.Rice-Evans, N.J. Miller // Methods in enzymology. Oxygen radicals in biological systems / Ed. L. Packer. — San Diego, California: Academic Press, Inc., 1994. — 234, Part D.- P. 279-293.
- O.Influence of dihydroquercetin on the lipid peroxidation of mice during post-radiation period /Yu.O.Teselkin, I.V.Babenkova, N.A.Tjukavkina,I.A. Rulenko, Yu.A. Kolesnik, V.K.Kolhir, A.A. Eichholz // Phytother. Res. – 1998. – V. 12. – P. 517-519.
- O.Dihydroquercetin as a means of antioxidativedefence in rats with tetrachloromethanehepatitis /Yu.O.Teselkin,I.V.Babenkova, V.K.Kolhir, A.I. Baginskaya, N.A. Tjukavkina, Y.A. Kolesnik, I.A. Selivanova, A.A. Eichholz// Phytother. Res. – 2000. – V. 14, № 3. – P. 160-162.
- Uotila J.T.The total peroxyl radical-trapping ability of plasma and cerebrospinal fluid in normal and preeclampticparturients/ J.T.Uotila,A.L.Kirkkola, M. Rorarius,R.J. Tuimala, T. Metsä-Ketelä// Free Radic. Biol. Med. —V. 16, № 5. -P. 581-590.
- M.Vitamin C prevents the acute atherogenic effects of passive smoking/ M.M.Valkonen, T.Kuusi // Free Radic. Biol. Med. — 2000. — V. 28, № 3.-Р. 428-436.[schema type=»book» name=»ОПРЕДЕЛЕНИЕ АНТИОКСИДАНТНОЙ АКТИВНОСТИ ПЛАЗМЫ КРОВИ В ЭКСПЕРИМЕНТАЛЬНЫХ И КЛИНИЧЕСКИХ ИССЛЕДОВАНИЯХ» description=»В работе дается экспериментальное и клиническое обоснование определения антиоксидантной активности плазмы кровидля оценки функционального состояния антиоксидантной системы организмачеловека в условиях развития оксидативного стресса и эффективности антиоксидантной терапии.» author=»Бабенкова Ирина Владимировна, Буравлев Евгений Александрович, Буравлева Кристина Владимировна, Теселкин Юрий Олегович» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-03-30″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_30.04.2015_04(13)» ebook=»yes» ]

