Введение
В настоящее время возрастает интерес к глубокой переработке растительного и животного сырья с получением компонентов, обладающих высокой питательной ценностью. Одним из видов сырья, могущим служить основой для выделения таких продуктов, является горох.
Горох служит источником белка для потребления человеком и животными как в форме самих семян, так и в виде продуктов их переработки. В зерне гороха содержится (в %): белка – 24-31, крахмала – 50-60, жиров – 2-3, сахаров – 4-6, минеральных веществ – 3,5-3,6, пектиновых веществ – 1,5-2,8. Белки семян гороха представлены альбуминами, глобулинами (вицилинами, легуминами, конвицилином) и рядом второстепенных (по количественному соотношению) компонентов [1, с. 105]. У различных сортов гороха содержание альбуминов колеблется от 8 до 21,5 %, глобулина – от 58,6 до 76,6%, глютенина – от 10,0 до 19,8% [2, с. 416]. Аминокислотный состав компонентов белковых фракций идентичен, однако по количественному содержанию отдельных аминокислот они различаются. Для альбуминов характерно высокое содержание серосодержащих аминокислот, лизина, треонина, а также аспарагиновой и глутаминовой кислот. Глобулиновая фракция содержит больше незаменимых аминокислот [3, с. 13; 4, с. 448]. Кроме белковых веществ, семена гороха содержат и другие азотистые соединения, основная масса которых представлена свободными аминокислотами (до 4-5% веса зерна, т. е. 12-15% общего азота). Из углеводов в состав зерна гороха входят крахмал, сахароза, гемицеллюлоза, клетчатка, пектиновые вещества и низкомолекулярные сахара [5, с. 105].
Из семян гороха получают гороховую муку и концентрат белка. Производство концентрата белка заключается в извлечении белков из гороховой муки в водной среде при температуре 30-50 °С, при рН от 8 до 10 с последующим удалением нерастворимых веществ центрифугированием. Затем белки осаждают путем добавления кислоты до изоэлектрической точки (~ рН 4,5), при этом осадок содержит преимущественно глобулины и нерастворенные сахара, а экстракт содержит альбумины и растворенные сахара. Затем фракции можно нейтрализовать (рН 7) и высушить распылением с получением концентрированного белка. Однако при таком процессе белковый продукт имеет недостаточную чистоту, в связи с чем перед высушиванием проводят дополнительную очистку методом ультрафильтрации, при этом в концентрате остаётся очищенный высокомолекулярный белок [6, c. 136; 7, c. 150]. Пермеат и диафильтрат, обогащенные сахарами и низкомолекулярными белками, являются отходами процесса. Одним из путей их утилизации может быть использование их в качестве основы для получения питательной микробной среды с целью получения кормового белка дрожжей.
Микробная биомасса может служить хорошей белковой добавкой для кормления домашних животных, птиц и рыб. При выборе микроорганизма учитывают удельную скорость роста и выход биомассы на данном субстрате, стабильность при поточном культивировании, величину клеток. Для получения микробного белка используют как дрожжи, так и бактерии, однако, вследствие ряда технологических преимуществ, получение кормового дрожжевого белка рассматривают как более перспективный процесс.
Кормовые дрожжи получают с использованием доступных, дешевых углеродсодержащих видов сырья, таких как гидролизаты древесных и сельскохозяйственных отходов, меласса, послеспиртовая барда, отходы производства синтетических моющих веществ, парафины нефти [8].
Дрожжи Candida utilis рассматривают как один из наиболее интересных микроорганизмов, содержание белка в биомассе которых может составлять до 50% от сухой массы, а остальные соединения представлении липидами, полисахаридами и т.д. Белок Candida utilis имеет сбалансированный аминокислотный состав, а сама культура способна метаболизировать широкий спектр сахаридов с накоплением высокой концентрации биомассы. Также для данной культуры не является обязательным наличие какого-либо дорогостоящего источника углерода, то есть возможно культивирование с использованием отходов переработки растительного сырья [9, c. 113].
Таким образом, получение и очистка белковых продуктов из гороховой муки сопровождается образованием отхода, обогащенного низкомолекулярными белками и растворимыми сахарами (горохового пермеата), который необходимо утилизировать. Состав данного отхода и характеристики культуры Candida utilis позволяют предположить, что данный пермеат может быть использован в качестве питательной среды для получения дрожжевой биомассы. В связи с этим, целью настоящей работы стало изучение ростовых характеристик дрожжей Candida utilis на гороховом пермеате, а также исследование влияния на них дополнительных минеральных компонентов.
Материалы и методы
В качестве микробного объекта в настоящей работе использовались дрожжи Candida utilis.
Контрольная питательная среда для культивирования имела следующий состав (среда Ридера): (NH4)2SO4 – 3,0 г/л; MgSO4 – 0,7 г/л; NaCl – 0,5 г/л; K2HPO4 – 1,0 г/л; KH2PO4 – 0,1 г/л; сахароза – 20,0 г/л, дрожжевой экстракт – 0,5 г/л. В качестве экспериментальных питательных сред использовали гороховый пермеат (ГП) или гороховый пермеат с добавлением солей среды Ридера (ГПС). pH во всех питательных средах составлял 5,5-6. Стерилизацию среды проводили в лабораторном автоклаве при 0,7 ати в течение 30 минут.
Содержание белка в растворах определяли с помощью биуретового метода, общих углеводов определяли — фенол-серным методом (метод Дюбуа). Содержание белка и углеводов в исследуемых растворах рассчитывали по соответствующим калибровочным графикам по формуле:
С = X*Р
где С – концентрация белковых веществ или углеводов, г/л; X – концентрация углеводов в проанализированном разведении, найденная по калибровочному графику, г/л; Р – разведение анализируемого раствора.
Содержание сухих веществ определяли по изменению массы бюкса после высушивания навески при 102 0С в сухожаровом шкафу. Содержание влаги W (мас. %) рассчитывали по формуле:
m1 –m2
W = ———— *100
m1 – m0
где m0 – масса пустого бюкса, г; m1 – масса бюкса с навеской биомассы до высушивания, г; m2 – масса бюкса с навеской биомассы после высушивания, г.
Содержание сухих веществ СВ (масс. %) рассчитывали по формуле:
СВ = 100 – W
Определение общего азота проводили микрометодом Къельдаля. Содержание общего азота рассчитывают по формуле:
WN = 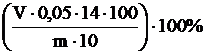 ,
,
где WN – содержание азота в пробе; V – объем серной кислоты, израсходованной на титрование, мл; 0,05 – концентрация титранта, мг-экв/мл; 14 – количество азота, мг, которое связывает 1 мг-экв серной кислоты; 100 – объем раствора в мерной колбе, мл; 10 – количество раствора, взятого для отгона аммиака, мл; m – навеска материала, мг.
Количество сырого протеина рассчитывали по формуле:
Wпротеин = N∙6,25,
где 6,25 – эмпирический коэффициент.
Культивирование проводили в конических колбах объемом 250 мл (объем питательной среды – 100 мл) на качалке при температуре 30 0C. Засев инокулята проводили из посевной колбы в количестве 5% от объема питательной среды в колбе. Пробы отбирали каждые 2-3 ч, накопление биомассы определяли спектрофотометрическим методом при длине волны 505 нм, а также методом прямого подсчета в камере Горяева.
Отделение культуральной жидкости от биомассы в конце культивирования проводили центрифугированием при 6000 об/мин в течение 15 минут.
Экспериментальная часть.
Для определения ростовых характеристик дрожжей Candida utilis в зависимости от используемых источников углерода и азота были приготовлены питательные среды различного состава. Контрольная среда Ридера в качестве дополнительного источника питания содержит дрожжевой экстракт, а в качестве источника углерода — сахарозу. Экспериментальные среды содержали гороховый пермеат в качестве единственного источника углерода, для изучения влияния минеральных солей на рост дрожжей была приготовлена среда, содержащая помимо горохового пермеата минеральные соли среды Ридера. Изучение состава питательной среды на основе горохового пермеата показало, что она содержит 19,8 г/л общих сахаров и 8,3 г/л белковых веществ.
Полученные кривые роста представлены в виде зависимости оптической плотности суспензии клеток от продолжительности культивирования (рис. 1а) и в полулогарифмических координатах (рис. 1б).
Кривые роста во всех случаях имеют характерную s-образную форму. На кривых можно выделить лаг-фазу, фазу экспоненциального роста, фазу замедленного роста и стационарную фазу. Продолжительность лаг-фазы наибольшая при культивировании на гороховом пермеате, что, вероятно, связано с неадаптированностью культуры к данному субстрату. Продолжительность фазы экспоненциального роста при культивировании на всех средах приблизительно одинакова, время до наступления стационарной фазы составляет 22-26 часов. Для контрольной среды стационарная фаза наступает быстрее, что связано с более быстрым исчерпанием углеродного субстрата. Интенсивный рост культуры на экспериментальных средах позволяет сделать первоначальное заключение о том, что гороховый пермеат может быть использован в качестве основы питательной среды для роста дрожжей Candida utilis.
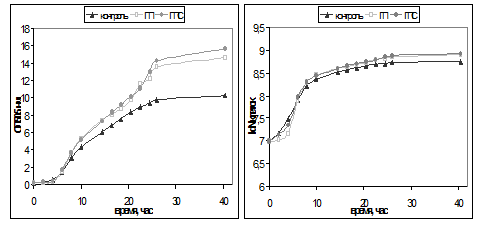
Рис. 1. Кривые роста для контрольной среды и экспериментальных сред: а) выраженные в единицах оптической плотности; б) в полулогарифмических координатах
В таблице 1 представлены ростовые характеристики культуры, рассчитанные по кривым роста в логарифмических координатах. Как видно из полученных данных, все использованные в эксперименте среды позволяют достичь достаточно высокой скорости роста Candida utilis (0,20-0,37). Следует отметить, что значение удельной скорости роста для контрольной среды ниже, чем в экспериментальных средах, что свидетельствует о большей эффективности использования дрожжами углеводов и белковых веществ в составе горохового пермеата. Также можно отметить, что при добавлении в гороховый пермеат минеральных солей, ростовые характеристики культуры повышаются, по сравнению с контрольной пробой, но не повышаются в сравнении с гороховым пермеатом без добавления солей.
Таблица 1.
Ростовые характеристики дрожжей при их культивировании на контрольной и экспериментальной средах
|
№ колбы |
μ, ч-1 | Продолжительность лаг-фазы | Время до наступления стационара, ч |
Время генерации, ч |
| 1 | 0,20 | 4 | 22,5 | 1,5 |
| 2 | 0,37 | 4,5 | 26 | 0,8 |
| 3 | 0,28 | 5 | 24,5 | 1,1 |
Как следует из табл. 2, степень усвоения питательных веществ варьирует в зависимости от состава среды. Степень усвоения углеводного субстрата при культивировании на контрольной среде приближается к максимальному, в то время как при культивировании на экспериментальных средах она составляет порядка 75 %. Такое различие, возможно, связано с тем, что гороховый пермеат является сложной средой природного происхождения, содержащей смесь моно-, ди- и олигосахаров, не все типы которых могут усваиваться дрожжевой культурой. Культура, растущая на гороховом пермеате, усваивает около четверти белковых веществ, содержащихся в исходной среде, культура, растущая на гороховом пермеате с добавлением солей, растворенный белок не усваивает. Это можно объяснить тем, что более предпочтительным источником азота для кандиды является азот в минеральной форме (сульфат аммония), и при его наличии в среде культура будет потреблять именно его, а не белковые компоненты в составе горохового пермеата, что происходит во второй колбе.
Таблица 2.
Степень усвоения питательных компонентов среды
| Питательная среда | Степень усвоения белковых компонентов, % | Степень усвоения сахаров, % |
| Контроль | — | > 95 |
| ГП | 26,5 | 74,2 |
| ГПС | 0 | 75,8 |
Дрожжевая биомасса используется преимущественно в кормовых целях как источник микробного белка, поэтому необходимо оценить качество биомассы, получаемой при культивировании дрожжей на средах с гороховым пермеатом, и сравнить его с биомассой, полученной при культивировании на контрольной среде (табл. 3).
Таблица 3.
Накопление биомассы и содержание в ней сырого протеина при росте на различных питательных средах
| Питательная среда | Накопление биомассы, г/л | Содержание сырого протеина в биомассе, % |
| Контроль | 3,1 | 51,0 |
| Гороховый пермеат | 4,5 | 55,9 |
| Гороховый пермеат с минеральными солями | 4,4 | 54,4 |
По сравнению с контрольной питательной средой накопление биомассы увеличивается в 1,4-1,5 раз при использовании сред на основе горохового перемеата. Эти данные свидетельствуют о содержании в гороховом пермеате веществ, благоприятно влияющих на рост и развитие культуры дрожжей.
Высокобелковой считается биомасса, содержащая не менее 40% сырого протеина. В биомассе, полученной на экспериментальных средах, его содержится больше, чем в контрольной среде (до 55,9%). Таким образом, биомасса Candida utilis, полученная при культивировании на гороховом пермеате, отвечает требованиям, предъявляемым к кормовой биомассе по содержанию сырого протеина.
Выводы
В ходе исследований было установлено, что пермеат, полученный при ультрафильтрации экстракта из гороховой муки, может быть использован в качестве питательной среды для роста микроорганизмов Candida utilis. Удельная скорость роста дрожжей на экспериментальных средах увеличивается по сравнению с контрольной средой (среда Ридера): в случае с гороховым пермеатом — практически в 2 раза, в случае с гороховым пермеатом с добавлением минеральных солей — в 1,5 раза. Степень усвоения сахаров в составе горохового пермеата составляет около 75 %, при этом культура, растущая на пермеате без добавления минеральных солей, потребляет также содержащийся в пермеате низкомолекулярный белок. Наблюдаемое в ходе эксперимента увеличение ростовых характеристик может быть связано с богатым биохимическим составом пермеата и наличием компонентов, необходимых для усиленного роста культуры.
Также показано, что накопление биомассы на средах, содержащих гороховый пермеат, в 1,5 раза выше такового для контрольной среды. Биомасса, полученная при культивировании дрожжей с использованием горохового пермеата, содержит 54-56% сырого протеина, что позволяет считать её высокобелковой.
Список использованной литературы:
- Клименко, В. Г. Белки семян бобовых растений / В.Г. Клименко // Растительные белки и их биосинтез. – М.: Наука, 1975. – С. 97-116.
- Володин, В. И. Фракционный и аминокислотный состав высоко- и низкобелковых линий гороха / В. И. Володин, В. И. Масалова // Научные труды. Т.3. – Орел, 1971. – С. 413-421.
- Володин, В. И. Изменчивость и аминокислотный состав белковых фракций семян гороха / В. И. Володин, Р. Ф. Черненькая, Н. Н. Зеленская // Научно-технический бюллетень № 30. ВНИИ зернобобовых и крупяных культур. – Орел, 1983. – С. 13-15.
- Hurich, J. Comparative study of seed proteins in the genus Pisum.2. Amino acid composition of different protein fractions / J. Hurich, H. Parzysz, J. Przybylska // Genet. Polonica. – 1977. – V. 18, № 3. – P. 241-252.
- Королева, О. С. Аминокислотный состав глобулинов различных сортов и форм гороха / О. С. Королева, Т. Я. Пелагейчик, Е. Р. Уральская [и др.] // Весцi АН БССР. Сер. бiл. н. – 1991. – № 6. – С. 103-106.
- Mondor, M. Production of pea protein concentrates by ultrafiltration: Influence of hollow-fibre module / Martin Mondor, Olga Tuyishime, Hélène Drolet // Innovative Food Science and Emerging Technologies – 2012. — V. 14 — Р. 135–138.
- Gao, L. Pilot Scale Recovery of Proteins from a Pea Whey Discharge by Ultrafiltration / Lei (Leigh) Gao, Khai D. Nguyen and Alphonsus C. Utioh // Lebensm.-Wiss. u.-Technol. – 2001. – V.34 — Р. 149 — 158.
- Сайт Биотехнология. [Электронный ресурс]. – Раздел «Промышленная биотехнология» Производство белка микроорганизмов , 1995-2013 — . – Режим доступа — , свободный. — Загл с экрана.
- Kim, J.K. Production of Candida utilis biomass on molasses in different culture types / Bum-Kyu Lee, Joong Kyun Kim // Aquacultural Engineering – 2001. – V. 25, Р. 111 – 124.[schema type=»book» name=»ИСПОЛЬЗОВАНИЕ ПЕРМЕАТА, ПОЛУЧЕННОГО ПРИ УЛЬТРАФИЛЬТРАЦИИ ЭКСТРАКТА ГОРОХОВОЙ МУКИ, ДЛЯ КУЛЬТИВИРОВАНИЯ CANDIDA UTILIS» author=»Хабибулина Наталья Викторовна, Красноштанова Алла Альбертовна, Адучиева Валерия Дорджиевна» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-03-30″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_30.04.2015_04(13)» ebook=»yes» ]

