Адаптационные и эволюционные изменения в популяциях основываются на генетическом разнообразии, которое вместе с тем выступает одним из важнейших факторов их устойчивости. Величина генетического разнообразия популяций определяется сложным переплетением взаимодействий основных факторов микроэволюции – естественного отбора, генных мутаций, случайного дрейфа и миграции генов [1, 12]. При этом объем генетического разнообразия и распределение его внутри и между популяциями часто связаны с такими факторами как величина ареала и система воспроизведения видов. Тип скрещивания вида является главной детерминантой в распределении генетической изменчивости внутри- и между популяциями и, таким образом, влияет на большинство эволюционных процессов. Известно, что перекрестноопыляющиеся виды растений имеют более высокий уровень разнообразия по сравнению с самоопыляющимися, причем большую его часть составляет внутрипопуляционная компонента [15]. Аутбредные виды формируют панмиктичные популяции, в которых высокий уровень генетического разнообразия поддерживается благодаря постоянному перекомбинированию генетического материала при скрещиваниях. У инбредных видов, наоборот, уровень панмиксии значительно снижен. Популяции таких видов уступают панмиктичным в генетическом разнообразии, при этом большая часть его приходится на долю межпопуляционного разнообразия [1, 12]. Тем не менее, широкое распространение и процветание многих видов самоопыляющихся растений подтверждает устоявшееся к настоящему времени мнение, что они имеют свои оригинальные способы поддержания генетической гетерогенности. У инбредных видов генотип организован на основе коадаптированных комплексов генов, т.е. генов, находящихся в гаметическом неравновесии. Их созданию способствует отбор и ограничение рекомбинации вследствие инбридинга, что дает возможность образования системы с постоянной гетерогенностью и в значительной степени ограничивает свободу расщепления [21, 3].
Процессы адаптации в природных популяциях особенно актуальны при неблагоприятных условиях среды, в частности на границах ареалов видов. Согласно одной из эволюционных стратегий выживания популяций – стратегии активного реагирования, при неблагоприятных условиях происходит повышение темпов генетической изменчивости, способствующее отбору новых генетических вариантов [4]. Предыдущие наши исследования [9, 10, 11] подтвердили теоретические представления Колчанова и др. [4] показав (с помощью аллозимного, RAPD и микросателлитного анализов), что характерной особенностью северных природных популяций Arabidopsis thaliana является высокий уровень генетического разнообразия, что также согласуется с представлениями Левонтина о популяционно-генетической структуре краевых популяций [5].
Об адаптивно значимой генетической изменчивости можно судить на основе модели нейтрального равновесия. В частности, тест на нейтральность может быть применен к достаточно большим группам однотипных молекулярных маркеров полиморфизма ДНК (обычно это микросателлитные локусы, AFLP, SNP, EST) [8]. Такие методы основаны на представлениях о явлении «генетического попутчика» (hitch-hiking), при котором снижение равновесия нейтральных маркеров обычно ускоряется отбором в ассоциированных с ними локусах [12]. Микросателлитные локусы в настоящее время широко применяются в качестве генетических маркеров для анализа популяционной структуры и оценки филогенетических взаимоотношений между популяциями. Они характеризуются высокой скоростью спонтанного мутирования, большим аллельным разнообразим и гетерозиготностью [6]. Хотя микросателлиты локализованы в основном в некодирующих регионах генома и, следовательно, должны быть селективно нейтральными, ряд фактов говорит о том, что они могут служить кодирующими или регуляторными элементами [2]. Исходя из этого, микросателлиты, как тандемно повторяющиеся последовательности, могут иметь значение в адаптивной эволюции. Дупликации генов приводят к избыточности, которая ослабляет давление отбора и, тем самым создает почву для функциональной эволюции [17, 20].
Для A. thaliana – модельного объекта генетических исследований, Белл и Эке [13] описали 30 микросателлитных локусов и определили величину их изменчивости среди лабораторных линий. Обширное исследование полиморфизма A. thaliana, проведенное Иннан и др. [14] на 42 образцах растений, собранных со всего мира, позволило выявить существенное разнообразие по микросателлитным локусам на уровне вида, несмотря на инбредную природу его. При этом большая часть разнообразия пришлась на межпопуляционную компоненту, что характерно для самоопылителей и свидетельствует о значительной дивергенции популяций.
В настоящей работе представлены результаты изучения особенностей микросателлитного полиморфизма в природных популяциях A. thaliana с целью выявления генетических механизмов адаптации их к условиям северной периферии ареала вида в Карелии. Данная работа дополняет и расширяет ранее проведенное исследование карельских популяций A. thaliana [11].
Растения A. thaliana протестированы по семи микросателлитным динуклеотидным локусам: ATHCTR1, nga59, nga111, nga162, nga168, nga172 и nga225 [21] из семи карельских популяций, три из которых относятся к бассейну Онежского озера (Царевичи, Радколье, Медвежьегорск), и четыре находятся на островах Ладожского озера (Валаам, Саматсаари, Пиенисартосари и Маркатсимансаари). Популяция Радколье также находится на острове (Радколье), а Царевичи и Медвежьегорск – на материке, и названы в соответствие с близлежащими населенными пунктами. Методика выделения ДНК из листьев взрослых растений, ПЦР и фрагментный анализ на CEQ 8000 («Beckman Coulter», США) описаны в предыдущей статье [11].Число динуклеотидных повторов каждого аллеля определяли путем сравнения полученного размера ПЦР-продукта с величиной его у лабораторной линии Col-0, число повторов которой установлено [13]. Статистическую обработку полученных результатов проводили, используя пакеты программ PHYLIP ), Arlequin ver. 3.11 3). Уровень генетического разнообразия популяций определяли с помощью показателей: доли полиморфных локусов (P99%), количества аллелей на локус (A), гетерозиготности наблюдаемой (Нob) и ожидаемой (Нexp) и количества гаплотипов (N). Наличие неравновесия по сцеплению (LD) между всеми парами локусов определяли, используя тест на LD [18] (пакет программ Arlequin). Процент локусов, находящихся в неравновесии по сцеплению относительно максимально возможного числа локусов в LD (Pd) был определен для каждой популяции [19].
В предыдущем нашем исследовании показано, что A. thaliana обладает огромной изменчивостью по микросателлитным локусам вопреки инбредной природе вида. В среднем более полиморфными оказались популяции северной границы ареала вида в бассейне Онежского озера (Р99%= 0.43; Нexp= 0.17; Нob= 0.03; A = 1.8) по сравнению с популяциями островов Ладоги, расположенными примерно на 300 км южнее (Р99%= 0.39; Нexp= 0.15; Нob= 0.02; A = 1.8) (табл.) [11]. В связи с этим, мы склонны придерживаться предыдущей версии объяснения результатов исследования [9, 10, 11]: высокий популяционный полиморфизм A. thaliana в северной части его ареала, скорее всего, связан с жесткими экологическими условиями произрастания и представляет основу адаптационных процессов. Однако среди исследованных популяций выявлены популяции с высоким уровнем генетического разнообразия и с невысоким. Полученные данные согласуются с работой норвежских ученых, изучавших популяции арабидопсиса Скандинавии [20].
Таблица.
Генетическая вариабельность по микросателлитным локусам в северных природных популяциях A. thaliana
|
Показатели |
Популяции бассейна Онежского озера |
Популяции бассейна Ладожского озера |
|||||||
| 1 | 2 | 3 | Среднее | 4 | 5 | 6 | 7 | Среднее | |
| P99% | 0.14 | 0.86 | 0.28 | 0.43 | 0.86 | 0.14 | 0.28 | 0.28 | 0.39 |
| А | 1.14 | 3.00 | 1.29 | 1.81 | 3.00 | 1.25 | 1.71 | 1.42 | 1.84 |
| Hexp | 0.02 | 0.45 | 0.03 | 0.17 | 0.42 | 0.05 | 0.10 | 0.04 | 0.15 |
| Hob | 0.01 | 0.06 | 0.02 | 0.03 | 0.05 | 0.00 | 0.02 | 0.01 | 0.02 |
| N | 2 | 23 | 3 | 9 | 22 | 4 | 6 | 5 | 9 |
| Pd | – | 38.0% | – | 12.7% | 9.5% | – | – | – | 2.4% |
В таблице представлены показатели генетической изменчивости: частота полиморфных локусов (P99%), число аллелей на локус (А), среднее генное разнообразие (Hexp), частота гетерозигот (Hob), количество гаплотипов (N) и процент пар локусов, находящихся в значимом неравновесии по сцеплению (LD) по сравнению с максимально возможным количеством пар локусов в LD (Pd). “–“ – разнообразие отсутствует. Популяции: 1 – Медвежьегорск, 2 – Радколье, 3 – Царевичи, 4 – Валаам, 5 – Самматсаари, 6 – Пиени-Сартосаари, 7 – Маркатсимансаари.
По мнению Стенойен и др. [20] полученные результаты, позволяют предположить постледниковую колонизацию полуострова множеством различных предков A. thaliana. Возможно, этот же процесс явился причиной таких больших различий в величине генетического разнообразия карельских популяций. Кроме того, микросателлиты, как некодирующие локусы, имеют свои особенности микроэволюции у инбредных видов. В таких популяциях снижение уровня изменчивости может быть связано с уменьшением их численности, вплоть до вымирания в результате эффектов хитч-хайкинга, фонового отбора и дрейфа генов. Указанные эффекты являются следствием существенной подразделенности и пониженной частоты рекомбинации инбредных видов [20]. Наибольшее генетическое разнообразие выявлено в популяциях Радколье и Валаам, что, по-видимому, связано с уникальными природными особенностями островов [см. 11].
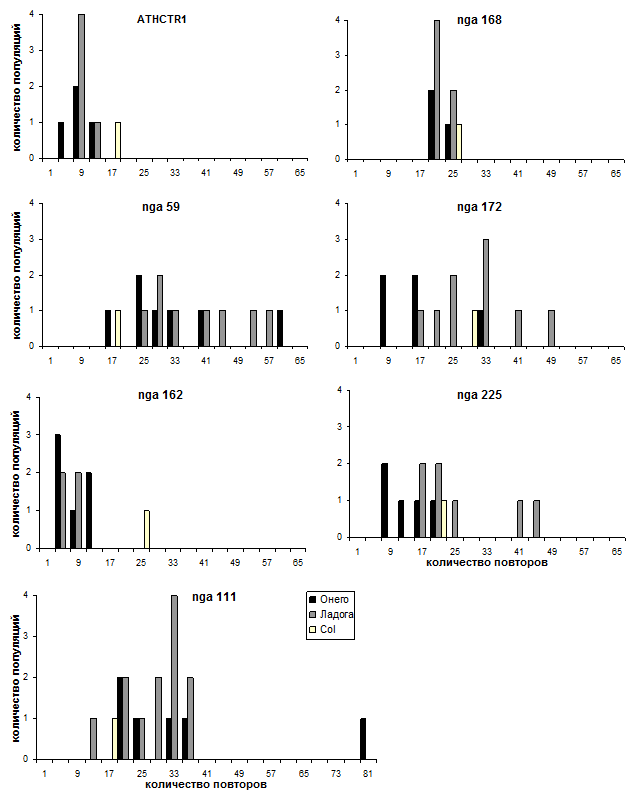
Рисунок. Распределение аллелей по микросателлитным локусам в природных популяциях A. thaliana бассейнов Онежского и Ладожского озер.
Распределение аллелей исследованных локусов по популяциям представлено на рисунке. В карельских популяциях A. thaliana выявлены микросателлитные локусы, имеющие уникальные аллели с длинными динуклеотидными повторами: nga59 (55 – 61 повтор), nga111 (80 повторов), nga172 (40 – 48 повторов) и nga225 (41 – 42 повтора). При изучении микросателлитного полиморфизма у 42-х экотипов A. thaliana, собранных со всего мира [14], только три локуса из 20 проанализированных имели аллели с длинными динуклеотидными повторами. Это nga126: 40 — 44 повтора и nga172 – 40 повторов у нескольких экотипов, и nga59: 55 повторов у одного экотипа (Akita) из Японии. Существование таких аллелей может поддерживаться естественным отбором, так как, следуя «модели пошаговых мутаций» (stepwise mutation model) [7], различия в величине аллелей свидетельствуют о количестве мутационных изменений в числе повторов, которые сохраняются из поколения в поколение. Аллели с длинными повторами – это, таким образом, «память» о прошедших мутационных событиях [16]. На рисунке для сравнения приведены данные анализа микросателлитных локусов лабораторной линии Col-0 [14]. По данным Иннан и др. [14] линия Col-0 имеет более длинные аллели по сравнению с другими 41 экотипами по 6 локусам из 20 проанализированных авторами, три из них присутствуют на рисунке – ATHCTR1, nga162 и nga168 (рис.).
Поскольку отбор действует не на отдельные гены, а на особей в целом, были изучены мультилокусные гаметические частоты (частоты гаплотипов) и гаметическое неравновесие (неравновесие по сцеплению, LD) между всеми парами микросателлитных локусов. Выявлено высокое гаплотипическое разнообразие – 65 гаплотипов в 7 популяциях (табл.). Каждая популяция имеет свой набор гаплотипов и нет общих гаплотипов для популяций. Тест на выявление парных ассоциаций микросателлитных локусов [18] показал наличие неравновесия по сцеплению в двух наиболее полиморфных популяциях A. thaliana – Радколье и Валаам. При проведении 21 сравнения по каждой паре локусов значимыми в LD при 5% уровне оказались 8 пар в Радколье (38%) и две в Валааме (9.5%). В популяции Радколье среди пар локусов в LD доминировали ATHCTR, nga59, nga111 и nga162, а в популяции Валаам обнаружены пары: nga59 – nga225 и nga168 – nga172. Интересно, что большинство ассоциированных локусов в карельских популяциях имеют аллели с длинными повторами. Так, в популяции Валаам это nga59, nga225 и nga172, а Радколье – nga59 и nga111 (рис.). Микросателлитные локусы, как некодирующие, в основном нейтральны. Показано [12], что для таких локусов снижение равновесия может быть связано с генетическим хитч-хайкинггом. Следовательно, они являются нейтральными маркерами для блока генов, имеющих адаптивное значение. С другой стороны, появляются свидетельства в пользу функциональной значимости отдельных вариантов тандемных повторов и, таким образом, их подверженности возможному давлению отбора [6]. Исходя из этого, не исключено, что микросателлитные локусы могут иметь значение для адаптации к условиям северной границы ареала. Хотя из наших данных точные генетические механизмы (мультилокусный отбор, инбридинг, дрейф генов и др.) значимой неслучайной ассоциации аллелей не могут быть установлены, все-таки показано, что A. thaliana способен поддерживать высокий уровень LD по микросателлитным локусам на северной периферии ареала. Для сравнения приведем результаты оценки неравновесия по сцеплению микросателлитных локусов среди 42 экотипов арабидопсиса, собранных со всего мира – 12.1% [14].
Таким образом, полученные результаты говорят в пользу активной адаптации вида A. thaliana к условиям северной периферии его ареала. Свидетельством этого является повышенное популяционно-генетическое разнообразие, способствующее отбору новых генетических вариантов, и наличие аллелей с длинными динуклеотидными повторами по микросателлитным локусам, которые при этом часто ассоциированы в пары, находящиеся в неравновесии по сцеплению. Снижение равновесия изученных локусов может быть связано с генетическим хитч-хайкингом с генами, имеющими адаптивное значение, или, как результат накопленных прошедших мутационных событий, поддерживаться естественным отбором. Исходя из этого, можно предположить, что в северных природных популяциях A. thaliana идет отбор на увеличение генетического разнообразия, которое представляет основу адаптационных процессов и является в данном случае необходимой предпосылкой для выживания их в экстремальных и не стабильных условиях.
Работа выполнена при финансовой поддержке гранта РФФИ (13-04-98838-р_север_а).
Список литературы:
- Алтухов Ю.П. Генетические процессы в популяциях. М.: Академкнига, 2003. 431 с.
- Динамика популяционных генофондов при антропогенных воздействиях (под ред. Ю.П.Алтухова). М.: Наука, 2004. 619 с.
- Животовский Л.А. Интеграция полигенных систем в популяциях. М.: Наука, 1984. 182 с.
- Колчанов Н.А., Суслов В.В., Шумный В.К. Молекулярная эволюция генетических систем // Палеонтологический журнал. 2003. № 6. С. 58–71.
- Левонтин Р.С. Генетические основы эволюции. М.: Мир, 1978. С. 157–161.
- Никитина Т.В., Назаренко С.А. Микросателлитные последовательности ДНК человека: мутационный процесс и эволюция // Генетика. Т. 40. №. 10. С. 1301–1318. (Nikitina N.V.,Nazarenko S.A. Human microsatellites: mutation and evolution // Rus. J. Genetics. 2004. V. 40. № 10. P. 1301–1318.)
- Оно С. Генетические механизмы прогрессивной эволюции. М.: Мир, 227 с.
- Салменкова Е.А. Молекуляро-генетические основы процессов адаптации и подходы к их анализу // Генетика. 2013. Т. 49. № 1. С. 94–
- Федоренко О. М., Савушкин А. И., Олимпиенко Г. С. Генетическое разнообразие природных популяций Arabidopsis thaliana (L.) Heynh. В Карелии. // Генетика. 2001. Т. 37. № 2. С. 223 – 229.
- Федоренко О. М., Грицких М. В. Генетическое разнообразие природных популяций Arabidopsis thaliana (L.) Heynh. на северной границе его ареала: RAPD-анализ // Генетика. 2008. Т. 44. № 4. С. 496–
- Федоренко О.М., Зарецкая М.В., Лебедева О.Н., Титов А.Ф. Генетическое разнообразие природных популяций Arabidopsis thaliana (L.), расположенных на северной периферии ареала вида // Труды КарНЦ РАН. Серия биогеография. 2014. № 2. С. 36-42.
- Хедрик Ф. Генетика популяций. М.: Техносфера, 2003. 592 с.
- Bell C.J., Ecker J.R. Assignment of 30 microsatellites to the linkage map of Arabidopsis // Genomics. 1994. V. 19. P. 137–144.
- Innan H., Terauchi R., Miyashita T. Microsatellite polymorphism in natural populations of the wild plant Arabidopsis thaliana // Genetics. 1997. V. 146. P. 1441–1452.
- Hamrick J.L., Godt M.J.W. Allozyme diversity in plant species // Plant population genetics, breeding, and genetic resources / Eds Brown A.H.D., Clegg M.T., Kahler A.L., Weir B.S. Sunderland (Massachusetts): Sinauer Associates, 1990. P. 43-64.
- Hardy O.J., Charbonnel N., Freville H., Heuertz M. Microsatellite alleles sizes: a simple test to assess their significance on genetic differentiation // Genetics. 2003. V. 163. 1467–1482.
- Ohta T., Kimura M. The model of mutation appropriate to estimate the number of electrophoretically detectable alleles in a genetic population // Res. 1973. V. 22. P. 201–204.
- Slatkin M. Linkage disequilibrium in growing and stable populations // Genetics. 1994. V. 137. 331–336.
- Stenøien H.K., Sastad S.M. Genetic structure in three haploid pead mosses (Spliagnum) // Heredity. 1999. V. 82. 391–400.
- Stenøien H. K., Fenster Ch. B., Tonteri A., Savolainen O. Genetic variability in natural populations of Arabidopsis thaliana in northern Europe // Molecular Ecology. 2005. Vol. 14. P. 137–
- Wagner A. Gene duplications robustness and evolutionary innovations // Bioessays. 2008. V. 30. P. 367–373.
- Weir B.S., Allard R.W., Kahler A.L. Analysis of complex allozymes polymorphisms in barley population // Genetics. 1972. V.72. N 3. P. 505- 523.[schema type=»book» name=»ГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ ПРОЦЕССОВ АДАПТАЦИИ ПРИРОДНЫХ ПОПУЛЯЦИЙ ARABIDOPSIS THALIANA» author=»Федоренко Ольга Михайловна, Зарецкая Марина Витальевна» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-03-30″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_30.04.2015_04(13)» ebook=»yes» ]

