На сегодняшний день проблема угнетающего воздействия антибиотиков на организм человека стоит достаточно остро[6 с. 599-609]. Кроме того, мировой опыт показывает, что скорость развития антибиотикорезистентности у микроорганизмов превышает скорость создания и исследования новых антибиотических веществ, в связи с чемнеобходим поиск альтернативных антибиотических средств с минимальными негативными эффектами [6 с. 599-609, 7 с. 202-206, 8 с. 150-154]. Исследования эндогенных антимикробных пептидов природного происхождения становятся основным направлением ввиду особых свойств данных соединений [2 с. 583-598, 4 с. 1337-1347]. Стоит отметить, что антимикробные пептиды, например, дефензины, являются основным фактором врожденного иммунитета, сохранившегося у растений, животных, грибов, в процессе эволюции [1 с. 31-40, 3 с. 211-215, 4 с. 1337-1347, 5 с. 4-5]. Они способны распознавать инфекционные агенты и обеспечивать защитную реакцию путем нарушения структуры или функции клеточной мембраны патогена [2 с. 583-598, 7 с. 202-206, 8 с. 150-154].
Материалы и методы
Объектами исследования являлись лиофильно высушенныеиндивидуальные экстракты слизистых оболочек свиней(ротовой полости, языка, пятачка, прямой кишки).
Для получения экстрактов сырье замораживали и измельчали на бытовой электрической мясорубке. Экстракцию проводили на лабораторной диспергирующей установке (Россия)при постоянном перемешивании в течение 24 часов, со скоростью 300 об/мин при соотношении объемов экстрагируемой ткани и раствора натрия хлорида (0,9 %) 1:2 при температуре 4-5 оС. Полученные экстракты центрифугировали при 3500 об/мин в течение 8 мин, отобиралинадосадочную жидкость и проводили ультрафильтрацию на установке VivaFlow200 (Германия), при этом экстракты разделяли на три фракции по соответствующим молекулярным массам: ˃5 кДа; 5-30 кДа; 30<кДа.Последующую вакуумную сушку осуществляли при температуре -40-42оС, давлении 3,8-4 Па на лабораторной лиофильной сушке (Россия).
Анализ белково-пептидного состава выполняли методом электрофореза в полиакриламидном геле 18 % плотности в присутствии 0,1 % лаурилсульфата натрия на предварительно подготовленных образцах с концентрацией 0,5 мг/мл и 0,6 мг/мл в буфере для разведения. В качестве свидетелей использовали маркер, состоящий из одиннадцати стандартов с молекулярной массой 250, 150, 100, 70, 50, 40, 30, 20, 15, 10 и 5 кДа («Fermentas», Литва).
Антибактериальную активность определяли микробиологическим диско- диффузионным методом:в чашки Петри на поверхность агара газоном высевали культуры Еsherihiacoli и Proteusvulgaris, затем на агарвыкладывали диски, смоченные разведенными лиофилизатами(концентрации: 0,1 г/мл, 0,05 г/мл, 0,025 г/мл, 0,012 г/мл). Диффузия экстракта в агар приводила к формированию зоны подавления роста микроорганизмов вокруг дисков. Чашки Петри с посевами ставили в термостат (температура 37 оС), через 20 и 40 часов замеряли зоны подавления роста культур (Рисунок 1).
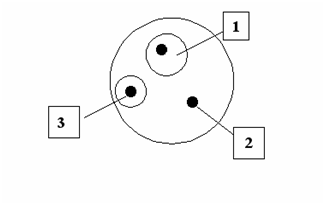 1 — зона подавления роста микроорганизма вокруг диска с экстрактом, микроорганизм чувствителен к экстракту
1 — зона подавления роста микроорганизма вокруг диска с экстрактом, микроорганизм чувствителен к экстракту
2 — нет зоны подавления роста микроорганизма экстрактом, микроорганизм не устойчив к экстракту
3 — зона подавления роста микроорганизма вокруг диска с экстрактом, микроорганизм умеренно чувствителен к экстракту
Рис. 1. Определение чувствительности микроорганизмов диско- диффузионным методом.
Результаты исследования
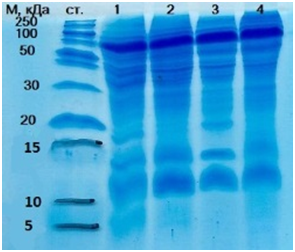
Анализ электрофореграмм в 18 % полиакриламидном геле показал, что в экстракты являютсямногокомпонентными смесями, содержащими белки в широком диапазоне молекулярных масс (выявлено большое количество как высокомолекулярных, так и низкомолекулярных соединений, при этом экстракты слизистых тканей органов достаточно индивидуальны(Рисунок 2).
 |
Условные обозначения:
Ст — Маркеры молекулярной массы (250, 150, 100, 70, 50, 40, 30, 20, 15, 10 и 5 кДа) 1- экстракт слизистой оболочки языка 2- экстракт слизистой оболочки ротовой полости 3-экстракт слизистой оболочки носовой полости 4- экстракт слизистой оболочки ануса
|
|
Рисунок 2. Электрофореграмма исследуемых образцов |
|
Анализ электрофоретических исследований экстракта слизистой оболочки языка (трек 1)выявил 28 полос: четкие белковые зоны обнаружены в диапазонах 13-14, 28-29, 38-39, 43-45, 56-70, 85-86 кДа; минорные белковые зоны 17-18 кДа, 20-21 кДа, 21-22 кДа, 22-23 кДа. Также было получено детальное разделение низкомолекулярных белковых зон – четко прослеживаются полосы в диапазоне от 2 до 6, 11-12, 14-15 и 16 кДа), в диапазоне от 18 до 54 кДа проявились минорные зоны (31, 32-33, 52-53, 54-55 кДа). Отмечено появление четкой полосы, соответствующей молекулярной массе 100-101 кДа.
При анализе электрофореза экстракта слизистой оболочки ротовой полости (трек 2)и экстракта слизистой оболочки носовой полости (трек 3)обнаружено 30 полос. При этом на треке 2показано присутствие четких белковых зон в области 11-12, 13-14, 26-27, 34-35, 35-36, 38-39, 41-42, 100-101 кДа; минорных белковых зон в диапазонах 16-17 и 21-22 кДа. Выявлено детальное разделение минорных зон в диапазоне 17-18, 20-21, 29-30 и 49-50 кДа; четких зон в области 25-26, 28-29, 30-31, 32-33, 43-45, 47-48 и 149-150 кДа. На треке 3 присутствуют четкие белковые зоны в диапазонах 26-27, 28-29, 34-35, 35-36 и 39-40 кДа; минорные белковые зоны в области 24-25 и 25-26 кДа. Отчетливо проявились минорные зоны в области 23-24, 45-4 и 96-97 кДа; ярковыражены полосы в диапазоне 12-13, 14, 19, 32-33, 36-37, 44-45, 47-48, 89-90 и 149-150 кДа.
При анализе электрофореза экстракта слизистой оболочки прямой кишки(трек 4) обнаружено 23 полосы: присутствуют полосы четкие белковые зоны в области 25-26, 28-29, 38-39, 54-55 и 100-101 кДа; детально проявились минорные зоны 14-15 кДа; четкие белковые зоны в диапазоне 12-13, 33-34, 120-121 и 150-151 кДа.
Сопоставление полученных с помощью электрофоретического исследования результатов с базой данных UniProt [9] позволил охарактеризовать белковые вещества, которые присутствуют в нативных экстрактах. Так, треки экстрактов слизистых оболочек, предположительно, включают в себя следующие соединения: Интегрин-бета (87 и 86 кДа), Бета-катенин (85 кДа), белок АМОТ (73 кДа), белок-рецептор серина/треонинкиназы(57, 58 и 60 кДа), полипиримидиновыйпутесвязывающий белок — 1 (60 кДа), белок FRS2 (57 кДа), белок UDP глюкозо-6-дегидрогеназы (55 кДа), МНС класса 1 антиген (40кДа), Бета-дефензин (4-17 кДа), белок UDP глюко-6-дегидрогеназы (5 кДа), белок MADH4 белок (4 кДа), белок NSD 1 (2 кДа) [9].
Определение антибактериальной активности показало, что в минимальной (0,012 г/л)и максимальной концентрации (0,1 г/л) подавление роста происходило более выраженно, чем в концентрациях 0,025 г/л и0,05 г/мл. При этом отмечена разная направленность действия: выявлено менее выраженное антимикробное действие при использовании экстрактов слизистой оболочки ротовой полости (Е. coliиP. Vulgaris), носовой полости и языка (Р. Vulgaris).Наиболее интенсивное подавление роста наблюдается у экстрактов слизистых ротовой, носовой полостей и языка в концентрации 0,1 г/мл при молекулярных массах менее 5 кДа и в диапазоне от 5 до 30 кДа, что подтверждает анализ электрофоретического исследования.
Таблица 1.
Антимикробные свойствалиофилизатов слизистых оболочек
|
Концентрация лиофилизата |
Задержка зоны подавления роста, мм | |||
| Е. coli | P. vulgaris | |||
| 20 часов | 40 часов | 20 часов | 40 часов | |
| Слизистая оболочка ротовой полости (0,1 г/мл) | ||||
| > 30 кДа | — | 0,5 | 2 | 2,5 |
| Слизистая оболочка ротовой полости (0,05 г/мл) | ||||
| 5 — 30 кДа | 1,5 | 2 | — | 2 |
| Слизистая оболочка ротовой полости (0,025 г/мл) | ||||
| 5 — 30 кДа | — | — | 0,5 | 1 |
| Слизистая оболочка ротовой полости (0,012 г/мл) | ||||
| < 5 кДа | 1,5 | 4,5 | — | — |
| 5 — 30 кДа | — | — | 2 | 2 |
| > 30 кДа | — | 1 | — | 4 |
| Слизистая оболочка носовой полости (0,1 г/мл) | ||||
| < 5 кДа | — | 3 | 4 | 7 |
| 5 — 30 кДа | — | — | — | 4,5 |
| > 30 кДа | — | 1 | 3 | 3 |
| Слизистая оболочка носовой полости (0,05 г/мл) | ||||
| < 5 кДа | 2 | 2 | — | — |
| > 30 кДа | — | — | 2,2 | 2,2 |
| Слизистая оболочка носовой полости (0,025 г/мл) | ||||
| < 5 кДа | 3 | 3 | — | 2 |
| 5 — 30 кДа | 1,5 | 1,5 | — | — |
| > 30 кДа | 7,5 | 7,5 | — | — |
| Слизистая оболочка носовой полости (0,012 г/мл) | ||||
| < 5 кДа | 2 | 2,5 | 0,5 | |
| 5 — 30 кДа | 1 | 2 | 1 | 1 |
| > 30 кДа | — | — | 3 | 3 |
| Слизистая оболочка языка (0,1 г/мл) | ||||
| < 5 кДа | — | 1 | 1,5 | 1,5 |
| 5 — 30 кДа | 1 | 1 | 2 | 2 |
| > 30 кДа | 3 | 4 | — | — |
| Слизистая оболочка языка (0,05 г/мл) | ||||
| > 30 кДа | — | — | 1 | 2 |
| Слизистая оболочка языка (0,025 г/мл) | ||||
| < 5 кДа | — | — | 1,5 | 1,5 |
| 5 — 30 кДа | — | — | 1 | 1 |
| > 30 кДа | 5 | 5 | — | 2 |
| Слизистая оболочка языка (0,012 г/мл) | ||||
| > 30 кДа | — | — | * | 6 |
| Слизистая оболочка ануса (0,1 г/мл) | ||||
| 5 — 30 кДа | 1 | — | 2 | 2,5 |
| Слизистая оболочка ануса (0,05 г/мл) | ||||
| > 30 кДа | — | — | 0,5 | 0,5 |
| Слизистая оболочка ануса (0,025 г/мл) | ||||
| < 5 кДа | 3,5 | 3,5 | 3 | 3 |
| 5 — 30 кДа | — | — | 2 | 2 |
*Намечается зона подавления роста
Выводы
Показано, чтоисследуемыеэкстракты слизистых оболочек ротовой и носовой полостей, языка и прямой кишки являются многокомпонентными смесями, выявлены различные высокомолекулярные и низкомолекулярные соединения, при этом экстракты слизистых достаточно индивидуальны и, предположительно, включаютантимикробные пептиды.
Лиофилизаты, разведенные в различных концентрациях, подавляют рост Е. coliиP. Vulgaris, при этом, более интенсивное подавление роста наблюдается при использовании экстрактов слизистых ротовой, носовой полостей и языка в концентрации 0,1 г/мл. Стоит отметить, что подавление роста микроорганизма чаще заметно у экстрактов с молекулярными массами меньше 5 кДа и от 5 до 30 кДа.При этом отмечена разная направленность действия: выявлено менее выраженное антимикробное действие при использовании экстрактов слизистой оболочки ротовой полости (Е. coliиP. Vulgaris), носовой полости и языка (Р. Vulgaris).
Эти данные подтверждают предположение о наличии дефензинов в исследуемых экстрактах слизистых оболочек, теоретически способствующихболее быстрому ранозаживлению, уменьшению количества опухолевых клеток, стимулирующих ферментативную активность и обладающих широким спектром антибактериальной активности против различных грибковых и бактериальных патогенов.
Дальнейшие, более глубокие исследования экстрактов слизистых оболочек свиней и других сельскохозяйственных животных позволят более точно и детально изучить их действие в отношении живого организма, а так же патогенов грибковой и бактериальной природы.
Список литературы:
- Budikhina A.S. Defensins – multifunctional cations peptides of human/ Budikhina A.S., Pinegin B.V. // Immunopathology, allergology, infectology. 2008. – Vol.2, N 1. – P. 31–40.
- David G. Allison, Peter A. Lambert / Chapter 32 – Modes of Action of Antibacterial Agents // Molecular Medical Microbiology (Second Edition)2015, P. 583–598.
- Kirill A. Pluzhnikov. Linear antimicrobial peptides from Ectatommaquadridens ant venom/ Kirill A. Pluzhnikov, Sergey A. Kozlov, , Alexander A. Vassilevski, Olga V. Vorontsova, Alexei V. Feofanov, Eugene V. Grishin//Biochimie. – 2014. — Volume 107, Part B. – P. 211–215.
- Kris De Smet. Human antimicrobial peptides: defensins, cathelicidins and histatins / De S. Kris, C. Roland // Biotechnology Letters. – 2005. – Vol. 27, N 13.– 1337–1347.
- Protective effects of human milk antimicrobial peptides against bacterial infection / Anders P. Hakansson //Jornal de Pediatria (VersãoemPortuguês), — 2015. Volume 91, Issue 1, 4-5.
- Sebastian G.B. Amyes, Benjamin A. Evans / Chapter 33 – Molecular Epidemiology of Antibiotic Resistance in Humans and Animals // Molecular Medical Microbiology (Second Edition)2015, P. 599–609.
- Selsted M. E. Activity of rabbit leukocyte peptides against Candida albicans / M. E. Selsted, D. Szklarek, T. Ganz // Infect. Immun. – 1985. – Vol. 49, N 2. – P. 202–206.
- Selsted M. E. Purification and antibacterial activity of antimicrobial peptides of rabbit granulocytes / M. E. Selsted, D. Szklarek, R. I. Lehrer // Infect. Immun. – 1984. – Vol. 45, N 1. – P. 150–154.
- Protein Knowledgebase (UniProtKB), 2002-2014 [Электронныйресурс].URL: https://www.uniprot.org (Датаобращения03.2015).[schema type=»book» name=»ВЫДЕЛЕНИЕ АНТИМИКРОБНЫХ ПЕПТИДОВ ИЗ СЫРЬЯ ЖИВОТНОГО ПРОИСХОЖДЕНИЯ И ИЗУЧЕНИЕ ИХ АНТИБАКТЕРИАЛЬНЫХ СВОЙСТВ» description=»Возможность выделения антимикробных пептидов из сырья животного происхождения и определения их антибактериальной активности микробиологическим методом в отношении Е. coliи P. vulgaris.» author=»Василевская Екатерина Романовна, Ертикеева Екатерина Александровна, Ахремко Анастасия Геннадьевна» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-02-23″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_25.07.15_07(16)» ebook=»yes» ]

