Интенсивное распространение антибиотикоустойчивости микроорганизмов связано с широким применением антибактериальных препаратов (АБП) в медицине, ветеринарии, сельском хозяйстве и других отраслях деятельности человека. Применение химиопрепаратов изменяет состав и функциональные свойства микрофлоры в природных местах обитания в сторону увеличения антибиотикоустойчивости микробного сообщества.
Вопрос о том, что природные места обитания микроорганизмов, окружающая нас среда являются богатым резервуаром разнообразной антибиотикоустойчивости, можно считать решенным окончательно [7,6 с.123-127]. Поэтому целесообразно расширить круг исследуемых проблем, связанных с распространением антибиотикорезистентных патогенных микроорганизмов, включив в него процессы накопления и обмена генов антибиотикорезистентности среди бактерий в природных экосистемах [3, с. 38-40, 5].
Одним из важнейших аспектов фенотипической характеристики условно-патогенных энтеробактерий является их резистентность к АБП [7 с.2-3]. При этом массовое распространение антибиотикорезистентных штаммов в популяциях УПМ стало важной проблемой в связи с их более высокими адаптационными возможностями по сравнению с возбудителями классических инфекций [2 с. 46-48, 8]. Разнообразный микробный пейзаж возбудителей УПМ, высокий уровень их антибиотикорезистентностиговорят о необходимости мониторинга за устойчивостью к АБП. Такой мониторинг должен включать непрерывный сбор информации о частоте выделения резистентных штаммов, анализ и публикацию результатов. Это позволит осуществлять надзор за устойчивостью к антибиотикам, а также идентифицировать специфические случаи появления генетически-модифицированных микроорганизмов с неустановленным влиянием на экосистему [8 с.222, 9].
Цель настоящего исследования – проведение активного сигнального мониторинга чувствительности/устойчивости к АБП условно-патогенных микроорганизмов порядков Enterobacteriales и Pseudomonadales, выделенных из поверхностных водоемов с мая по сентябрь 2014 г., результаты которого могли бы служить индикатором состояния антибиотикорезистентности микроорганизмов поверхностных водоемов г. Ростова-на-Дону.
Материалы и методы
Объекты исследования: условно-патогенные микроорганизмы порядков Enterobacteriales и Pseudomonadales, выделенные из стационарных точек поверхностных водоёмов г. Ростова-на-Дону.
Пробы воды из поверхностных водоемов отбирали батометром. Температура воды в момент забора проб составила: май — 22˚С; июнь — 21˚С; июль – 22-24˚С; август — 25˚С; сентябрь — 12˚С. Для отбора проб воды применяли стерильные стеклянные или пластмассовые прозрачные бутыли емкостью 1,5 л(ГОСТ 31861-2012 «Вода. Общие требования к отбору проб»; ГОСТ 31942-2012 «Вода. Отбор проб для микробиологического анализа»).
Идентификацию микроорганизмов начинали с изучения морфологии выросших колоний на агаре Хоттингера (рН 7,3±0,2) и на селективных средах: Эндо, Плоскирева, висмут-сульфит агаре. В целях ускорения исследования и значительного сокращения объема работы использовали хромогенную питательную среду (HiCromUTIAgarModified, Himedia) для одноэтапного выделения и прямой идентификации наиболее частых и значимых для санитарной микробиологии энтеробактерий. Определение родовой и видовой принадлежности условно-патогенных бактерий осуществляли по результатам совокупности биохимических тестов.
Для быстрой выборочной идентификации микроорганизмов использовали программно-аппаратный комплекс MALDI Biotyper. Масс-спектрометрический анализ проводили с использованием MALDI-TOF масс-спектрометра Microflex («Bruker Daltonics», Германия). Для записи, обработки и анализа масс-спектров использовали программное обеспечение фирмы «Bruker Daltonics» (Германия): flexControl 2.4 (Build 38) и flexAnalysis 2.4 (Build 11).
Чувствительность к антимикробным препаратам определяли методом серийных разведений в агаре Мюллера-Хинтон (рН 7,3±0,2). В работе использовали гентамицин, доксициклин, ампициллин, налидиксовая кислота, левомицетин, нитрофурантоин, ко-тримоксазол (препараты отечественного производства); цефтриаксон (Офрамакс, Ranbaxy, Индия); ципрофлоксацин (цифран, Ranbaxy, Индия). Интерпретацию результатов проводили в соответствии с МУ 4.12.1890-04 путем сопоставления величин минимальной подавляющей концентрации (МПК).
Внутренний контроль качества чувствительности определяли с использованием контрольных штаммов E. coli АТСС 25922 и P.aeruginosa АТСС 27853, которые тестировали параллельно с выделенными из воды изолятами. Статистическую обработку результатов осуществляли с помощью стандартных средств программы «MicrosoftOfficeExcel».
При характеристике микроорганизмов использовали общепринятые показатели: «чувствительные», «умеренно-резистентные» и «резистентные». «Умеренно-резистентные» и «резистентные» штаммы были объединены в категорию «резистентные».
Результаты
Всего за период исследования было выделено 225 штаммов условно-патогенных микроорганизмов, относящихся к 16 родам: Escherichia, Enterobacter, Klebsiella, Citrobacter, Salmonella, Pantoea, Proteus, Raoultella, Kluyvera, Yersinia, Providencia, Morganella, Serratia, Rahnella, Pseudomonаs, Acinetobacter.
Каждый штамм был протестирован на чувствительность/устойчивость к различным АБП. Критерии интерпретации значений минимальной подавляющей концентрации антибактериальных препаратов в отношении порядка Enterobacteriales оценивали по таблицам для энтеробактерий, а для порядка Pseudomonadales — по таблицам для неферментирующих микроорганизмов.
Порядок Enterobacteriales. За время исследования было выделено 156 штаммов порядка Enterobacteriales.Изучение влияния антимикробных препаратов на изолированные из воды микроорганизмы показало, что к гентамицину в мае, июне и сентябре были чувствительны 100 % штаммов. Высокая чувствительность к ципрофлоксацину, цефтриаксону и доксициклину регистрировалась в течение всего периода наблюдения.
Доля штаммов, чувствительных к налидиксовой кислоте варьировала от
61 % в мае до 100 % в сентябре. Частота встречаемости чувствительных к левомицетину микроорганизмов менялась в пределах от 56 % до 92,6 %. Изменения уровней чувствительности выделенных штаммов к ампициллину в разные месяцы были от 0 до 65,4 %, к нитрофурантоину — 18,4 % до 92,6 %. Уровень чувствительности к ко-тримоксазолу в течение периода наблюдения менялся от 30 % до 50 %.
Анализ распространенности антибиотикорезистентности к различным антимикробным препаратам в популяции условно-патогенных энтеробактерий, выделенных в 2014 году из поверхностных водоемов г. Ростова-на-Дону, показал высокую резистентность к ампициллину и ко-тримоксазолу. Интересно отметить, что в июне 2014 г. наблюдалось снижение уровней резистентности ко всем антибактериальным препаратам, за исключением ко-тримоксазола (рис.1).

Рисунок 1. Динамика доли резистентных к АБП штаммов УПМ
Штаммы, чувствительные ко всем АБП, в нашем исследовании были выделены в июне (35,2 %), июле (16,67 %) и сентябре (42,3 %). Так, в июне и сентябре такие штаммы встречались во всех исследуемых точках, среди них встречались представители родов Escherichia, Morganella, Raoultella, Salmonella, Enterobacter, Pantoea, Citrobacter, Klebsiella.
Доля монорезистентных УПМ варьировала в зависимости от месяца наблюдения (табл. 1). В июне и сентябре зарегистрирована высокая частота встречаемости таких штаммов — 46,3 % и 30,8 % соответственно, причем в июне монорезистентные штаммы были обнаружены во всех точках. Среди них встречалисьпредставители родов Citrobacter, Escherichia, Providencia — в мае, представители всех родов – в июне, в июле – микроорганизмы родов Klebsiella и Proteus, в августе — Enterobacter, Escherichia, Serratia, в сентябре —Enterobacter, Klebsiella, Pantoea.
Таблица 1.
Распределение долей чувствительных к АБП штаммов энтеробактерий
| май
n = 38 |
июнь
n = 54 |
июль
n = 18 |
август
n = 20 |
сентябрь n = 26 | |
| Чувствительные | 0 | 35,2 % | 16,7 % | 0 | 42,3 % |
| Монорезистентные | 18,4 % | 46,3 % | 16,7 % | 15,0 % | 30,8 % |
| Полирезистентные | 81,5 % | 18,5 % | 66,6 % | 85,0 % | 26,9 % |
Как видно из рисунка 2, в 2014 г. чувствительными ко всем АБП были
21,2 % штаммов, монорезистентными — 29,5 %. Следует отметить, что в микробном сообществе УПМ порядка Enterobacteriales доминировали полирезистентные штаммы. В целом, за год их доля составила 49,4 %, достигая в отдельные в отдельные месяцы 81,5 % и 85,0 %.
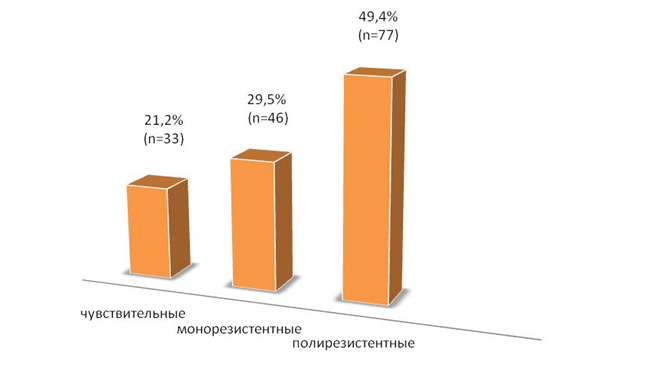
Рисунок 2. Доли штаммов порядка Enterobacteriales по чувствительности к АБП (%) в 2014 г.
Порядок Pseudomonadales. Всего в 2014 г. проанализировано по чувствительности/устойчивости к антибактериальным препаратам 69 штаммов неферментирующих бактерий родов Acinetobacter (57 штаммов) и Pseudomonas(12 штаммов). Все исследуемые штаммы показали стопроцентную чувствительность к цефтриаксону. Выделенные в мае, июне, июле и сентябре штаммы были чувствительны к ципрофлоксацину, только 36,8 % изолятов, проанализированных в августе, проявили устойчивость к этому АБП. Эффективность гентамицина invitro по отношению к исследуемым штаммам была 100 % в мае, июне и сентябре. В июле и августе доля чувствительных штаммов составила 66,7 % и 79 % соответственно.
Резистентность к левомецитину и ко-тримоксазолу у выделенных штаммов варьировала от 16,6 % до 100 % в разные месяцы. Больше всего устойчивых к различным АБП штаммов неферментирующих бактерий было выделено в августе (к ципрофлоксацину — 36,8 %, левомицетину — 36,8 %, ко-тримоксазолу — 73,7 %, гентамицину — 21 %).
Род Acinetobacter показал высокую устойчивость к ко-тримоксазолу
(49,1 %) и левомицетину (35,0 %). Доля устойчивых к ципрофлоксацину и гентамицину штаммов Acinetobacterсоставила 10,5 %. Среди выделенных изолятов устойчивых к цефтриаксону штаммов выделено не было.
Среди выделенных представителей рода Pseudomonas50 % штаммов были устойчивы к левомицетину и 50 % к ко-тримоксазолу. Штаммов псевдомонад, устойчивых к ципрофлоксацину, цефтриаксону и гентамицину, обнаружено не было.
Представляют интерес данные, полученные при динамическом микробиологическом мониторинге неферментирующих бактерий в 2014 году. Чувствительными ко всем АБП были 31,8 % штаммов, монорезистентными — 40,5 %, полирезистентными — 27,5 %.
Свойство полирезистентности было отмечено у представителей разных видов и родов условно-патогенных энтеробактерий (рис. 3).

Рисунок 3. Распределение профилей антибиотикорезистентности
по родам УПМ
Сто процентов бактерий родов Yersinia, Rahnella, Kluyvera, большая часть представителей родов Escherichia, Klebsiella, Enterobacter и Morganella обладали полирезистентностью, доля Citrobacter составила 42,9 %, Proteus 33,3 %, Acinetobacter28,1 %, Pseudomonas25,0 %.
Больше всего монорезистентных штаммов выявлено среди бактерий родов Proteus (66,6 %) иPseudomonas(58,3 %), половина представителей родов Providencia и Raoultella также оказались монорезистентными.
Заключение
Проведенный микробиологический мониторинг свидетельствует о возрастающей антропогенной нагрузке и неблагоприятной экологической обстановке в исследуемых точках.
В микробном сообществе УПМ порядка Enterobacteriales доминировали полирезистентные штаммы. В целом, за год их доля составила 49,4 %, достигая в отдельные месяцы 81,5% и 85,0%. Среди бактерий порядка Pseudomonadales доля полирезистентных штаммов составила — 27,5 %.
Полученные результаты могут послужить основой для создания базы данных о штаммах УПМ, циркулирующих в водных экосистемах г. Ростова-на-Дону, для дальнейшего мониторирования водных экосистем, что могло бы способствовать переводу биологического контроля в системе обеспечения биологической безопасности из режима «устранение последствий» в режим «предупреждения».
Список литературы
1.Анганова Е.В.Условно-патогенные энтеробактерии: доминирующие популяции, биологические свойства, медико-экологическая значимость: Автореф. дисс. докт. мед. наук. Иркутск, 2012. – 47 с.
2.Веркина Л.М., Березняк Е.А., Титова С.В., Тришина А.В., Симонова И.Р., Селянская Н.А., Кирилова О.Д. Мониторинг антибиотикорезистентности условно-патогенных микроорганизмов поверхностных водоемов // Медицинский альманах. — 2014.- Вып. 4(34) -С.46-48.
3.Виноградова К.А., Булгакова В.Г., Полин А.Н., Кожевин П.А. Устойчивость микроорганизмов к антибиотикам: резистома, ее объем, разнообразие и развитие // Антибиотики и химиотерапия.-2013.- Вып. 5-6(58)-С.38-48.
4.Онищенко Г.Г. Актул. Пробл. Биол. безопасности // Вестник РАМН.-2013.- Вып.11(2). -С.4-11.
5.Супотницкий М.В. Механизмы развития резистентности к антибиотикам у бактерий // Биопрепараты. -2011.- Вып. 2.- С. 4-44.
6.Abdullah M., Alzahrani I., Youssuf A. Antibiotic resistance in Escherichia coli strains isolated from water springs in Al-Ahsa Region // African Journal of Microbiology Research. -2011.- Vol. 5(2).- Р. 123-130.
7.Jesse A. Port, Alison C. Cullen, Jemes C. Wallace, Marissa N. Smith, Eleine M. Faustman. Metagenomic Frameworks for Monitoring Antibiotic Resistance in Aquatic Environments // Environmental Health Perspectives.Vol.122.-N.3.-Р.222-228.
8.3rd Symposium on Antimicrobial Resistance in Animals and the Environment. 2009. ARAE. Tour-Vinci, 1-3 June 118.
9.Tenover F.C. 2005. Global problem of antimicrobial resistance // Russ.Med.J.Vol.4.-Р.1-6.[schema type=»book» name=»АНТИБИОТИКОРЕЗИСТЕНТНОСТЬ УСЛОВНО-ПАТОГЕННЫХ МИКРООРГАНИЗМОВ ПОВЕРХНОСТНЫХ ВОДОЕМОВ Г. РОСТОВА-НА-ДОНУ» description=»Проведено исследование условно-патогенных и патогенных микроорганизмов стационарных точек водных объектов города Ростова-на-Дону в 2014г. Выявлена гетерогенность микробных популяций условно-патогенных микроорганизмов (УПМ) водоемов. Изучена устойчивость УПМ к антимикробным препаратам для оценки потенциальной опасности появления в водной среде поли- и панрезистентных микроорганизмов. В микробном сообществе УПМ порядка Enterobacteriales доминировали полирезистентные штаммы. В целом, за год их доля составила 49,4 %, достигая в отдельные месяцы 81,5% и 85,0%. Среди бактерий порядка Pseudomonadales доля полирезистентных штаммов составила — 27,5 %.» author=»Березняк Елена Александровна, Тришина Алена Викторовна, Веркина Людмила Михайловна, Симонова Ирина Рафиковна» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-03-14″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_30.05.2015_05(14)» ebook=»yes» ]

