Введение
Полианионные полисахариды являются обширной группой биополимеров, которые обнаружены во всех классах морских водорослей. Интерес к изучению этих полисахаридов вызван широким спектром их биологического действия. Они обладают противовирусным, противоопухолевым, иммуномодулирующим, противовоспалительным, антикоагулянтным, антиадгезивным, антиангиогенным действием [22, 14, 16, 5, 21, 20, 2, 17, 9, 15, 4].
Среди полианионных полисахаридов наибольшее внимание привлекают фукоиданы — сульфатированнные полисахариды бурых водорослей. Фукоиданы принадлежат к семейству сульфатированных гетерополисахаридов, основным, а иногда единственным мономером которых являются сульфатированные и, в некоторых случаях, ацетилированные по различным положениям остатки α‑L‑фукозы. Кроме остатков фукозы, в состав фукоиданов бурых водорослей часто входят и другие моносахариды, такие как галактоза (Gal), манноза (Man), ксилоза (Xyl), рамноза (Rha), уроновые кислоты (U). Неуклонно растет количество публикаций, посвященных исследованиям биологической активности фукоиданов, которые намного опережают исследования структуры этих полисахаридов. Механизм действия фукоиданов и влияние его молекулярной структуры на проявление той или иной биологической активности остаеются мало изученным. Это связано, прежде всего, с отсутствием сведений об особенностях строения молекулы фукоидана, например, о способах включения минорных моносахаридов в структуру молекулы.
К настоящему времени установлены только основные принципы построения молекул фукоиданов. Химические исследования этих полисахаридов затруднены из-за чрезвычайной нерегулярности их строения, в связи с чем детальный анализ структуры представляет значительные трудности. Поэтому, надежной корреляции между химическим строением и биологическим действием фукоиданов установить до сих пор не удается. Для решения этих задач актуальным является использование ферментов с установленной специфичностью и механизмом действия, способных гидролизовать сложные молекулы фукоиданов. Детальный анализ структуры небольших фрагментов фукоиданов позволит установить химическую структуру этого полисахарида. Использование разнообразных по структуре фрагментов фукоидана поможет определить взаимосвязь между теми или иными структурными элементами и их биологическим действием.
Ферментами, субстратом для которых являются фукоиданы, называются фукоиданазами или фуканазами. Эти ферменты катализируют гидролиз О-гликозидных связей внутри основной цепи молекул фукоиданов (КФ 3.2.1.44, GH107 (база данных CAZy)). Фукоиданазы являются редкими и слабо изученными ферментами. Имеется несколько публикаций, посвященных распространению фукоиданаз в морских бактериях [1] и морских беспозвоночных Японского моря [3]. В настоящее время первичная структура установлена только для трех ферментов, выделенных из бактерий Mariniflexile fucanivorans SW5 и Alteramonas sp. SN-1009. [11, 19], из которых только одна фукоиданаза имеет характеристику каталитических свойств [8].
На сегодняшний день нет информации о структурной организации фукоиданаз, размерах активных центров, субстрат-связывающих участках, вторичной и третичной структурах. Механизм действия фукоиданаз практически не изучен. Столь небольшое количество публикаций о структуре фукоиданаз и их каталитических свойствах связано с низким содержанием этих ферментов в организмах, используемых в качестве источников. Одним из путей решения данной проблемы является установление аминокислотных последовательностей фукоиданаз и получение рекомбинантных ферментов в количествах достаточных для исследования тех или иных свойств и пространственной структуры ферментов.
Данная работа посвящена изучению каталитических и молекулярных свойств двух рекомбинантных фукоиданаз из морской бактерии Formosa algae.
Результаты
В качестве продуцента фукоиданаз был выбран штамм морской бактерии F. algae. Ранее нами из данного штамма была выделена внутриклеточная фукоиданаза, определены ее каталитические свойства, получены и охарактеризованы продукты ферментативного гидролиза фукоидана [18].
Данные об аминокислотных последовательностях фукоиданаз были получены в результате секвенирования нуклеотидной последовательности генома морской бактерии F. algae (данные не опубликованы). Был проведен поиск гомологов продуктов генов, содержащихся в геноме F. algae. Результаты поиска позволили сделать вывод о наличии в геноме F. algae двух генов, кодирующих фукоиданазы (ФФА1 и ФФА2). Сравнение аминокислотных последовательностей ФФА1 и ФФА2 посредством множественного выравнивания показало 57 % их идентичности. Идентичность аминокислотных последовательностей FcnA с ФФА1 и ФФА2 составила 67 % и 57 %, соответственно. Меньшая идентичность наблюдалась при сравнении аминокислотных последовательностей ФФА1 и ФФА2 с аминокислотными последовательностями других известных фукоиданаз: из Alteromonas sp. SN-1009 (Fda1 (GenBank AAO00508.1) и Fda2 (GenBank AAO00509.1)) и из Shewanella violacea DSS12 (SVI_0379 (GenBank BAJ00350.1)). При помощи сервиса Signal IP обнаружено наличие сигнальной последовательности у ФФА1, которая характерна для внеклеточных белков, в то время как у ФФА2 такая последовательность отсутствовала. По результатам анализа при помощи сервиса InterProScan, аминокислотные последовательности ФФА1 и ФФА2 имют в своем составе повторяющиеся кадгериноподобные домены. Кадгериноподобные домены встречаются у ферментов бактерий, катализирующих гидролиз соединений различных классов (белков, углеводов, нуклеиновых кислот), а также у лектинов, связывающихся с анионными полисахаридами [7, 12, 6, 13]. Стоит отметить, что общими для всех описанных в литературе функций этих доменов является связывание с тем или иным биополимером при помощи ионов кальция (кальций-зависимое связывание) [10]. С-Концевые участки ФФА1 и ФФА2 демонстрировали высокую степень идентичности аминокислотных последовательностей (от 26 % до 41 %) с С-концевыми доменами различных белков, в основном, гликозидгидролаз и протеиназ, синтезируемых бактериями типа Bacterioidetes.
Таким образом, в аминокислотной последовательности исследуемых нами фукоиданаз (ФФА1 и ФФА2) присутствуют все домены, ранее найденные в структуре FcnA, что может быть объяснено таксономической близостью организмов продуцентов.
Для подтверждения прогнозируемой функции генов ФФА1 и ФФА2 морской бактерии F. algae были получены рекомбинантные продукты этих генов. С целью определения функции того или иного домена были получены 6 генетических конструкций по три для каждой из фукоиданаз ФФА1 и ФФА2. Генетические конструкции содержали нуклеотидные последовательности, кодирующие полноразмерные фукоиданазы ФФА1 и ФФА2, а также их усеченные производные ФФА1-СД и ФФА2-СД без С-концевого домена и ФФА2-КД и ФФА1-КД без повторяющихся последовательностей кадгериноподобных доменов.
В качестве систем экспрессии генов ФФА1 и ФФА2 был использован коммерческий штамм E. coli: BL21 star (DE3)pLysS. Практически все рекомбинантные белки: полноразмерные фукоиданазы (ФФА1, ФФА2) и их усеченные производные (ФФА1-СД, ФФА2-СД) — экспрессировались в растворимой форме. Исключение составляли усеченные производные ФФА1-КД и ФФА2-КД, которые экспрессировались как в виде телец включений, так и в растворимой форме. Наибольшее содержание целевых рекомбинантных белков для всех исследованных штаммов наблюдалось при температуре культивирования +20º С.
Обе полноразмерные рекомбинантные фукоиданазы и все их усеченные производные катализировали расщепление фукоидана (рис. 1). Фукоиданазная активность рекомбинантных ферментов, также как и нативного, проявлялась только в присутствии некоторых ионов двухвалентных металлов. Это дает основание предположить, что фукоиданазы, синтезируемые морской бактерией F. algae, являются металлозависимыми. Наличие фукоиданазной активности у усеченных производных рекомбинантных фукоиданаз ФФА1-СД и ФФА2-СД указывает на то, что С-концевой домен, вероятно, не участвует в каталитическом акте. Фукоиданазы ФФА1-КД и ФФА2-КД также обладали способностью гидролизовать фукоидан, но в значительно меньшей степени (рис. 1). Возможно, подобная модификация белков приводила к уменьшению способности связываться с молекулами субстрата. Аналогичный результат мог быть получен за счет уменьшения устойчивости молекулы, если кадгериноподобные домены играли стабилизирующую роль [27]. Функция, выполняемая кадгериноподобными доменами, входящими в состав структуры фукоиданаз, остается неизвестной.

Рисунок 1 – Электрофореграмма продуктов гидролиза фукоидана из F. evanescens (P) рекомбинантными фукоиданазами ФФА1 (1), ФФА2 (2), ФФА1-СД (3), ФФА2-СД (4), ФФА1-КД (5) ФФА2-КД (6); (Кс) – смесь фукоидана и денатурированных рекомбинантных фукоиданаз (1—6)
Для очистки фукоиданаз была выбрана комбинация методов ионообменной хроматографии и гель-фильтрации. Ферменты были выделены в гомогенном состоянии.
Изучение влияния ионов двухвалентных металлов на ферментативную активность фукоиданаз ФФА1 и ФФА2 показало, что наиболее эффективными активаторами для обоих ферментов служили ионы Ca2+, Ba2+, Mg2+ и Mn2+. Ионы Al3+, Cu2+, Sn2+ и Fe3+ полностью ингибировали рекомбинантные фукоиданазы (рис. 2 А). Оптимальный уровень рН для проявления ферментативной активности составляет 6,5 – 8 для ФФА1, 6,5 – 9 для ФФА2
Специфичность рекомбинантных фукоиданаз была изучена на серии фукоиданов различной структуры (рис. 2, Б). Оба фермента с высокой скоростью гидролизовали фукоидан из Fucus evanescens, цепь которого построена из чередующихся α-1→3- и α‑1→4‑связанных остатков сульфатированной фукозы. Фукоиданы из Saccharina cichorioides и Undaria pinnatifida, содержащие в своем составе только α-1→3-связанные остатки сульфатированной фукозы, ферментативному гидролизу не подвергались.
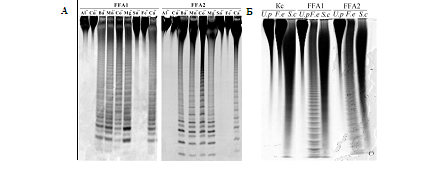
Рисунок 2 – А: Электрофореграмма продуктов гидролиза фукоидана из F. evanescens рекомбинантными фукоиданазами ФФА1 и ФФА2 в присутствии ионов двухвалентных металлов; Б — Электрофореграмма продуктов гидролиза фукоиданов из F. evanescens (F.e), S. cichorioides (S.c), U. pinnatifida (U.p) рекомбинантными фукоиданазами ФФА1 и ФФА2. Kс – фукоиданы
Полученные данные свидетельствуют о том, что обе фукоиданазы специфичны к расщеплению α‑1→4‑гликозидных связей между остатками сульфатированной фукозы. Данные ферменты классифицированы нами как эндо-1→4-α‑L-фуканазы.
Благодарность
Данная работа поддержана: грантом ДВО РАН № 15-II-5-006 «Фукоиданазы морской бактерии Formosa algae – точные инструменты для изучения структуры фукоиданов и получения биологически активных олигосахаридов».
Список литературы:
- Бакунина И.Ю., Шевченко Л.С., Недашковская О. И., Шевченко Н. М., Алексеева С. А., Михайлов В.В., Звягинцева Т. Н. Поиск фукоидан-гидролаз среди морских микроорганизмов // Микробиология. 2000. — Т. 69, № 3. — С. 370-376.
- Беседнова Н.Н., Запорожец Т.С. Фундаментальные и прикладные аспекты изучения биополимеров из гидробионтов Тихого океана // Бюлл. СО РАМН. 2008. — Т. 132 № 4. — С. 16-21.
- Бурцева Ю. В., Кусайкин М. И., Сова B. B., Шевченко Н. М., Скобун С. А., Звягинцева Т. Н. Распространение фукоиданаз и некоторых гликозидаз среди морских безпозвоночных // Биология моря. 2000. — Т. 26, № 6. — С. 429-432.
- Кузнецова Т.А., Шевченко Н.М., Звягинцева Т.Н., Беседнова Н.Н. Биологическая активность фукоиданов из бурых водорослей и перспективы их применения // Антибиот. химиотер. 2004. — Т. 49 № 5. — С. 24-27.
- Макаренкова И.Д., Дерябин П.Г, Львов Д.К, Звягинцева Т.Н, Беседнова Н.Н. Противовирусная активность сульфатированного полисахарида из бурой водоросли Laminaria japonica в в отношении инфекции культур клеток, вызванной вирусом гриппа А птиц (H5N1) // Вопр. вирусологии. 2010. — Т. 1, — С. 41-45.
- Abdian P.L., Caramelo J. J., Ausmees N., Zorreguieta A. RapA2 is a calcium-binding lectin composed of two highly conserved cadherin-like domains that specifically recognize Rhizobium leguminosarum acidic exopolysaccharides // J. Biol. Chem. 2013. — Vol. 288, N 4. — P. 2893-904.
- Cao L., Yan X., Borysenko C.W., Blair H.C., Wu C., Yu L. CHLD. A cadherin-like domain in Proteobacteria and Cyanobacteria // FEMS Microbiol. Lett. 2005. — Vol. 251, N 2. — P. 203-209.
- Colin S., Deniaud E., Jam M., Descamps V., Chevolot Y., Kervarec N., Yvin J., Barbeyron T., Michel G., Kloareg B. Cloning and biochemical characterization of the fucanase FcnA: definition of a novel glycoside hydrolase family specific for sulfated fucans // Glycobiology. 2006. — Vol. 16 N11. — P. 1021–1032.
- Chevolot L., Foucault A., Chaubet F., Kervarec N., Sinquin C., Fisher A.M., Boisson-Vidal C. Further data on the structure of brown seaweed fucans: relationships with anticoagulant activity // Carbohydr. Res. 1999. — Vol. 319, N 1-4. — P. 154-165.
- Cho J.H., Muralidharan V., Vila-Perello M., Raleigh D.P., Muir T.W., Palmer III A.G. Tuning protein autoinhibition by domain destabilization // Nat. Struct. Mol. Biol. 2011. — Vol. 18, N 5 —P. 550-555.
- Descamps V., Colin S., Lahaye M., Jam M., Richard C., Potin P., Barbeyron T., Yvin J., Kloareg B. Isolation and culture of a marine bacterium degrading the sulfated fucans from marine brown algae // Mar. Biotechnol. 2006. — Vol. 8, N 1. — P. 27–39
- Fraiberg M., Borovok I., Wainer R.M., Lamed R., Bayer E.A. Bacterial cadherin domains as carbohydrate binding modules: determination of affinity constants to insoluble complex polysaccharides // Biomass Convers.: Methods and Protocols. 2012. — Vol. 908, N 11. — P. 109-118.
- Fraiberg M., Borovok I., Bayer E.A., Wainer R.M., Lamed R. Codherin domein in polysaccharide-degrading marine bacterium Saccharophagus degradans 2-40 are carbohydrate binding modules // J. Bacteriol. 2011. — Vol. 193, N 1. — P. 283-285.
- Hayashi K., Nakano T., Hashimoto M., Kanekiyo K., Hayashi T. Defensive effects of a fucoidan from brown alga Undaria pinnatifida against herpes simplex virus infection // Int. J. Immunopharmacol. 2008. — Vol. 8 N1. — P. 109-116.
- Jin W., Zhanga Q., Wanga J., Zhanga W. A comparative study of the anticoagulant activities of eleven fucoidans // Carbohydr. Polym. 2013. — Vol. 91, N — P. 1-6.
- Lee J.B., Hayashi K., Hashimoto M., Nakano T., Hayashi T. Novel antiviral fucoidan from sporophyll of Undaria pinnatifida (Mekabu) // Chem. Pharm. Bull. (Tokyo). 2004. — Vol. 52, N 9. — P. 1091-1094.
- Nishino T., Yokoyama G., Dobashi K., Fujihara M., Nagumo T. Isolation, purification, and characterization of fucose-containing sulfated polysaccharides from the brown seaweed Ecklonia kurome and their blood-anticoagulant activities // Carbohydr. Res. 1989. — Vol. 186, N 1. — P. 119-129.
- Silchenko A.S., Kusaykin M.I., Kurilenko V.V., Zakharenko A.M., Isakov V.V., Zaporozhets T.S., Gazha A.K., Zvyagintseva T.N. Hydrolysis of fucoidan by fucoidanase isolated from the marine bacterium, Formosa algae // Mar. Drugs. – 2013. – Vol. 11, N 7. – P. 2413−2430.
- USA 6489155 (B1). Enzymes capable of degrading a sulfated-fucose-containing polysaccharide and their encoding genes / Takayama M., Koyama N., Sakai T., Kato I.; assignee: Takaro Shuzo CO., LTD (JP).—publl. 03.12.2002.
- Usui T., Asari K., Mizuno T. Isolation of Highly Purified Fucoidan from Eisenia-Bicyclis and Its Anti-Coagulant and Anti-Tumor Activities // Agric. Biol. Chem. 1980. — Vol. 44, N 8. — P. 1965-1966.
- Yamasaki-Miyamoto Y., Yamasaki M., Tachibana H., Yamada K. Fucoidan Induces apoptosis through activation of caspase-8 on human breast cancer MCF-7 cells // J. Agric. Food Chem. 2009. — Vol. 57, N 18. — P. 8677-8682.
- Zonga A.,Cao H., Wang F. Anticancer polysaccharides from natural resources: A review of recent research // Carbohydr. Polym. 2012. — Vol. 90, N 4. — P. 1395-1410.[schema type=»book» name=»Характеристика каталитических свойств двух новых рекомбинантных фукоиданаз из морской бактерии Formosa algae» description=»В морской бактерии Formosa algae определены два гена кодирующие, фукоиданазы ФФА1 и ФФА2. Биоинформационный анализ аминокислотных последовательностей выявил их мультидоменную организацию. Для выявления функции того или иного домена, входящего в состав фукоиданаз, были получены усеченные с С-конца производные данных ферментов. Полноразмерные фукоиданазы и все их усеченные производные обладали ферментативной активностью. Наличие фукоиданазной активности у усеченных производных указывает на локализацию активного центра в N-концевой области данных ферментов. Ионы Ca2+, Ba2+, Mg2+ и Mn2+ активировали ФФА1 и ФФА2, в то время как ионы Al3+, Cu2+, Sn2+ и Fe3+ ингибировали оба фермента. На основании субстратной специфичности фукоиданазы ФФА1 и ФФА2 классифицированы нами как эндо-1→4-α L-фуканазы.» author=»Сильченко Артем Сергеевич, Зуева Анастасия Олеговна» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-02-08″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_29.08.15_08(17)» ebook=»yes» ]

