Введение. В современных условиях отрицательного влияния деятельности человека на окружающую среду наблюдается усиление влияния стресс факторов на животных и человека, приводящих к снижению естественной резистентности. В результате увеличивается рост количества регистрируемых вирусных и бактериальных инфекций, а так же инвазионных заболеваний. Наблюдается существенный рост числа выявляемых антибиотико-устойчивых патогенных штаммов бактерий. В сложившихся условиях возрастает актуальность синтеза новых лекарственных препаратов, проявляющих не только антибиотическую активность, но и оказывающих антитоксическое и стимулирующее воздействие на иммунную систему организма.
Методика исследований
В данной работе был осуществлен синтез N-, O-(2,3 дигидроксипропил)хитозана, с максимальной степенью замещения (2,0-2,6) и молекулярной массой полимерного звена, определенной по результатам элементного анализа 317,0-377,28 [1,с.1140]. Синтезированный высокомолекулярный лиганд в щелочной среде вступал в реакцию комплексообразования с борной кислотой. Концентрация полимера в готовом препарате – 4,0-5,0 %. Концентрация борной кислоты в синтезированном комплексе 0,69 моль/л, pH=9,0, содержание сухого вещества -5,5-6,0 %. Водный раствор комплекса имеет консистенцию геля. Препарат испытан для профилактики и лечения доминирующих раневых инфекций дистальных отделов конечностей у крупного рогатого скота при промышленных технологиях содержания.
Предполагаемое химическое строение комплекса:

Результаты исследований
При проведении микробиологического мониторинга за 5 лет был отмечен возросший удельный вес полирезистентных штаммов , Staphylococcus aureus (10,2-66,7%), множественная лекарственная устойчивость Staphylococcus epidermidis (14,1-55,6%) к трем и более препаратам антимикробного действия. В этих условиях появление в клинической практике новых антибактериальных препаратов, активных в отношении полирезистентных штаммов представляет огромный интерес. Такие препараты не должны вызывать развитие побочных эффектов (токсичность, формирование устойчивости бактерий, аллергенная сенсибилизация организма, подавление нормальной эндогенной микрофлоры) при контакте с кожными покровами, раневой поверхностью и слизистыми оболочками при применении данного препарата per os. Препарат должен иметь широкий антимикробный спектр, а так же повышенную активность в отношении патогенных энтеробактерий и кокков как основных этиологических факторов бактериальных осложнений при раневых инфекциях дистальных отделов конечностей. В последнее время в качестве химиотерапевтических препаратов привлекают к себе внимание различные органические производные бора, в том числе комплексные соединения борной кислоты.
Борная кислота в качестве наружного антисептика используется уже давно в виде различных лекарственных форм, таких как: пасты Теймурова, линимента «борно-цинкового», мазь «борная», раствор «фукорцин», раствора борной кислоты спиртового, глицериновый раствор натрия тетрабората. Недостатком данных лекарственных форм является свободная борная кислота и ее низкомолекулярные комплексы с трехатомными спиртами и ароматическими оксикарбоновыми кислотами и фенолами. Борная кислота относящиеся к 4 классу опасности является малотоксичным соединением, токсическая доза которой для млекопитающих составляет около 0,28 г/кг. Применение данных препаратов борной кислоты подразумевает быстрое поступление терапевтической дозы ионов бора (III) в организм, что может вызвать токсический эффект при декомпенсации выделительной способности почек[2,с.689].
Применение высокомолекулярных комплексов борной кислоты позволяет снизить побочные физиологические эффекты ионов бора, а так же усилить терапевтический эффект не только высвобождающимися ионами бора, но и возможно самим комплексом на основе ионов бора ферментативно расщепляемого в организме реципиента. Одним из таких комплексообразующих соединений с ионами бора, является дигидроксиалкилированный хитозан (ГАХ). Применение ГАХ обусловлено хорошей биосовместимостью его с тканями высших организмов, гипоаллергенностью и полным отсутствием токсических реакций при пероральном применении, а так же хорошими сорбционными и детоксикационными свойствами. Хитозан подвергается расщеплению в организме теплокровных ферментом лизоцимом (N-ацетил-β-D-глюкозаминидазой), который находится в различных биологических жидкостях организма человека, в том числе сыворотке крови (в концентрации 4-13 мг/л), в секретах слезных желез (450-1230 мг/л), как фактор неспецифического иммунитета. Последнее свойство обеспечивает естественное выведение полимера и его олигомеров из ротовой полости и желудочно-кишечного тракта.
Ранее были предложены антибактериальные препараты на основе комплексов ионов бора и продукта конденсации О- карбоксиметилхитозана с полиглицеролом (прототип). Гистологическими методами исследования доказано, что данный препарат не оказывал цитотоксического эффекта и быстро расщеплялся тканевыми ферментами при трансплантации образца лабораторным животным, имел высокий бактериостатический эффект в отношении грамположительных кокков Staphylococcus aureus. Комбинация растворов 0,5 % уксусной и 0,5 % борной кислот в соотношении 1:2 и 1:4 угнетает развитие грамположительного Staphylococcus pseudintermedius, что может быть использовано при лечении местных гнойных кожных инфекций у животных (прототип).
Недостатком данных композиций является в первом случае многостадийность синтеза комплексообразующего полимера на основе конденсированного карбоксиметилхитозана с полиглицеролом, во втором, применение свободной борной кислоты способной резорбироваться в жулудочно-кишечном тракте и с поврежденной поверхности кожи, оказывая системные нарушения работы почек, особенно при сопутствующей почечной недостаточности.
Задача разработки – создание антибактериальной композиции на основе высокоселективного к ионам бора лиганда – дигидроксипропилхитозана, синтезированного одностадийным синтезом из хитозана и глицидола с последующей селективной сорбцией ионов бора(III). Полученный комплекс должен удовлетворять современным требованиям лекарственной терапии заболеваний животных, осложненных мультирезистентными штаммами кокков и лишенный неблагоприятных побочных эффектов свободной борной кислоты. Данные свойства композиции достигаются образованием в щелочной среде четырехкоординированного комплекса ионов бора с дигидроксипропильными группами высокомолекулярного N,O-(2,3-дигидрокси) пропилхитозана (ГАХ).
Композиция имеет консистенцию геля на основе высокомолекулярного лиганда (оксиалкилированный хитозан и привитый низкомолекулярный полиглицерол) и борной кислоты, содержащий в своем составе три активных составляющих (ионы бора (III), полиглицерол, хитозан), оказывающих бактерицидный эффект при патологиях, осложненными патогенными кокками. Антибактериальный механизм комплексного препарата основан на создании временного депо ионов бора координационно связанных с высокомолекулярным лигандом (дигидроксипропил хитозан ГАХ). Постепенное высвобождение борной кислоты из комплекса приводит к высвобождению ионов бора и проявлению бактериостатического эффекта. Полиглицерол, входящий в состав комплекса, выполняет транспортную функцию, доставляя ионы бора в патологический очаг, способствуя усилению антибактериального эффекта. Высокая мукоадгезивность композиции, благодаря входящему в состав поликатиона- дигидроксипропил хитозана, обеспечивает связь препарата с межклеточным веществом поврежденных тканей и слизистыми оболочками желудочно-кишечного тракта. Таким образом, использование комплексного препарата позволяет существенно снизить дозы поступления основного действующего вещества (борат ион) и, следовательно, избежать побочных физиологических реакций, обеспечивая пролонгированное высвобождение ионов бора.
Приготовление композиции включает в себя следующие этапы. В качестве лиганда используется высокомолекулярный дигидроксипропилхитозан с максимальной степенью функционализации 2,0-2,6 и молекулярной массой полимерного звена, определенной по результатам элементного анализа (N- (O) 2,3-дигидроксипропил глюкозамин) 317,0-377,28. К навеске полимера массой 10,0 г добавляется раствор ионов бора с pH=9.0 с концентрацией ионов бора 7,5 г/л или в пересчете на борную кислоту моль/л (комплексообразователь). После непрерывного часового перемешивания для завершения сорбционных процессов и реакции комплексообразования, раствор выдерживается при 20,0-25,0 Co 24 часа без мешалки для седиментации коллоидного осадка. С образовавшегося осадка коллоида с координированными ионами бора декантируется сорбционный раствор. Содержание ионов бора в композиции определен с помощью атомно-эмиссионного метода анализа и составляет ___ моль/мл. Концентрация комплексообразующего полимера 4-5 %. Содержание сухого вещества 5,5-6,0 %.
Токсикологические исследования композиции проводились на лабораторных животных (белые мыши). Препарат вводился белым мышам (массой 25-30 г) в желудок, в нативном виде, с помощью шприца, на сосок которого надевался эластичный зонд, внутренний просвет которого 0,5-0,7 мм. Было испытано 4 дозы: 0,5мл, 1,0 мл, 1,5 мл, 2,0 мл. За животными вели наблюдение в течение 2-х недель после введения, учитывая общее состояние животных, сохранение двигательных функций, аппетита, состояние шерстного покрова, дыхание, реакцию на внешние раздражители. Проведенные исследования морфологического состава клеток крови и биохимические показатели сыворотки крови в опытной группе, не отличались от таковых в контрольной. При гистологическом исследовании внутренних органов от мышей, получавших препарат N,O-(2,3-дигидрокси) пропилхитозана (оксиалкилированный хитозан) с ионами бора в течение 20 дней, существенных изменений не обнаружено, которые можно было связать с отсутствием токсического воздействия препарата на организм. Установлено, что максимально переносимая доза препарата составляет 1600 мг/кг, профилактическая – 70 мг/кг, а терапевтический индекс (соотношение этих доз) – 22,8 , что указывает на достаточный предел безопасного применения препарата в ветеринарной медицине.
Токсическое воздействия комплекса ГПХ с ионами бора оценивали путем гистологического исследования печени и почек лабораторных мышей получавших принудительно препарат в течение 14 дней. Гистологические исследования включали в себя химическую обработку аутопсийного материала, приготовление парафиновых блоков, резку и окраску депарафинированных срезов (толщиной 5,0 мкм) с последующим заключением их в синтетическую полимерную среду. Резка парафиновых блоков осуществлялось на санном микротоме МС-3 по стандартной методике принятой в гистологии с использованием одноразовых лезвий DURAEDGE (США).
Исследования гистологических препаратов, приготовленных из паренхиматозных органов (печень, почки) лабораторных животных показали, отсутствие существенных изменений на тканевом уровне. Не выявлено изменений которые можно было связать с гистотоксическим, сенсибилизирующим или каким-либо иным повреждающим воздействием на специализированные клетки, а так же изменениями метаболизма в соединительной ткани и в кровеносных сосудах, входящих в состав гистиона данных органов. На рисунке 1 представлена типичная гистологическая картина паренхиматозных органов лабораторных животных, получавших препарат путем принудительного скармливания.
Рис. 1. Пример
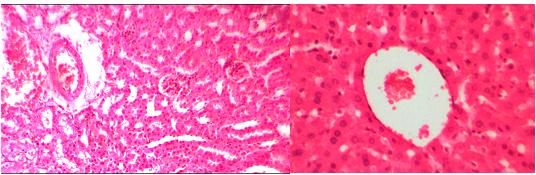
Рис.1.Пример микрофотографии гистологического среза почечной (вверху) и печеночной ткани (внизу) лабораторных животных (белые мыши), получавших препарат ГПХ с ионами бора. Окраска гематоксилин Майера-эозин
В качестве объектов исследования на бактериостатические свойства, использовали бактериальные культуры: Staphylococcus aureus, Klebsiella pneumoniae, Staphylococcus epidermidis выделенных от клинически больных животных раневыми инфекциями дистальных отделов конечностей. Минимальную ингибирующую концентрацию (МИК) определяли, используя серийные двойные разведения N,O-(2,3-дигидрокси) пропилхитозана (оксиалкилированный хитозан) с ионами бора на мясо-пептонном бульоне. В каждую пробирку вносили по 50 мкл физиологического раствора, содержащего суспензию бактерий в концентрации 6*10 7 КОЕ /мл. Контролем служила пробирка, содержащая чистую питательную среду.
Влияние концентрации композиции на динамику роста культуры в жидкой питательной среде исследовали по модифицированному методу. Для этого 50 мкл суспензии 18-часовой культуры бактерий, содержащей 6 *107 КОЕ/мл, добавляли к 100 мкл мясопептонного агара, содержащего испытуемый препарат в различной концентрации и рН 6,0. В контрольный вариант испытуемый препарат не добавлялся. Смесь инкубировали при 37 ºС на качалке при 180 об/мин.
Таблица 1 -Антибактериальная активность N,O-(2,3-дигидрокси) пропилхитозана (оксиалкилированный хитозан) с ионами бора в отношении штаммов бактерий, выделенных от животных с клиническими проявлениями заболеваний.
| Виды микроорганизмов | МИК,% |
| Staphylococcus aureus | 0,0002±0,00004 |
| Staphylococcus epidermidis | 0,00006±0,00004 |
Более чувствительными к действию вещества оказались Staphylococcus aureus и Staphylococcus epidermidis.Таким образом, грамотрицательные энтеробактерии оказались более устойчивыми к действию указанной композиции по сравнению с грамположительными кокками. Результаты биохимических исследований сыворотки крови показали, что после применения препарата N O-(2,3-дигидрокси) пропилхитозана (оксиалкилированный хитозан) с ионами бора нормализуются обменные процессы в организме животных при промышленных технологиях содержания ,что выражается в снижении уровня содержания общего белка, и достоверном повышении содержания кальция, фосфора и магния (табл. 2).
Таблица 2– Биохимические показатели сыворотки крови коров
| Группа | Кол-во живот-
ных(n) |
Показатели |
||||
| Общий белок, г/л | Щелочная фосфотаза, ммоль/л | Кальций, моль/л | Фосфор, моль/л | Магний, моль/л | ||
| Привязное содержание | 25 | 99,17±2,74 | 94,96±2,46 | 2,28±0,04 | 1,68±0,08 | 0,94±0,06 |
| Беспривязное содержание | 25 | 92,56±3,98 | 68,54±5,44** | 2,36±0,02** | 1,90±0,20* | 1,10±0,04** |
* Разница достоверна (P≤ 0,05)
** Разница достоверна (P≤ 0,01)
Препарат N O-(2,3-дигидрокси) пропилхитозана (оксиалкилированный хитозан) с ионами бора обладает противомикробной активностью по отношению к штаммам микроорганизмов, выделенных от больных животных с поражениями дистальных отделов конечностей, в том числе: Staphylococcus aureus, Staphylococcus epidermidis и способствует снижению заболеваемости при промышленных технологиях содержания. По результатам исследования на животных препарат не токсичен, хорошо переносится при наружном применении, наиболее эффективен при беспривязном содержании.
Литература.
- Нестеров Д. В.Новые методы получения и сорбционные свойства N,O-(2,3-дигидроксипропил)хитозана./ Д. В. Нестеров, Л. С. Молочников, А.В. Пестов, Е. Г. Маточкина, М. И .Кодесс , Ю. Г. Ятлук //Высокомолекулярные соединения.- Серия Б.- 2013.- том 55.- №8.- С.1140.
- Alenkar de Queiros et all. Physicochemical and antimicrobial properties of boron-complexed polyglycerol–chitosan dendrimers // J. Biomater. Sci. Polymer Edn, Vol. 17, No. 6., 2006. P. 689.[schema type=»book» name=»ПРЕПАРАТ НА ОСНОВЕ ДИГИДРОКСИПРОПИЛХИТОЗАНА (ГАХ) И ИОНОВ БОРА ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ДОМИНИРУЮЩИХ РАНЕВЫХ ИНФЕКЦИЙ ДИСТАЛЬНЫХ ОТДЕЛОВ КОНЕЧНОСТЕЙ КРУПНОГО РОГАТОГО СКОТА ПРИ ПРОМЫШЛЕННЫХ ТЕХНОЛОГИЯХ СОДЕРЖАНИЯ» description=» Препарат на основе дигидроксипропилхитозана (ГАХ) и ионов бора относится к ветеринарной медицине, а именно к лечению и профилактике инфекционной патологии животных и касается композиции на основе ионов бора и дигидроксипропилхитозана относительно патогенных форм кокков.» author=»Барашкин Михаил Иванович, Петрова Ольга Григорьевна» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-01-26″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_31.10.15_10(19)» ebook=»yes» ]

