Актуальность. Гетерогенность индивидуальных клинических фенотипов артериальной гипотонии (Аг), формирующихся в структуре вегетативных нарушений парасимпатической направленности посттравматического, инфекционного поражения центральной нервной системы (ЦНС), этиология и патогенез которых различны, тесно взаимосвязана с решением вопроса диагностики и выбора тактики лечения данной категории пациентов. Имеется немало наблюдений, свидетельствующих о том, что Аг отличается полиморфизмом клинических проявлений, сопровождающихся снижением физической и интеллектуальной работоспособности, что приводит к развитию синдрома средовой дезадаптации и снижению качества жизни [1].
На воздействие неблагоприятных факторов, оказывающих деструктивное влияние на нервную ткань, первым откликается эффекторное звено нервной системы, а эндокринные железы и иммунокомпетентные клетки вызывают развитие устойчивых, иногда необратимых патологических процессов [2]. Изменение функции иммунной системы существенно влияет на дилатацию и констрикцию сосудов, в основном, за счет инициации каскада цитокинов, индукции экспрессии рецепторов иммунокомпетентных клеток, стимуляции специфического антителообразования в ответ на эндогенные антигены, определяя индивидуальную иммунореактивность каждого пациента [3,4].
Существует определенный эпигенотип формирования Аг, зависящий от множества врожденных факторов резистентности и состояния нейро-иммунно-эндокринного комплекса, что проявляется на системном, органном, клеточном, субклеточном, рецепторном, медиаторном уровне и зависит от функции ионных каналов, экспрессии генной активности и структурных нарушений генома [5]. Под действием различных стрессорных факторов, среди которых чаще всего встречается травматическое поражение ЦНС, воздействие хронической инфекции и психоэмоционального стресса, формируются различные эпифенотипы, характеризующиеся клиническими особенностями течения различных форм Аг с сочетанием индивидуальных нарушений адаптационных возможностей, следствием которых является изменение взаимодействия нервной и иммунной систем. Разнообразие клинической вариабельности позволяет выделять селективные подгруппы, отличающиеся индивидуальными особенностями иммунорезистентности и изменений гормонального фона [6].
В соответствие с современными представлениями о механизмах поддержания гомеостаза и аллостаза организма, которые в последние десятилетия претерпели определенные изменения и разрушили традиционные представления о существовании структурно-функциональных границ между тремя регуляторными системами организма – нервной, иммунной и эндокринной, выявлено, что для обмена сигнальной информацией между клетками, тканями и органами существует общий молекулярный «язык» [7,8]. На основании исследований последних лет установлено, что различные клетки, принадлежащие к нервной, иммунной или эндокринной системе, синтезируют общие идентичные сигнальные молекулы – пептидные гормоны, биогенные амины, различные биологически активные вещества (цитокины, хемокины, интегрины), являющиеся медиаторами межклеточных взаимодействий [9]. Помимо нейронов, источниками цитокинов и других сигнальных молекул являются иммунокомпетентные клетки (макрофаги, Т-лимфоциты, дендритные клетки, эозинофильные лейкоциты) как резидентные, так и мигрирующие в головной мозг при повреждении или воспалительных процессах [10].
Иммунокомпетентные клетки, имея способность реагировать на «чужие» и «свои» антигены, могут не только ингибировать, но и стимулировать процессы кооперации с клетками нервной системы [11]. Существует своеобразная органоспецифичность и гетерогенность лимфоцитарних клеток в зависимости от их локализации в разных тканях. Т.е., те же самые факторы, которые индуцируют нарушение функции иммунокомпетентных клеток, могут вызывать структурно-функциональные изменения в нервной системе [12].
В головном мозге основной системой, регулирующей гомеостаз является вегетативная нервная система, а именно её парасимпатический отдел, поэтому, при возникновении вегетативных нарушений, формирующихся под воздействием различных стрессорных факторов (травматического, инфекционного характера либо хронического психоэмоционального стресса) развиваются механизмы, влияющие на гомеостаз [13]. Метаболические процессы, поддерживающие механизмы гомеостаза инициируются за счет активации агрессивных клонов Т-лимфоцитов, повышения аутоиммунных антител и увеличения аффинитета рецепторов тканевых антигенов. Одним из таких естественных механизмов является усиление функциональной активности гормонов коры надпочечников [14,15].
Известно, что стероидные гормоны надпочечников, индуцированные стрессорным воздействием, могут вызывать интенсивную инволюцию иммунокомпетентных органов – тимуса и селезенки, а также вызывать разрушение эндотелия сосудов и астроцитарную дисфункцию с последующим развитием сосудистой патологии. В соответствие с данным литературы [16,17], такой гормон надпочечников как кортизол обладает ингибирующим действием на синтез иммуноглобулинов, а также на регенеративные и пролиферативные процессы, способность фагоцитирующих мононуклеаров и гранулоцитарных нейтрофилов к хемотаксису и миграции. Кортизол, наряду с ингибирующим пролиферацию действием, тормозит функциональное состояние иммунокомпетентных клеток и угнетает бласттрансформацию, естественную цитотоксичность [18 ].
Результат взаимодействия нервной, иммунной и эндокринной систем на уровне афферентных и эфферентных звеньев является основой выбора индивидуальной стратегии адаптации, что приводит к сохранению на адекватном уровне церебрального кровотока, независимо от колебаний системного АД [19,20]. В настоящее время в качестве интегрального показателя адаптационных возможностей системы мозгового кровообращения рассматривается сосудисто-мозговая реактивность, обеспечивающая способность сосудов мозга реагировать на изменяющиеся условия функционирования, оптимизировать кровоток соответственно этим условиям и адекватно реагировать на стимулы различной природы [21].
Одной из основных задач системы мозгового кровообращения является минимизация отклонений циркуляторного и химического гомеостаза головного мозга при различных функциональных состояниях, что предполагает сложную структурно-функциональную организацию процесса регулирования мозгового кровотока, который осуществляется посредством механизмов ауторегуляции [22,23]. Суть понятия «реактивность сосудов мозга» заключается в возможности объективизации деятельности регуляторных механизмов, лежащих в основе управления мозговым кровообращением и обеспечивающих его функциональную устойчивость, что достигается применением специальных воздействий.
Нарушения в функциональном состоянии сосудорегуляторного аппарата может приводить к возникновению несоответствия между потребностями организма и сосудистыми реакциями. В этих случаях гипотония будет проявляться как патологическое состояние и недостаточность сосудистой регуляции разовьется тем скорее, чем меньше адаптационный резерв организма [24].
В соответствие с вышеизложенным целью нашей роботы явилось изучение изменения адаптационных возможностей организма у больных Аг в структуре вегетативных нарушений вагальной направленности посттравматического и инфекционного поражения ЦНС в соответствие с особенностями формирования индивидуального клинического фенотипа Аг с недостаточностью в Т-клеточном звене иммунитета и изменения гормонального фона.
Материалы и методы. Нами было обследовано три группы больных Аг в структуре вегетативных нарушений парасимпатической направленности при посттравматических и инфекционных поражениях ЦНС в возрасте от 18 до 46 лет, которые находились на стационарном лечении в неврологических отделениях Центральной клинической больницы «Укрзалізниці», а также были обследованы во время консультативного приема на кафедре неврологии и детской неврологии Харьковской медицинской академии последипломного образования. I группу составили 58 пациентов, страдающих конституционально-наследственно обусловленной вегетативной дисфункцией (ВД), протекающей по парасимпатическому типу. Во II группу вошли 44 пациента, перенесших закрытую черепно-мозговую травму, в результате чего с течением времени сформировалась неврологическая симптоматика, характерная для отдаленного периода закрытой черепно-мозговой травмы (ОПЗЧМТ). III группу составили 62 пациента, страдающих инфекционно-аллергическим церебральным арахноидитом (ЦА), симптоматика которого сформировалась на фоне наличия в организме хронических очагов инфекции тонзилогенной и риногенной локализации, обостряющихся 1-2 раза в год. В контрольную группу вошли 45 обследованных с физиологической артериальной гипотонией в возрасте от 18 до 46 лет с отсутствием субъективных симптомов, объективных данных и достаточным уровнем адаптации.
Всем обследованным больным было проведено всестороннее комплексное обследование, которое включало в себя традиционное клиническое обследование с подробным сбором и детализацией жалоб больного, анамнестических данных, отражающих историю развития и давность заболевания, а также изучение соматического, неврологического статуса проведенного по традиционной методике.
Контроль за артериальным давлением больным проводился трижды в течение суток 5 дней, а затем ежедневно в течение пребывания пациента на больничной койке. Средний койко-день составлял 10-12 дней. Пациентам, которые были обследованы в ходе консультативного приема, предлагалось самостоятельно проводить измерение АД троекратно в домашних условиях в течение 5 дней, о чем предоставлялись соответствующие записи.
Оценка состояния иммунной системы организма включала: определение изменений факторов первичного иммунного ответа — фагоцитарной активности гранулоцитарних нейтрофилов в лейкоцитарной суспензии, полученной из гепаринизированой крови. Микроскопирование фагоцитирующих клеток проводили под иммерсионной системой светового микроскопа; определение активности белков системы комплемента выявляли по потреблению его компонентов в реакции антигена с соответствующими комплемент-зависимыми антителами. Оптическую плотность образцов и контрольной пробы измеряли коллориметрически.
Состояние вторичного иммунитета включало: определение содержания сывороточных иммуноглобулинов (Ig) классов А, М и G при помощи спектрофотометрического метода с использованием стандартных наборов моноспецифических антисывороток к иммуноглобулинам каждого класса и контрольных сывороток с известным содержанием иммуноглобулинов (г/л); концентрацию циркулирующих иммунных комплексов (ЦИК) оценивали спектрофотометрически после инкубации образцов в боратном буфере и полиэтиленгликоле при комнатной температуре, а определение константы ЦИК сыворотки крови проводили с помощью спектрофотометрического метода — выявляли оптическую плотность ЦИК при длине волны λ=280 нм против гидроксида натрия; концентрацию пептидов средней молекулярной массы (ПСММ) оценивали с помощью спектрофотометрического метода — оптическую плотность образцов измеряли на спектрофотометре СФ-46 при l=254 нм (дейтериевая лампа) относительно дистиллированной воды; определение аутоиммунных антител проводили с помощью теста лимфоцитотоксичности (классический метод Терассаки), подсчет клеток проводили при помощи светового микроскопа.
О состоянии клеточного звена иммунитета судили по уровню экспрессии кластеров дифференцировки CD Т-лимфоцитов при помощи люминисцентного микроскопа.
Определение интерлейкина 2 (IL-2) и интерлейкина 4 (IL-4) проводили с помощью твердофазного иммуноферментного метода.
Определение тиреотропного гормона сыворотки крови (ТТГ) проводили с помощью иммуноферментного анализа.
Содержание кортизола в сыворотке крови больных определяли с помощью использования набора реактивов для радиоиммунологического анализа содержания кортизола с использованием СТЕРОН-К-125I-M. В основе метода лежит обратимая иммунохимическая реакция связывания 125I – кортизола и эндогенного кортизола с кроличьими антителами против кортизола (АТ-1).
Оценка выраженности адаптационных возможностей сосудистой системы проводили в бассейне основной артерии (ОА) при помощи метода транскраниальной допплерографии (ТКДГ) в покое и с применением функциональных нагрузочных проб: гиперкапнической нагрузки с произвольной задержкой дыхания в течении 20-30 секунд и гипервентиляционной нагрузкой, достигаемой путем спонтанной или индуцированной гипервентиляции в течение 25-30 секунд.
По результатам проведения функциональных проб рассчитывали коэффициенты реактивности, которые являются количественной характеристикой состояния системы регуляции мозгового кровообращения: коэффициент реактивности на гиперкапническую нагрузку (Кр⁺) [25]; коэффициент реактивности на гипокапническую нагрузку (Кр⁻) [25] и коэффициент вазомоторной реактивности (ИВМР) [26]. Расчет коэффициента реактивности на гиперкапническую нагрузку (Кр⁺) производят по формуле:
где:

где:
V⁰ – средняя максимальная ЛСК в покое (см/с),
V ˉ – средняя максимальная ЛСК на фоне гипокапнической нагрузки (см/с).
Тест с гипервентиляцией определяет резерв вазоконстрикции, который становится максимальным при наибольшей дилатации.
Коэффициент вазомоторной реактивности (ИВМР) рассчитывали по формуле:
![]()
Значения данного коэффициента дают интегральную оценку диапазона «подвижности» системы регуляции мозгового кровообращения в ответ на изменение молекулярного состава притекающей к мозгу крови [26].
Полученные результаты были подвергнуты математической обработке с использованием параметрических и непараметрических методов вариационной статистики и определением статистической значимости достоверности различий сравниваемых величин при помощи статистической программы STATGRAFICA 6.
Результаты исследования. Результаты исследования состояния первичного и вторичного иммунитета, их гуморального и клеточного звена позволили нам классифицировать обследованных больных Аг в соответствие с клиническими фенотипами, которые характеризовались особенностями клинического течения и индивидуальной гетерогенностью нарушений показателей регуляторных систем – нервной, иммунной и эндокринной, проявляющихся значительными разнонаправленными изменениями иммунорезистентности и гормонального фона. Патогенетической основой, на базе которой были сформированы индивидуальные неврологические фенотипы Аг, являлось изменение регуляции на медиаторном, субклеточном и клеточном уровне.
Одной из общих закономерностей для всех групп обследованных больных явилось наличие иммунодефицита в Т-клеточном звене иммунитета, что позволило нам выделить клинический фенотип Аг с недостаточностью в Т-клеточном звене. Формирование иммунодефицита в Т-клеточном звене иммунитета, о чем судили по наиболее значимому показателю – регуляторному индексу (коэффициент IPI), представляющему собой соотношение иммунорегуляторных клеток — субпопуляции CD4 Т-хелперов к субпопуляции CD8 Т-киллеров, было выявлено в 20% случаев в I группе больных с ВД; во II группе обследованных больных, отягощенных травматическим стрессорным воздействием на ЦНС, с большей частотой встречаемости – в 70,5% наблюдений и в III группе обследованных больных с церебральным арахноидитом недостаточность в Т-клеточном звене иммунитета отмечена в 28,8% наблюдений (табл.1).
Таблица 1
Частота встречаемости разнонаправленных показателей коэффициента IPI в обследованных группах больных артериальной гипотонией
|
Иммунологический показатель |
Градация |
Клинические формы |
|||||
| ВД | ОПЗЧМТ | ЦА | |||||
| n | % | n | % | n | % | ||
|
Коэффициент IPI |
<N | 12 | 20,7 | 31 | 70,5 | 17 | 28,8 |
| N | 35 | 60,3 | 9 | 20,5 | 11 | 18,6 | |
| >N | 11 | 19 | 4 | 9,1 | 31 | 52,5 | |
Примечание: n — абсолютное число пациентов в группе; % — частота встречаемости показателя;
N – диапазон нормальных значений коэффициента IPI (2,0-3,0%);
<N – активность комплемента меньше контрольных значений;
>N – активность комплемента выше контрольных значений.
Изменения регуляторного индекса отражает варианты иммунного ответа в Т-клеточном звене иммунитета в обследованных группах больных и может определять типы взаимодействий регуляторных систем организма.
Подобные изменения в Т-клеточном звене иммунитета отмечены на фоне незавершенности фагоцитоза, что свидетельствует о несостоятельности фагоцитарной функции гранулоцитарных нейтрофилов и может являться одним из патогенетических звеньев формирования переходных и необратимых патологических состояний. Недостаточность эндоцитоза микроорганизмов фагоцитирующими нейтрофилами зарегистрированы в 50% наблюдений во II группе, в 54,2% случаев в III группе больных, отягощенных стрессорными воздействием травмы и хронической инфекции, и в 51,7% наблюдений в I группе больных с ВД при спонтанном, а не индуцированном развитии Аг (рис.1).
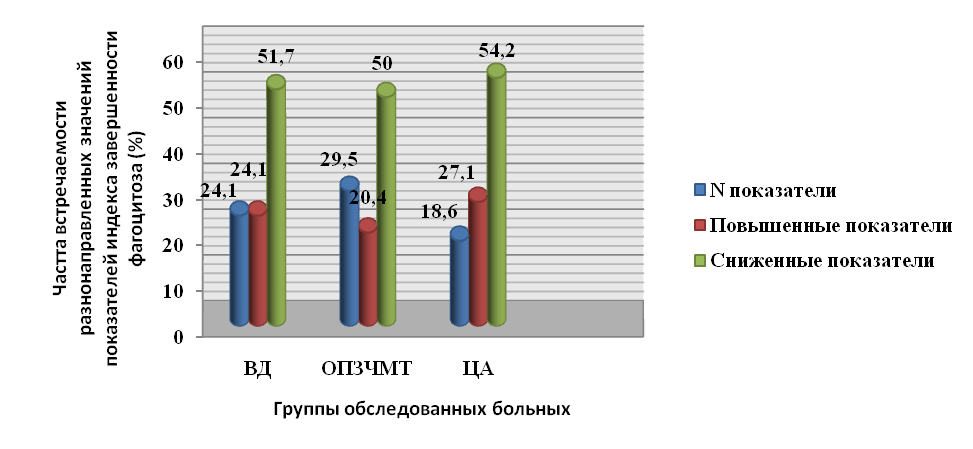
Рис.1. Частота встречаемости разнонаправленных показателей индекса завершенности фагоцитоза в обследованных группах больных артериальной гипотонией.
Показатели активности белков системы комплемента на фоне иммунодефицита в Т-клеточном звене иммунитета выявили отклонения от референтных значений в сторону активации фрагментов комплемента соответственно в 17,2% наблюдений в I группе, в 18,2% случаев во II группе и в 20,3% наблюдений в III группе. Поскольку компоненты системы комплемента принимают участие в регуляции микроциркуляции и, взаимодействуя с клетками эндотелия, способствуют вазодилятации, то можно предположить, что активация компонентов системы комплемента может оказывать влияние на снижение системного артериального давления (табл.2).
Таблица 2
Частота встречаемости различных градаций показателей белков системы комплемента в обследованных группах больных артериальной гипотонией
| Показатели
Иммунологический показатель |
Градация |
Клинические формы |
|||||
| ВД | ОПЗЧМТ | ЦА | |||||
| n | % | n | % | n | % | ||
| Активность белков системы комплемента | <N | 26 | 44,8 | 26 | 59,9 | 40 | 67,5 |
| N | 22 | 38 | 10 | 21,9 | 7 | 12,2 | |
| >N | 10 | 17,2 | 8 | 18,2 | 12 | 20,3 | |
Примечание: n — абсолютное число пациентов в группе; % — частота встречаемости показателя;
N – диапазон нормальных значений белков системы комплемента (0,9-1,2%);
<N – активность комплемента меньше контрольных значений;
>N – активность комплемента выше контрольных значений.
У большинства пациентов с иммунодефицитом в Т-клеточном звене иммунитета выявлено снижение содержания всех классов иммуноглобулинов, за исключением III группы больных, отягощенных наличием хронических очагов инфекции в организме, где содержание IgM в 6,8% случаев находилось в пределах референтных значений, уровень которых составил 1,01±0,2 г/л, а в 3,4% наблюдений значения были снижены до 0,8±0,3 г/л (табл.3).
Таблица 3
Распределение пациентов с артериальной гипотонией в селективных подгруппах с разнонаправленными значениям трех классов иммуноглобулинов
|
Показатели |
Клинические формы |
||||||
|
Класс иммуноглобулинов |
Градация |
ВД | ОПЗЧМТ | ЦА | |||
| n | % | n | % | n | % | ||
|
IgM |
<N | 55 | 94,8 | 39 | 88,6 | 2 | 3,4 |
| N | 1 | 1,7 | 4 | 9,1 | 4 | 6,8 | |
| >N | 2 | 3,4 | 1 | 2,3 | 53 | 89,8 | |
Примечание: n — абсолютное число пациентов в группе; % — частота встречаемости показателя;
N – диапазон нормальных значений иммуноглобулинов IgM (0,5-1,8 г/л);
<N – показатели меньше контрольных значений;
>N – показатели выше контрольных значений.
Изменения во вторичном звене иммунитета характеризовались у данной категории больных преимущественно нормальными и у части пациентов сниженными и повышенными значениями концентрации ЦИК малых и больших значений молекулярной массы.
В I группе в 21,2% наблюдений значения концентрации ЦИК находилась в пределах нормальных значений и в 18,3% случаев показатели были повышены, в 38,6% случаев во II группе и в 45,8% случаев в III группе концентрация ЦИК была в норме. Средние и большие значения молекулярной массы у описанной категории больных преобладали в 36,2% случаев в I группе, в 31,8% наблюдений во II группе и в 33,9% случаев в III группе, т.е. не обладали выраженным патогенным действием.
Повышение содержания ПСММ было отмечено в 32% наблюдений в I группе больных, в 29% случаев во II группе и в 34,1% наблюдений в III группе, в остальном, значения концентрации ПСММ находились в группах в пределах нормы, соответственно: в 19% наблюдений в I группе, в 18% случаев во II группе и в 6,8% наблюдений в III группе (рис.2).
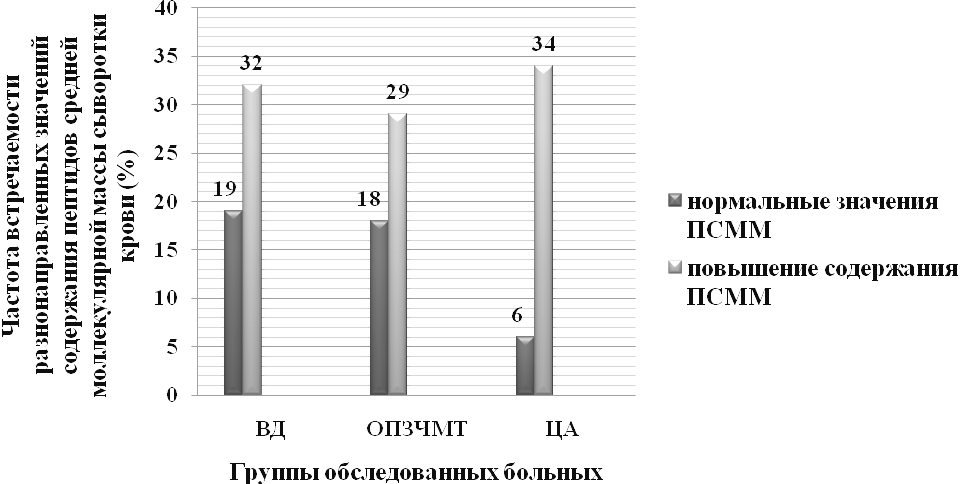
Рис.2. Частота встречаемости больных с разнонаправленными показателями пептидов средней молекулярной массы сыворотки крови в обследованных группах больных.
Изменения во вторичном звене иммунитета в I группе можно расценить как переходное физиологическое состояние на фоне иммунодефицита в Т-клеточном звене, которое при определенных условиях (психоэмоциональные перенапряжения, перенесенные инфекции, травмы и иные средовые воздействия) могут сформировать необратимые физиологические процессы, а при благоприятном течении могут быть обратимы.
Содержание аутоантител у больных с недостаточностью в Т-клеточном звене иммунитета было повышено соответственно в 22,8% наблюдений в I группе, в 36,8% случаев во II группе и в 40% наблюдений в III группе (рис.3).
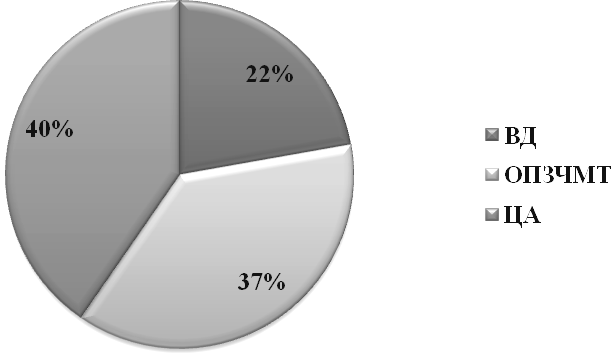
Рис.3. Частота встречаемости разнонаправленных показателей лимфоцитотоксичности у пациентов с недостатосчностью в Т-клеточном звене иммунитета.
Данный факт можно объяснить склонностью к пароксизмальному течению клинической картины заболевания в описанных группах, где наряду с преобладание синкопальных пароксизмов, которые отмечены соответственно в 14,3% наблюдений в I группе, в 17,3% случаев во II группе и в 29,8% наблюдений в III группе, отмечены эпиприпадки в 2% наблюдений во II группе и в 5% случаев в III группе. На наш взгляд, подобный тип течения клинической картины можно расценить как своеобразное дополнительное стрессорное воздействие, сопровождающееся усилением аутоантигенной активности, которая, в свою очередь, приводит к индукции измененного иммунного ответа и формирует выраженные структурные изменения в ткани мозга (гидроцефалия, гипотрофия коры головного мозга), что в дальнейшем усугубляет выраженность неврологических нарушений.
Характерным фактом является и то, что в клиническом фенотипе с иммунодефицитом в Т-клеточном звене иммунитета выявлены нарушения в содержании кортизола и ТТГ в сторону повышения значений во всех группах обследованных больных, соответственно: уровень кортизола в 89,7% в I группе, в 93,2% случаев во II группе и в 79,7% наблюдений в III группе (табл.4); содержание ТТГ в 67,2% наблюдений в I группе, в 95,5% случаев во II группе и в 69,5% наблюдений в III группе (рис.4).
Таблица 4
Частота встречаемости разнонаправленных показателей концентрации кортизола в обследованных группах больных артериальной гипотонией
|
Иммунологический показатель |
Градация |
Клинические формы |
|||||
| ВД | ОПЗЧМТ | ЦА | |||||
| n | % | n | % | n | % | ||
|
Кортизол |
<N | 3 | 5,2 | 1 | 2,3 | 9 | 15,3 |
| N | 2 | 3,4 | 2 | 4,5 | 3 | 5,1 | |
| >N | 52 | 89,7 | 41 | 93,2 | 47 | 79,7 | |
Примечание: n — абсолютное число пациентов в группе; % — частота встречаемости показателя;
N – диапазон нормальных значений концентрации кортизола (140-600 нмоль/л);
<N – концентрация кортизола меньше контрольных значений;
>N – концентрация кортизола выше контрольных значений.
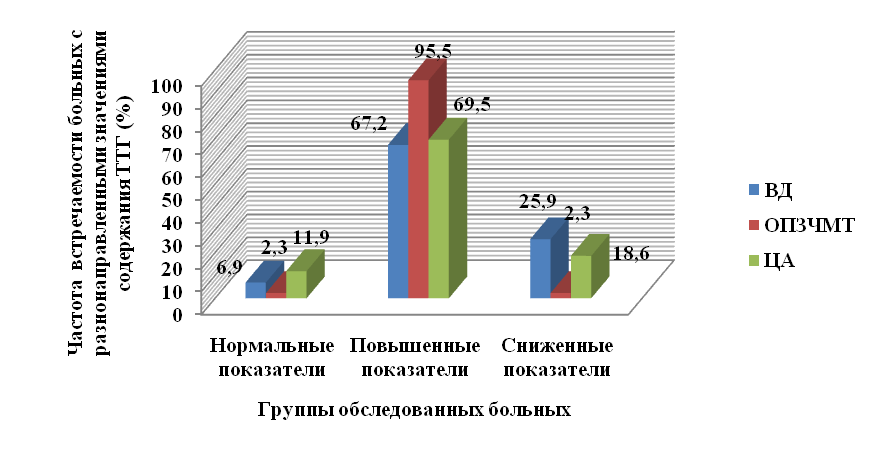
Рис.4. Частота встречаемости больных с разнонаправленными значениям тиреотропного гормона в обследованных группах больных артериальной гипотонией.
Клиническая картина неврологических проявлений у данной категории больных отличалась многообразием вегетативных проявлений, протекающих по парасимпатическому типу. Обращает на себя внимание склонность к пароксизмальному течению заболевания при выраженности иммунологической анергии и усилении синтеза гормонов гипофиза и надпочечников. Причем, по характеру клинической симптоматики превалировали синкопальные пароксизмы. Вышеописанную субъективную симптоматику сопровождали изменения в психоэмоциональной сфере. Выявлена склонность у обследованных пациентов к астеническим состояниям примерно в равных соотношениях: в 17,9% в I группе, в 40% во II группе и в 41,9% наблюдений в III группе; повышенная раздражительность отмечена у 14,6% больных I группы, 22,5% пациентов II группы и 14% больных III группы; ощущение тревоги и страха выявлено примерно в равных пропорциях: 4,4% в I группе, 8% во II группе и 9,6% в III группе. Кроме того, отмечена выраженная гетерогенность неврологических симптомакомплексов (ликворно-венозная дистензия, синдромы двигательных, чувствительных, координаторных нарушений), свидетельствующих об органическом поражении головного мозга, что подтверждалось структурно-функциональными изменениями при объективном обследовании (наличие наружной, внутренней либо смешанной гидроцефалии, гипотрофии коры головного мозга, кистозно-слипчивого процесса в оболочках мозга).
На фоне иммунодифицита в Т-клеточном звене иммунитета выявлено умеренно выраженное повышение содержания провоспалительных и противовоспалительных цитокинов, преимущественно во II и III группах, а в I группе значения IL2 были снижены по сравнению с контролем в 4 раза.
При исследовании состояния церебральной гемодинамики с применением функциональных нагрузок (гиперкапнической и гипревентиляционной) выявлено, что во II и III группах больных отмечена склонность к вазодилятации церебральных сосудов на фоне снижения системного артериального давления и напряжение адаптационных возможностей резистивных сосудов, а также повышение индекса вазомоторной реактивности в 2-3 раза по сравнению с референтными значениями, преимущественно в III группе, результаты которых в группах составили 58,3% в I группе, 51,9% во II группе и 60,9% в III группе (в контроле 20,1%) (табл.5).
Таблица 5
Показатели индексов реактивности в бассейне основной артерии у больных артериальной гипотонией в трех обследованных группах
|
Допплерогра фические показатели |
Группы обследованных больных |
|||
| Контрольная группа
n=45 (абс.) |
I группа
(ВД) n=64 (абс.) |
II группа (ОПЗЧМТ)
n=42 (абс.) |
III группа (ЦА)
n=53 (абс.) |
|
| Кр+(%) | 9,14±9,4 | 28,2±33,6* | 24,7±35,03* | 42,1±44,4* |
| Крˉ(%) | 11,03±5,3 | 30,54±16,2* | 27,5±25,6* | 18,7±28,8* |
| ИВМР(%) | 20,1±5,8 | 58,3±34,7* | 51,9±24,4* | 60,9±27,7* |
Примечание:*-достоверное отличие исследуемого показателя от контроля (р<0,05).
Обращает на себя внимание тот факт, что при гипервентиляции в обследованных группах больных выявлена тенденция к повышению значений, вместо снижения в норме, т.е. пародоксальную реакцию, что можно расценить как проявление напряжения механизмов ауторегуляции, вследствие снижения артериального давления. Наибольшую выраженность полученные результаты имели в I и во II группах обследованных больных, где значения были повышены соответственно в 3 раза, а в III группе всего в 1,5 раза.
Обсуждение полученных результатов. Способ выбора тактики лечения больных Аг, в основе которого лежат различные патогенетические механизмы, участвующие в формировании Аг, должны быть направлены на улучшение гемодинамики, нормализации вегетативных проявлений, снижения выраженности ликворно-гипертензионных проявлений, а также уменьшении выраженности симптомов, свидетельствующих об органическом поражении ЦНС и на увеличение общей резистентности к факторам окружающей среды.
Из всех исследуемых показателей мы выбрали наиболее значимые и достоверно изменяющиеся параметры, комплексная оценка которых позволила нам выделить клинический фенотип Аг с недостаточностью в Т-клеточном звене иммунитета (рис.5).
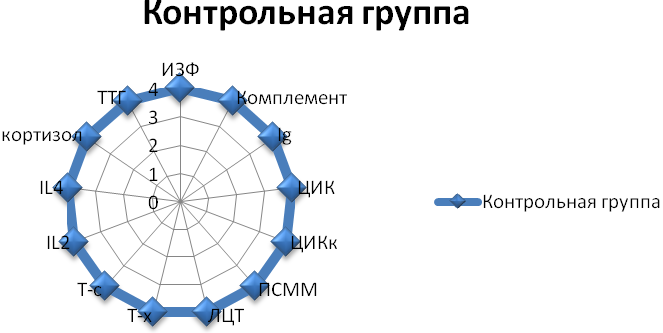
Рис. 5. Значения всех показателей иммунорезистентности в контрольной группе. Представлены в условных единицах и единицах концентрации. Для визуализации в лепестковых диаграммах контрольные величины исследуемых показателей принимали за 100%, а величины этих показателей в трех исследуемых группах выражали в процентах (рис.5).
Соотношения исследуемых показателей резистентности у больных с выраженной недостаточностью функционального состояния Т-лимфоцитов на фоне значительного увеличения концентрации кортизола и ТТГ, а также умеренно выраженных изменений в гуморальном звене иммунитета проиллюстрированы на рис.6.
Повышение содержания кортизола и ТТГ в сыворотке крови больных коррелирует с ингибированием кластеров дифференцировки Т-лимфоцитов и угнетением их функционального состояния, поскольку, под действием кортизола тормозится миграция и рециркуляция Т-лимфоцитов из вилочковой железы, снижается выход лимфоцитов в кровоток, более чем в 3 раза, что согласуется с данными литературы.
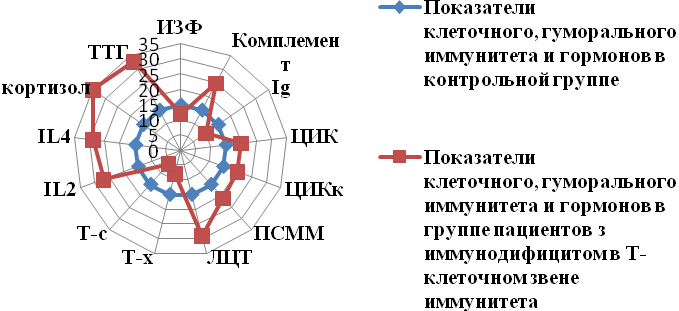
Рис.6. Соотношение звеньев иммунитета, уровня гормонов в индивидуальном клиническом фенотипе артериальной гипотонии с недостаточностью в Т-клеточном звене иммунитета
Подобные изменения, в свою очередь, сопровождались выраженной неврологической симптоматикой, свидетельствующей об органическом поражении ЦНС, склонностью к вазодилятации церебральных сосудов и у части пациентов напряжении механизмов ауторегуляции церебрального кровотока (рис.7).
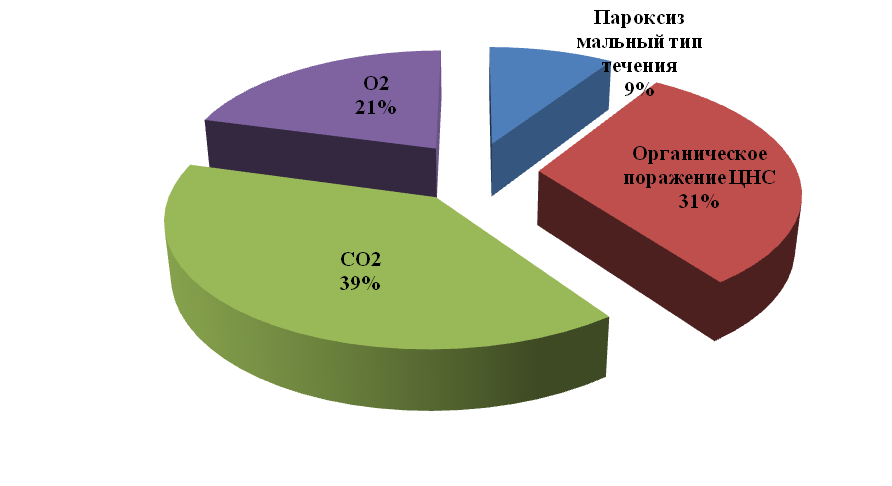
Рис.7. Частота встречаемости органической неврологической симптоматики и изменения адаптационных возможностей церебрального кровотока в индивидуальном клиническом фенотипе артериальной гипотонии с недостаточностью в Т-клеточном звене иммунитета.
Стероидные гормоны надпочечников, индуцированные стрессорным влиянием (психоэмоциональный стресс, травмы, хронические инфекции и т.д.) могут также вызвать разрушение эндотелия сосудов и астроцитарную дисфункцию с последующим развитием сосудистой патологии, что подтверждается нарушением церебральной гемодинамики и проявляется склонностью к церебральной вазодилятации сосудов на фоне снижения системного артериального давления и выраженного напряжения адаптационных возможностей резистивных сосудов.
Повышение индексов реактивности на гиперкапническую пробу, соответственно во II и III группах в 2 и 5 раз, и гипервентиляционную пробы в группах, отягощенных травмой и наличием хронической инфекции, соответственно в 1,5 и 2,5 раза, в состав неврологического симптомокомплекса которых входит синдром ликворно-венозной дистензии, свидетельствует о склонности к церебральной вазодилятации, которая явялется фактором, усугубляющим ликворную гипертензию. Применение функциональных нагрузок с гипервентиляцией может вызывать существенную дезадаптацию патологического компенсаторного иммунологического модуля, что проявляется в виде выраженного иммунопатологического дисбаланса и нарушения функции всех регуляторных систем.
Изменение молекулярного состава крови, напряжение «химизма» за счет перенасыщения CO2 и O2, снижение фагоцитирующей активности нейтрофилов, индукция в Т-клеточном звене иммунитета, формирует патологическую толерантность иммунопатологических реакций и развивается иммунодефицит.
Изменения в первичном и вторичном звеньях иммунитета на фоне иммунодефицита в Т-клеточном звене можно расценить как переходное физиологическое состояние, которое при определенных условиях (психоэмоциональные перенапряжения, перенесенные инфекции, травмы и иные средовые воздействия) могут сформироваться в необратимые физиологические процессы, а при благоприятном течении могут быть компенсированы.
Склонностью к вазодилятации и напряжению адаптационных возможностей церебральных сосудов, а также повышению индекса вазомоторной реактивности в 2-3 раза в ответ на перенасыщение CO2 и О2, что корелировало с высоким содержанием кортизола, а также снижением фагоцитирующей активности нейтрофилов и активации системы комплемента. В результате этого происходит угнетение функции ферментов, обеспечивающих образование активных форм кислорода (АФК) внутри фагоцитирующей клетки и, в конечном итоге, нарушению процесса эндоцитоза антигенов, т.е. нами выявлена взаимосвязь высокого содержания СО2 и О2 в церебральном кровотоке и угнетением функции ферментов, обеспечивающих образование активных форм кислорода, которые необходимы для нормального функционирования фагоцитирующей клетки, в результате чего обеспечивается адекватный иммуногенетический контроль в тканях и эндотелии сосудов.
Выводы. Таким образом, анализ полученных результатов позволяет нам сделать вывод о том, что снижение адаптационных потенций нервной системы может сопровождаться нарушением метаболических процессов, следствием которых является разбалансированность взаимодействия медиаторных факторов, обеспечивающих реакцию нервной и иммунной систем. Под действием различных стрессорных факторов, среди которых чаще всего встречается травматическое поражение ЦНС, воздействие хронической инфекции и психоэмоционального стресса, формируются различные эпифенотипы, характеризующиеся клиническими особенностями течения различных форм Аг с сочетанием индивидуальных нарушений адаптационных возможностей. Эта клиническая вариабельность позволяет выделять селективные подгруппы, отличающиеся индивидуальными особенностями иммунорезистентности и изменений гормонального фона.
Роль нервной системы в этиологии и патогенезе артериальной гипотонии подтверждаются данными о том, что непосредственное повреждение ЦНС при ЗЧМТ, церебральном арахноидите и при вегетативной дисфункции, а также ее перенапряжение вследствие стресса, вызванного перечисленными факторами, приводит к торможению функциональной активности иммунокомпетентных клеток, в том числе, в результате массивного фармакологического влияния, чаще всего не всегда оправданного, что приводит к возникновению стойких необратимых изменений как в нервной так и в иммунных системах.
Формирование обратимых и необратимых патологических состояний зависит во многом от выбора стратегии адаптации организма и в комплексном лечении этих больных целесообразно учитывать подходы к направленной коррекции выявленных нарушений звеньев иммунитета. Следовательно, для пациентов с выраженной недостаточностью в Т-клеточного звена иммунитета на фоне несостоятельности функции эндоцитоза фагоцитов следует применять иммунокорректоры (полиоксидоний, ликопид и пептидные препараты).
Коррегируя иммунный ответ с помощью монолигантных и полилигантных препаратов доступными являются ключевые интегральные механизмы поддержания гомеостаза и алостаза.
Список литературы.
- Голубева В.Л. Вегетативные расстройства (клиника,диагностика, лечение) / В.Л.Голубева // Медицинское информационное агенство Москва. – 2010. – 635 с.
- Барсуков А.В. Кардиометаболический синдром: насколько важна в реальной практике активация PRАR–рецептров? / А.В. Барсуков // Артериальная гипертензия. – 2008. – № 14. – С. 116–124.
- Акмаев И.Г. Современные представления о взаимодействиях регулирующих систем: нервной, эндокринной и иммунной / И.Г Акмаев // Успехи физиологических наук. – 1996. – № 1. – С. 3–20.
- Кветной И.М. Гормональная функция неэндокринных клеток: роль нового биологического феномена в регуляции гомеостаза / И.М. Кветной, И.Э. Ингель // Бюллетень экспериментальной биологии и медицины. – 2000. – № 11. – С. 483–487.
- Березин В.А. Специфические белки нервной ткани / В.А. Березин, Я.В. Белик. – Киев: Наукова думка, 1990. – 262 с.
- Кветной И.М. Нейроиммунноэндокринология тимуса / И.М. Кветной, А.А. Ярилин, В.О. Полякова. – СПб.: Деан, 2005. – 156 с.
- Райхлин Н.Т. APUD–система: (общепатологические и онкологические аспекты) / Н.Т. Райхлин, И.М. Кветной, М.А. Осадчук. – Обнинск: Изд–во МРНЦ РАМН, – 278 с.
- Пальцев М.А. Межклеточные взаимодействия / М.А. Пальцев, А.А. Иванов, С.Е. Северин. – М.: Медицина, 2003. – 287 с.
- Ефремова Н.М. Содержания белка S100 и первичных и вторичных антител к нему у больных с острой церебральной ишемией в зависимости от патогенетических вариантов инсульта / Н.М. Ефремова, В.И. Скворцова, М.А. Грудень // Современные подходы к диагностике и лечению нервных и психических заболеваний. – СПб.: Пресс. Информ, 2000. – С. 45–48.
- Симбирцев А.С. Цитокины: классификация и биологические функции / А.С. Симбирцев // Цитокины и воспаление. – 2004. – № 3. – С. 16–22.
- Ланкин В.З. Свободнорадикальные процессы в норме и при патологических состояниях: пособие для врачей / В.З. Ланкин, А.К. Тихазе, Ю.Н. Беленков . – М., 2001. – 78 с.
- Пащенков М.В. Основные свойства дендритных клеток / М.В. Пащенков, Б.В. Пинегин // Иммунология. – 2001. – № 4. – С. 7–16.
- Вейн А.М. Неврологические синдромы / А.М. Вейн, В.Л. Голубев. – М.: МЕДпресс-информ, 2011. – 736 с.
- Кветной И.М. Диффузная эндокринная система / И.М. Кветной, В.В. Южаков // Руководство по гистологии. Т. 2 / ред. Р.К. Данилов. – СПб.: Спецлит, 2001. – С. 509–541.
- Корнева Е.А. Гормоны и иммунная система / Е.А. Корнева, Э.К. Шхинек. – Л.: Наука. – 1988. – 177 с.
- Рабсон А. Основы медицинской иммунологии / А. Рабсон, А. Ройт, П. Делвз. – М.: Мир, 2006. – 315 с.
- Резников А.Г. Современные концепции в эндокринологии / А.Г. Резников // Лікування та діагностика. – 2005. – № – С.11–17.
- Черный В.И. Нарушение в системе гомеостаза при критических состояниях / В.И. Черный, Т.П. Кабанько, И.В. Кузнецова. – К.: Здоров’я, 2000. – 203 с.
- Сорокин О.В. Структурная архитектоника нейроиммунной системы / О.В. Сорокин, Е.В. Маркова, В.В. Абрамов // Нейроиммунология. – 2005. – № 2 – С. 196.
- Шевченко К.В. Изменения иммунного статуса у пострадавших в остром периоде черепно-мозговой травмы / К.В. Шевченко, В.А. Четвертных, Ю.И. Кравцов // Казанский медицинский журнал. – 2009. – № 5. – С. 663–667.
- Атаян А.С. Идиопатическая артериальная гипотензия: поражение головного мозга, церебральная и центральная гемодинамика / А.С. Атаян, В.Вл. Машин, А.В. Фонякин // Материалы 45–й научно–практической межрегиональной конференции врачей Ульяновской области. –Ульяновск, 2011. – С. 399–401.
- Атаян А.С. Неврологические нарушения и церебральная гемодинамика при идиопатической артериальной гипотензии / А.С. Атаян, В.Вл. Машин, А.В. Фонякин // Казанский медицинский журнал. – 2011. – № 3. – С. 403–407.
- Ярилин А.А. Цитокины в тимусе. Выработка и рецепция цитокинов / А.А. Ярилин // Цитокины и воспаление. – 2003. – № 1. – С 3–13.
- Бабияк В.И. Мозговые оболочки и их заболевания. (Сообщение третье) / В.И. Бабияк, М.И. Говорун, А.Н. Пащинин // Российская оториноларингология. – 2006. – № – С. 58–69.
- Lindegaard K.F. Bakke SJ, Grolimund P, Aaslid R, Huber P, Nornes H: Carotid Evaluation of cerebral AVM s using transcranial Doppler ultrasound // Lindegaard K.F., Bakke SJ, Grolimund P. et al. / J Neurosurg 1986 V. 65. P. 335-344.
- Ringeistein E. В, Sievers С Ecker S et al. Noninvasive assessment of CO2-induced cerebral vasomotor response in normal individuals and patients with ICA occlusions // Stroke 1988. V. 19 №8 P 963-969.[schema type=»book» name=»Формирование индивидуального клинического фенотипа с недостаточностью в Т-клеточном звене иммунитета у больных артериальной гипотонией в структуре неврологических симптомакомплексов посттравматического и инфекционного поражения центральной нервной системы» description=»Цель. Изучение особенностей формирования индивидуального клинического фенотипа артериальной гипотонии с недостаточностью в Т-клеточном звене иммунитета у больных артериальной гипотонией в структуре вегетативных нарушений вагальной направленности посттравматического и инфекционного поражения центральной нервной системы. Материалы и методы. Обследовано 164 пациента с артериальной гипотонией. Выполнены клинические и неврологическое обследования, мониторинг артериального давления, допплерогафическое обследование, определение состояния первичного, вторичного иммунитета и гормонального фона. Результаты. Выраженная недостаточность в Т-клеточном звене иммунитета сопровождалась несостоятельностью функции эндоцитоза фагоцитирующих клеток, активацией системы комплемента с последующим запуском иммунопатологических реакций вторичного типа, высоким уровнем кортизола и тиреотропного гормонов сыворотки крови, способных вызывать интенсивную инволюцию иммунокомпетентных органов, разрушение эндотелия сосудов на фоне выраженной неврологической симптоматики, склонности к вазодилятации церебральных сосудов и напряжении механизмов ауторегуляции церебрального кровотока. Выводы. Основой выбора индивидуальной стратегии адаптации, которая приводит к сохранению на адекватном уровне церебрального кровотока, независимо от колебаний системного артериального давления, является взаимодействие нервной, иммунной и эндокринной систем на уровне афферентных и эфферентных звеньев. » author=»Зинченко Елена Константиновна» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-02-24″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_25.07.15_07(16)» ebook=»yes» ]

