Злокачественные глиомы составляют около 60% от всех первичных опухолей центральной нервной системы и в последние десятилетия во всем мире и России наблюдается рост заболеваемости опухолями головного мозга (ОГМ). Современная тактика лечения больных глиальными опухолями головного мозга включает в себя их микрохирургическое удаление, лучевую и химиотерапию. Химиотерапия, биотерапия (интерфероны, интерлейкины, вакцины), гормонотерапия, а также молекулярно-нацеленная и генная терапия в последние годы играет существенную роль в лечении злокачественных глиом помимо лучевой терапии [1]. Однако, чувствительность к цитостатикам злокачественных опухолей головного мозга различных гистологических типов различна [2,3]. Тактика лечения нейроонкологических больных определяется на основании гистологического диагноза, который далеко не всегда в точности характеризует гистобиологическую агрессивность опухолей [4]. Кроме того, также известно, что все глиальные опухоли являются потенциально злокачественными, могут содержать «островки» анапластической астроцитомы, глиобластомы, что затрудняет их радикальное удаление, и послеоперационное применение адъювантной лучевой терапии или химиотерапии. С появлением методов иммуногистохимии расширились диагностические возможности для углубленной оценки гистобиологических свойств глиальных опухолей.
В настоящее время известны некоторые гистологические маркеры глиальных опухолей, определяющие прогноз лечения и химиочувствительность [5]. Несмотря на имеющиеся достижения, эффективность методов лечения глиальных опухолей недостаточна, что является причиной продолжения изучения морфологических и иммуногистохимических характеристик данных новообразований.
Целью нашего исследования явилось изучение сравнительных морфоиммуногистохимических показателей и коннексинов в астроцитомах головного мозга различной степени злокачественности с целью обосновать их комплексное лечение и улучшение его результатов.
Материалы и методы. Под наблюдением с 2013 по 2015 г.г. находились 95 больных. Из них – 19 больных, оперированы по поводу GrI астроцитомы (11 женщин, 8 мужчин), 21 человек — по поводу – астроцитомы GrII (12 женщин и 9 мужчин), 28 человек – астроцитомы GrIII (16 женщин и 12 мужчин), 27 чел. – GrIV-глиобластомы (14 женщин и 13 мужчин). Возраст больных был от 32 до 74 лет (средний возраст 53±14 лет). Для всех больных комплексное лечение заключалось в оперативном вмешательстве с микрохирургическим удалением опухоли в пределах здоровых тканей, адъювантной дистанционной гамма-терапей (ДГТ) и последующими курсами химиотерапии. Во время удаления опухоли с разрешения этического комитета института и согласия больных для гистологического и иммуногистохимического исследования забирался фрагмент опухоли объемом 1 см3.
Больные с астроцитомами GrI и GrII получили курс адъювантной дистанционной гамматерапии (ДГТ) до СОД 60 Гр и последующие курсы химиотерапии ломустином в дозе 100 мг/м2. Больные с астроцитомой GrIII и астроцитомой GrIV (глиобластомой) получали курс адъювантной дистанционной гамматерапии до СОД 60 Гр на фоне курса монохимиотерапии карбоплатином в дозе 50 мг в 1-й и 8-й дни ДГТ для усиления радиочувствительности опухоли, а впоследствии – курсы полихимиотерапии: карбоплатин, винкристин и перорально – ломустин в общепринятых дозировках. С помощью магнитно-резонансной томографии (МРТ) с контрастированием, которую проводили каждые 6 недель, выявляли отсутствие или наличие продолженного роста опухоли.
Нами использовался ступенчатый подход к химиотерапии, то есть, пациентам проводилась высокодозная многокурсовая внутриартериальная химиотерапия препаратами платины или полихимиотерапия по схеме: Карбоплатин+ Винкристин+ перорально Ломустин. Если пациент соглашался на имплантацию артериальной тромборезистентной порт-системы перед операцией по удалению опухоли, то в случае интраоперационного срочного гистологического подтверждения астроцитомы GrIII или GrIV ему имплантировали данную порт-систему. Она позволяет проводить многокурсовую внутриартериальную химиотерапию. В случае отказа на предлагаемую имплантацию данной порт-системы пациент получал системную полихимиотерапию.
По вариантам химиотерапии пациенты с астроцитомами GrIII и GrIV были распределены на 2 подгруппы каждая. В группе больных с астроцитомой GrIII 1-й подгруппе GrIII (1п/г GrIII), состоящей из 15 больных, после имплантации тромборезистентной внутриартериальной порт-системы «Селсайт» была выполнена внутриартериальная химиотерапия Карбоплатином в дозе 300 мг, введенным иньектоматом в течение 4 часов на аутоплазме больного. Длительность инфузии 4 часа обусловлена предупреждением возможных токсических осложнений, вызываемых введением внутриартериально химиопрепаратов в более короткий временной промежуток. Второй подгруппе GrIII (2п/г GrIII) – 13 больным проведена полихмиотерапия по схеме: Карбоплатин-150 мг, Винкристин-2 мг, peros Ломустин-200 мг.
В 1-й подгруппе (1п/г GrIII) в течение 18 месяцев с момента операции и начала комплексного лечения у 5 больных астроцитомой GrIII вследствие продолженного роста опухоли выполнена рекраниотомия с удалением продолженного роста опухоли. Учитывая продолженный рост было решено перейти ко второй ступени химиотерапии, усилить ее назначением Темодала по 250 мг/м2 с 1 по 5 дни, а Карбоплатин 300 мг вводился внутриартериально в 1 день курса.
Во 2-й подгруппе у 4 больных в течение 15 месяцев обнаружен продолженный рост опухоли, вследствие чего выполнена рекраниотомия с удалением опухолевого узла, а в плане химиотерапии было также решено перейти на следующую ступень – алкилирующий препарат второго поколения – Темодал из расчета 200 мг/м2. Курс был стандартный – с 1-го по 5 дни, с интервалом в 28 дней.
В 1-й подгруппе больных GrIV астроцитомой 13 больным после имплантации тромборезистентной внутриартериальной порт-системы «Селсайт» также проводилась внутриартериальная химиотерапия Карбоплатином в дозе 300 мг, введенным иньектоматом в течение 4 часов на аутоплазме больного. Из них в течение 9 месяцев наблюдения у 6 больных был выявлен продолженный рост опухоли с последующей повторной операцией, после чего переходили на вторую ступень химиотерапии — Темодал по 250 мг/м2 с 1 по 5 дни, а Карбоплатин по 300 мг продолжали вводить внутриартериально в 1 день курса.
Во 2-й подгруппе больных GrIV астроцитомой полихимиотерапия также начиналась со схемы Карбоплатин-150 мг, Винкристин-2 мг, peros Ломустин-200 мг.
При появлении на МРТ с контрастированием признаков отека вокруг ложа удаленной опухоли во всех подгруппах GrIII GrIV астроцитом осуществлялся переход на третью ступень химиотерапии — Иринотекан 200 мг/м2 в 1-й и 15-й дни курса плюс ондастерон 8 мг перед введением Иринотекана, Авастин 400 мг в/в капельно в 1-й и 15-й дни курса, повтор каждые 28 дней.
Сравниваемые группы были сопоставимы по возрасту, полу, гистотипу, стадии опухолевого процесса.
Результаты. За 28-месячный период наблюдения в 1-й подгруппе больных с астроцитомой GrIII живы 6 человек (из 15), во 2-й подгруппе — 5 человек. Из 1-й подгруппы больных астроцитомой GrIV 18 месяцев наблюдения не пережил никто. Во второй подгруппе больных астроцитомой GrIV 16 месяцев не пережил никто. В группах больных с астроцитомами GrI и GrII все больные живы -100% общая выживаемость. Однако, в группе GrI два человека были оперированы повторно по поводу продолженного роста, а в группе GrII — 5 человек.
На рис.1. представлены показатели бессобытийной выживаемости (оценка по Каплану-Майеру) для групп GrI и GrII. Под событием понимаем продолженный рост или смерть, которой в этих группах не было.
На рис.2. представлены показатели общей выживаемости (Каплан-Майер), а на рис.3 –бессобытийной, для групп GrIII и GrIV.
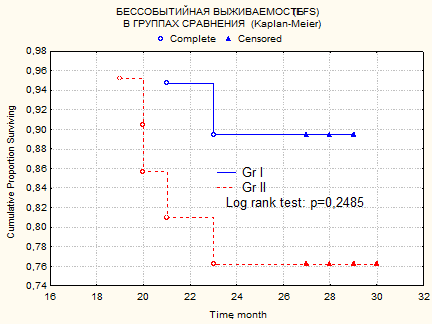
Рис.1. Показатели бессобытийной выживаемости для групп больных с астроцитомами GrI и GrII. Под событием понимаем продолженный рост опухоли. Различия статистически незначимы, р=0,2485. Медиана выживаемости в группах не достигнута. Двухлетняя бессобытийная выживаемость в группе с астроцитомой GrI – составляет 89%, в группе GrII – 76%. По оси абсцисс – время от начала лечения, месяцы.
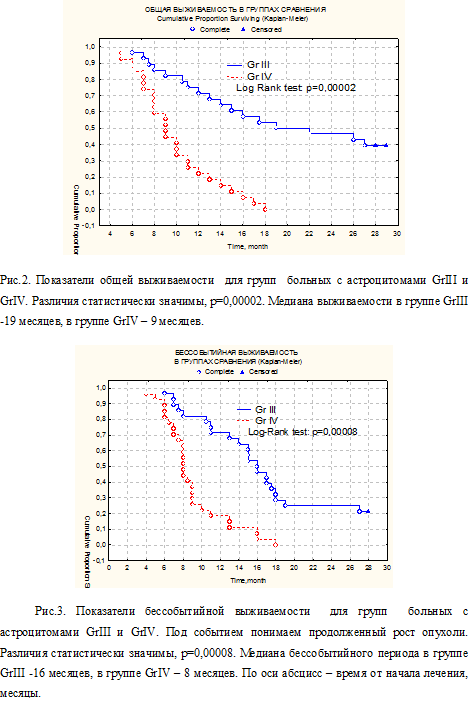

Статистический анализ выживаемости в группах и подгруппах сравнения показал достоверные различия в общей и бессобытийной выживаемости больных астроцитомой GrIII и GrIV. В подгруппе 1 больных как астроцитомой GrIII, так и GrIV, бессобытийный период достоверно больше, что свидетельствует об эффективности внутриартериальной химиотерапии.
Для выполнения гистологического исследования использовалась рутинная окраска гематоксилином-эозином. Иммуногистохимическое (ИГХ) исследование опухолей головного мозга было выполнено с использованием следующих моно- и поликлональных антител: bcl-6,p53, Ki-67, CD31, CD34, EGFR. Данная панель реактивов была подобрана для определения биологических свойств разных вариантов глиом.
Полученные результаты показателей иммуногистохимического профиля отражены в таблице 1.
Таблица 1. Иммуногистохимические показатели глиальных опухолей.
|
Астроцитомы |
||||
| Gr I | Gr II | Gr III | Gr IV | |
| Ki-67 | 1-2% | 3-5% | 5-9 % | более 15-20% |
| р53 | Отр. | 2-3% клеток | 25-30% | Отр. |
| EGFR | Отр. | Отр. | Отр. | Отр. |
| CD 31 | 1-3% | 2-4% клеток эндотелия | 10-15% | 45-50% |
| CD 34 | 1-3% | 2-4% сосудов | 10-15% | 45-50% |
| bcl-6 | 2-3% | 0 | 20% | 5-7% |
Иммуногистохимический профиль у больных астроцитомой GrI показал очень низкий уровень пролиферации Ki-67 и отрицательную реакцию на белок р53. CD31 и CD34 были единичными (1-3%). В ядрах отдельных клеток имелась очаговая экспрессия белка bcl-6, что свидетельствует о низкой транскрипционной активности опухолевых клеток (Рис. 6 а,б,в,г,д,е,ж,з).

У больных acтроцитомой GrII в иммуногистохимическом профиле выявлена очаговая экспрессия в клетках опухоли ядерного белка Ki-67 (3-5%), появление «островков» апоптоза (экспрессия белка p53), наряду с негативной реакцией с белком EGFR. Неоангиогенез был выражен неравномерно с одинаковой экспрессией CD31, CD34 (2-4%), что указывало на формирование новых эндотелиальных клеток и сосудов в опухоли. Реакция с bcl-6 отрицательная, что указывает на отсутсвие транскрипционной активности (рис. 7 а,б,в,г,д,е,ж,з).

На основании этих результатов было решено провести курс адъювантной дистанционной гамма-терапей (ДГТ) с последующими курсами монохимиотерапии ломустином.
Исследование иммуногистохимического профиля у больных астроцитомой GrIII показало повышение экспрессии белка Ki-67 (более 5-7%), увеличение до 20% bcl-6, что указывает на высокую транскрипционную активность клеток, свидетельствуя о её высоком ростовом потенциале. Показатель апоптоза — экспрессия белка p53 достигает 25-30%, увеличение плотности и экспрессии белков CD31, CD34, при отсутствии реакции с EGFR (рис. 8 а,б,в,г,д,е,ж,з).

У больных GrIV астроцитомой (глиобластомой) обнаружена высокая экспрессия белка Ki-67 (более 15-20%), отсутствие признаков апоптоза (экспрессии белка p53), единичная ядерная активность bcl-6, негативная реакция с EGFR, повышенная экспрессия в опухоли белков CD31, CD34 (усиленный неоангиогенез, неоэндотелиогенез) до 10-15% (рис. 9 а,б,в,г,д,е,ж,з). Поэтому было решено больным глиобластомой проводить ДГТ на фоне монохимиотерапии карбоплатином с целью повышения радиочувствительности опухоли к проводимому лучевому лечению.

Наблюдения в течение шестимесячного периода показали отсутствие продолженного роста опухоли, а также участков глиоза и отека в ложе удаленной опухоли.
Известно , что in vitro снижение способности сообщаться между собой через щелевые каналы у опухолевых клеток еще не определяет появление опухолевого роста. Восстановление межклеточной сообщаемости у коммуникационно дефектных линий опухолевых клеток путём устойчивой трансфекции в них генов щелевых контактов коннексинов в экспериментах показали, что межклеточная сообщаемость является сильным опухолеподавляющим фактором (Rose В. с соавт., 1991; Eghbali В, с соавт., 1991; ChenSh-Ch. с соавт., 1995).
Однако, при изучении глиом головного мозга в литературе отсутствуют сведения о роли различных типов коннексинов в динамике прогрессирования, рецидивирования, не установлены биологические потенции клеточного роста данных опухолей.
Среди семейства коннексинов, обнаруженных в ткани головного мозга следует отдельно выделить коннексин-43 (Cx43, CXA1_RAT), коннексин-36 — интегральные мембранные белки, образующие щелевые межклеточные контакты (gap-junction) между астроцитами, нейронами, участвующие в передаче межнейрональных импульсов и играющие важную роль в инвазии опухолевых клеток в паренхиму нормальной ткани мозга (Юсубалиева, Г.М., Зоркина Я.Л., Баклаушев В.П., Гурина О.И., Горяйнов С.А., Александрова Е.В., Жуков В.Ю., Савельева Т.А., Потапов А.А., Чехонин В.П., 2014 г.). Щелевые контакты играют Существуют экспериментальные данные, показывающие активирующее влияние Сх43 на процессы инвазии мультиформной глиобластомы человека и ее аналога у крыс — экспериментальной глиомы С6 (FuСТ, etal., 2004).
До настоящего времени в литературе отсутствуют сравнительные морфологические, иммуногистохимические характеристики разных типов коннексином, в том числе коннексина-36, коннексина-43 в астроцитомах разной степени злокачественности, глиобластомах при изучении операционного материала. Чехонин Владимир Павлович, Юсубалиева Гаухар Маратовна, Баклаушев Владимир Павлович, Гурина Ольга Ивановна получили Патент № 2457862 на «Способ лечения низкодифференцированных глиом», сутью которого является введение стандартизированного препарата анти-Сх43 антител, полученных к рекомбинантному фрагменту коннексина-43 Q173-1208 с аминокислотной последовательностью QWYIYGFSLSAVYTCKRDPCPHQVDCFLSRPTEKTI. Стандартизованный препарат анти-Сх43 антител, подготовленный для терапии низкодифференцированных глиом (5 мг препарата на 1 кг веса), под кетаминовым наркозом вводили в кровеносное русло 10-ти крысам на 5-е сутки после имплантации глиомы С6. Препарат анти-Сх43 антител вводится в количестве не менее 5 мг/кг веса реципиента один раз каждые 5-7 дней до достижения терапевтического эффекта (Заявка: 2011112433/15, 07.07.2011, дата начала отсчета срока действия патента: 07.07.2011; Дата подачи заявки: 07.07.2011) . Терапевтический эффект препарата анти-Сх43 антител оценили по увеличению продолжительности жизни крыс с глиомой С6 на фоне проводимой терапии в опытной по сравнению с крысами с глиомой С6 контрольных групп. Способ позволяет замедлить рост опухоли и увеличить продолжительность жизни пациента на фоне проводимой терапии низкодифференцированных глиом. О роли коннексина Сх36 в литературе информация не представлена.
В этой связи целью нашего исследования явилось проведение сравнительного морфоиммуногистохимического исследования астроцитом 1-3 степени злокачественности, глиобластом с определением в опухолях головного мозга коннексинов-36, 43, GFAP, Ki67, CD34.
Гистологическое исследование выполнялось по обычной методике с окраской гематоксилином-эозином, для иммуногистохимического исследования использовались антитела к коннексинам-36, 43, GFAP, Ki67, CD34. Астроцитомы 1-2 степени злокачественности характеризовались наличием фибриллярных астроцитов, строящих компактные пучки клеток вытянутой формы, имеющих клеточные структуры с крупными гиперхромными ядрами. Коннексины-36, 43 в данных астроцитомах были умеренно выражены, имели мембранную, очаговую цитоплазматическую экспрессию. Экспрессия белка GFAP в клетках и волокнистых структурах астроцитом данной категории была резко выраженной, в виде четко очерченных пучковых структур. Индекс пролиферативной активности (Ki67) в глиомах был невысокий и составлял не более 3-5%, отмечались единичные тонкостенные новообразованные сосуды (CD34).
В астроцитомах 3 степени злокачественности количество атипичных астроцитов резко возрастало, отмечались поля новообразованных тонкостенных сосудов, расположенные вокруг опухолевых солидных участков. Иммуногистохимическое исследование данной категории опухолей головного мозга выявило умеренно выраженную цитоплазматическую, мембранную реакцию клеток опухоли со стороны коннексина-36, в то же время негативную реакцию коннексина-43 в этих же участках. По сравнению с астроцитомами 1-2 степени злокачественности наблюдалось увеличение индекса пролиферативной активности клеток опухоли до 10-15% (Ki67), количество новообразованных сосудов в опухолевых участках возрастало (CD34). Экспрессия белка GFAP была неравномерно выраженной с преимущественной локализацией в цитоплазме, мембранах клеток глии.
В глиобластомах 4 степени злокачественности имелось компактное солидное скопление атипичных клеток глии, расположенные вокруг сосудов, с ландкартообразнымикоагуляционными некрозами ткани. Весьма характерным для данной группы опухолей был высокий митотический индекс Ki-67 (более 35-40% клеток), слабо выраженная экспрессия GFAP, полное отсутствие цитоплазматической, мембранной экспрессии коннексинов-36, 43. Отличительными признаками было большое количество новообразованных сосудов в ткани опухоли (CD34), что свидетельствовало о высоком неоангиогенезе в опухоли.
Таким образом, данные нашего сравнительного морфо-иммуногистохимического исследования позволяют сделать вывод о том, что по мере нарастания степени злокачественности в глиомах нарушаются взаимоотношения коннексинов-36, 43, вплоть до полного их отсутствия в глиобластомах. Мы считаем, что такая дезинтеграция коннексинов с преобладанием коннексина-36 в астроцитомах разной степени злокачественности может указывать на нарушение синхронизации передачи нервных импульсов в клетках опухоли. В то же время негативная реакция коннексинов в глиобластомах обоих типов может свидетельствовать о полном закрытии или повреждении щелевых контактов, что, несомненно, ведет к нарушению передачи нервных импульсов. При этом митотическая активность клеток опухоли и процессы неоангиогенеза в глиобластомах значительно превышают таковые показатели по сравнению с астроцитомами 3 степени злокачественности, а все вышеизложенное может объяснять различную чувствительность астроцитом к комплексному лечению, в частности — к химиотерапии.
Литература.
- Радулеску Г.Г. «Новые возможности улучшения результатов лечения пациентов с мультиформнойглиобластомой». «Онкология», №2, 2005 . С 57-60.
- В.Е. Олюшин, А.А. Петров, М.В. Филатов, А.Ю. Улитин, Ван Юньпэн, В.Ю. Чиркин «Результаты клинического применения методики индивидуального подбора цитотоксического препарата для химиотерапии при лечении злокачественных опухолей головного мозга».Вестник ТГУ, 2007, т. 12, вып.5, С. 599-601.
- Ван Юньпэн, В. Е. Олюшин, А.А. Скоромец, А.Ю. Улитин, А.А. Петров «Олигодендроглиальные опухоли: иммуногистохимические особенности и химиотерапия» Неврологический вестник, 2008, Т.XL, выпуск 1. С. 77-80.
- Ю.А. Зозуля, Т.А. Малышева «Актуальные аспекты морфологической диагностики опухолей центральной нервной системы». «Онкология» 2010,Т.12., №3, С.- 263-269.
- К.А. Колотов, О.В. Машковцев, Б.Н. Бейн «Иммуногистохимические особенности глиальных опухолей головного мозга», «Медициинский альманах» №4 (23), сентябрь 2012 г, С.66-69.
- Юсубалиева, Г.М., Зоркина Я.Л., Баклаушев В.П., Гурина О.И., Горяйнов С.А., Александрова Е.В., Жуков В.Ю., Савельева Т.А., Потапов А.А., Чехонин В.П. «Антитела к коннексину-43 в интраоперационной диангностике экспериментальных низкодифференцированных глиом», «Журнал вопросы нейрохирургии им. Н.Н. Бурденко, г. Москва». №3, Т. 78, С. 3-14.
- BradyTrexler, Weili, StephenL. Mills, andStephenC. Massey «CouplingFromAIIAmacrineCellstoONConeBipolarCellsIsBidirectional»- THEJOURNALOFCOMPARATIVENEUROLOGY 437:408-422 .2001
- Yamasaki H. (1990). Gap junctional intercellular communication and carcinogenesis.Carcinogenesis, 7, 1051-1058.
- Loewenstein W.R. and Kanno Y. (1966).Intercellular communication and the control of the tissue growth; lack of communication between cancer cells. Nature, 209, 1248-1249.
- Eghbali B., Kessler J.A., Reid L.M., Roy C. and SprayC. (1991). Involvement of gap junctions in tumorigenesis: Transfection of tumor cells with connexin 32 cDNA retards growth in vivo. Proc. Natl. Acad. Sci. USA, 88,701-10705.
- Chen Sh.-Ch., Pelletier D.B., Ao P. and Boynton A.L. (1995). Connexin43 reverses the phenotype of transformed cell and alters their expression of cyclin/cyclin-dependent kinases. Cell Growth & Differ., 6, 681-690.
- Fu C.T., Bechderger J.F., Ozog M. A.,Perbal B. Nauss C. C. (NOV) interact with connexin43 in c6 glioma cells. Possible mechanism of connexin-mediated growth suppression. J. Biol. Chem., Vol.279-35 -36943-36950, 2004.
- Патент № 2457862 на «Способ лечения низкодифференцированных глиом». Заявка: 2011112433/15, 07.07.2011. Дата начала отсчета срока действия патента: 07.2011. Приоритет(ы): Дата подачи заявки: 07.07.2011 (Авторы: Чехонин Владимир Павлович, Юсубалиева Гаухар Маратовна, Баклаушев Владимир Павлович, Гурина Ольга Ивановна)[schema type=»book» name=»СРАВНИТЕЛЬНАЯ ИММУНОГИСТОХИМИЧЕСКАЯ ХАРАКТЕРИСТИКА И ОСОБЕННОСТИ КОННЕКСИНОВ ГЛИАЛЬНЫХ ОПУХОЛЕЙ ГОЛОВНОГО МОЗГА ПРИ СТУПЕНЧАТОМ ПОДХОДЕ К ХИМИОТЕРАПИИ В ИХ КОМПЛЕКСНОМ ЛЕЧЕНИИ» description=» Проведено сравнительное морфологическое и иммуногистохимическое исследование доброкачественных и злокачественных глиальных опухолей головного мозга при использовании ступенчатого подхода к химиотерапии в их комплексном лечении. В исследование включены наблюдавшиеся с 2013 по 2015 год. 95 больных с астроцитомами: GrI – 19чел., GrII – 21чел., GrIII -28чел., GrIV(глиобластомы)- 27чел.. Иммуногистохимическое (ИГХ) исследование опухолей головного мозга было выполнено с использование следующих моно- и поликлональных антител: p53, Ki-67, CD31, CD34, EGFR, bcl-6. Показано наличие морфологических особенностей глиом, которые определяют выбор тактики их комплексного лечения, что является основой для прогноза лечения таких больных. В то же время по мере нарастания степени злокачественности в глиомах нарушаются взаимоотношения коннексинов Сх36, Сх43, вплоть до полного их отсутствия в глиобластомах. Такая дезинтеграция коннексинов с преобладанием коннексина-36 в астроцитомах разной степени злокачественности может указывать на нарушение синхронизации межклеточных взаимодействий,ухудшение передачи межнейрональных импульсов, а негативная реакция коннексинов в глиобластомах обоих типов может свидетельствовать о полном закрытии или повреждении щелевых контактов, что, несомненно, может определять чувствительность к химиотерапии и продолжительность жизни.» author=»И.В. Балязин-Парфенов, С.С. Тодоров» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-05-22″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_ 30.01.2015_01(10)» ebook=»yes» ]

