В последнее время много работ посвящено изучению токсического действия на растения наночастиц (НЧ) металлов [6, 7, 16]. Эта тема стала актуальной в связи с феноменом активации окислительного стресса в растении [4, 6, 18], повреждения фотосинтетических пигментов [6, 16], повреждения молекулы ДНК [18]. Известно, что именно фенольные соединения способны окисляться до менее реакционноспособных феноксильных радикалов -PhO• и обрывать цепные реакции окисления, тем самым предотвращать окислительный стресс [8]. В совокупности это подтверждает перспективность выяснения роли НЧ в модификации химической структуры фенольных соединений с использованием метода инфракрасной (ИК) спектроскопии, позволяющим получить представление о конформационном состоянии данных соединений и проанализировать токсическое действие НЧ металлов на растительные метаболиты [1].
В экспериментальном исследовании использовали сферические НЧ Cu0 размером 84±5нм, полученные левитационно-струйным методом Гена-Миллера, на поверхности которых имелась пышная оксидная пленка CuО (16,4% от общей массы частицы) [16]. При исследовании использовали дезинфицированные в течение 5 мин 0,01%-ным раствором KMnO4 проросшие семена Triticum vulgare. После этого их, промывали дистиллированной водой и проращивали в течение 24 часов. На 2-е сутки образцы раскладывали по 30 штук на фильтровальную бумагу и поливали опытными растворами — 15 мл раствора 0,5 г/л НЧ меди Cu0, которые интенсивно диспергировали в течение 15 мин ультразвуком с частотой 35 кГц («Сапфир ТТЦ», Россия). В контрольную пробу наливали 10 мл дистиллированной воды. Полученные образцы проращивали при 22°С на свету, не допуская подсыхания. На 3 сутки прорастания семена многократно промывали дистиллированной водой для удаления избытка НЧ с поверхности и отбирались для получения экстракта. Для этого точные навески семян массой 1,0 г тщательно растирали в фарфоровой ступке [1] и, собрав на дне, растирали с 50 мл 95%-ного этилового спирта («Гиппократ», Россия) до однородной массы. Затем 15 мл полученной взвеси центрифугировали при 3000 об/мин в течение 5 мин. Далее супернатант выпаривали на водяной бане, добавляли 10 мл хлороформа и полученную суспензию диспергировали ультразвуком в течение 5 мин. Для снятия ИК-спектров брали 100 мкл анализируемого раствора и наносили микропипеткой в виде пленки между двумя слоями солевых пластинок из. Затем проводили регистрацию ИК-спектра суммарного извлечения образцов на сканирующем инфракрасном Фурье-спектрометре марки «ИнфраЛЮМ ФТ-02» (НПФ «Люмэкс», Россия) в жидкостной кювете из NaCl толщиной 0,1 мм в области поглощения 4000-400 см-1 с разрешением 1 см-1. Предварительно записывали спектр чистого растворителя – хлороформа CНCl3 (Sigma-Aldrich, USA). Анализ данных проводили в программе «Спектралюм» (версия 1,02) и EZ «OMNIC» (USA).
Попытка детальной расшифровки ИК-спектров экстракта пшеницы показала, что выбрать характерный участок спектра (4000-400 см-1) не представляется возможным вследствие разнообразного состава, усложненности спектров растительных экстрактов. Поэтому для косвенной оценки модификаций молекул фенольной фракции пшеницы под воздействием НЧ, был выбран метод отнесения отдельных максимумов ИК-спектров экстрактов контрольных растений, а также их частотные сдвиги и сравнение интенсивности характеристических частот со спектром опытных вариантов при тех же условиях.
Известно, что растительные экстракты, вследствие разнообразного состава, могут давать усложненные ИК-спектры за счет наложения целого ряда полос поглощения, особенно в сочетании с наночастицами. Так, спектр контрольных растений, представленный на рисунке 1, характеризуется несколькими пиками поглощения.
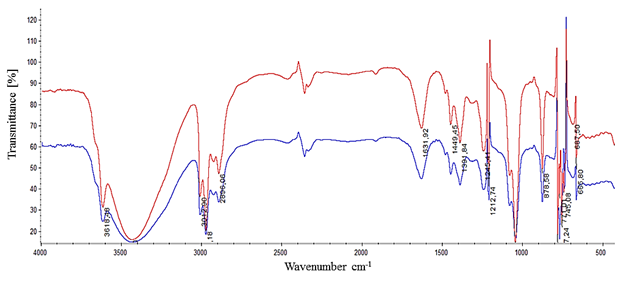
Рисунок 1. ИК-спектры жидких этанольных экстрактов из трехдневных семян пшеницы. Растворитель — хлороформ. Кювета NaCl
В высокочастотной области валентных колебаний (ν) простых связей O-H и C-H (4000-2500 см-1) интерпретируемого спектра первая полоса средней интенсивности при 3618,55 см-1 дает не участвующие в образовании межмолекулярной водородной связи («свободные») фенольные гидроксильные группы (3650-3590 см-1) [9]. Наряду с этим, появление широкой интенсивной полосы поглощения 3425,4 см-1 в области более низких частот (при 3500-3200 см-1) обусловлена наличием либо участием гидроксильной группы в образовании межмолекулярных водородных связей ди- и/или полимеров [9], либо кристализационной воды [1], что проявляется в смещении полосы поглощения свободных гидроксильных групп в сторону меньших частот и значительном увеличении ее интенсивности [1, 5, 10].
Далее перемещаясь слева направо по спектру – из высокочастотной в низкочастотную область, и детализируя наличие функциональных групп в области от 3300 до 2800 см-1, обнаруживаем сложную полосу поглощения в виде основного пика 2976 см-1 с плечами при 2927 и 2896 см-1, которое обусловлено валентными колебаниями алифатических СН3— и СН2-групп [5, 9], а также метоксильной группы –О-СН3 (2920-2850 см-1). Указанным валентным колебаниям алифатических С-Н групп соответствуют деформационные колебания в области 1477, 1392 см-1 и 740 см-1 [5, 9]. Наличие в спектре плеча при 3012,7 см-1 определяет валентные колебания С-Н связей ароматического цикла (3040-3010 см-1) и других связей С-Н с sp-гибридизацией (3320–3310 см-1) [9]. Этим колебаниям соответствуют внеплоскостные деформационные колебания ароматических arС-Н связей в области ниже 900 см-1 [1, 5] и ароматических О-Н связей при 666 и 420 см-1 [10]. Для самого бензольного кольца деформационному колебанию соответствует полоса при 688 см-1 и обертон указанных колебаний при 1920 см-1 (по справочным данным – область 2000-1600 см-1) [5]. Следует отметить, что интенсивность обертонов для веществ в конденсированном состоянии обычно ниже, чем основных до 100 раз [10]. Рассматривая подробно отнесение полос поглощения к связи С-Н можно отметить, что антисимметричному (as) валентному колебанию связей С- в группе νasСН3 (область 2930-2920 см-1) или в группе νas CH2 (область 2936-2916 см-1) соответствует полоса при 2927 см-1 [5, 10]. Отметим, что M.S. Ram и коллеги данную полосу относят к наличию в зерне пшеницы насыщенных кислот и крахмала [19]. В целом, пики поглощения выше 3000 см–1 обусловлены атомами водорода при sp2-гибридизованном атоме углерода [5]. Появление полосы при 2896 см-1 – результат симметричного валентного колебания νs CH3. Некоторые авторы относят полосы поглощения около 2976, 2896 и 1632 см-1 к колебаниям νСН2, νsCH2 и νC=О у липидов и триглицеридов [15].
В области валентных колебаний тройных связей C≡C («области прозрачности») (2700-1850 см–1) обнаруживается сложное поглощение слабой интенсивности — три полосы: две слабой интенсивности при 2467 и 2360 см-1, и одна сильной — при 2336 см-1 [3, 9]. Следует отметить, нехарактерное для фенольных соединений сложное поглощения в этой области в сочетании со слабым обертоном в зоне от 2000 до 1700 см-1 [10]. Доказательством наличия карбоновых кислот служит наличие полосы с максимумом ~2800 см-1, относящейся к колебаниям υCOO-H карбонильных групп и интенсивной полосы в химическом окружении 1720-1540 см-1, относящейся к валентному колебанию ионизированной карбонильной группы υС=О в фенолкарбоновых кислотах и сложно-эфирной группировки [9]. Появление в ИК-спектрах сильных полос валентных колебаний группы С=О также говорит об образовании альдегидов и кетонов, которая сопряжена со связью С=С ароматической систем. В целом, широкое несимметричное поглощение ниже 2000 см-1 подтверждает наличие органических кислот [10].
В области колебаний двойных связей (1950-1430 см–1) обнаружены четкие полосы поглощения переменной интенсивности при 1632, 1489 и 1450 см-1, отнесения которых являются скелетными валентными колебаниями С=С цикла, в т.ч. в ароматических соединениях (1690-1400 см-1) [9, 10]. Последним сопутствуют пики деформационных колебаний атомов водорода при двойной связи С=С около 1000 и 900 см–1 и самого углеродного скелета (1500-900 см-1). В области 1690-1520 см–1 вероятно наложение поглощения с валентными колебаниями связи С=N [9], с ножничными и маятниковыми деформационными колебаниями N-H или N=O нитратов (диапазон 1690-1630 см-1) [10]. Из анализа данных по частотным характеристикам следует, что в спектрах всех исследуемых экстрактов присутствуют полосы поглощения в области 3000 см-1, 1600-1500 см-1, характерные для колебаний ароматических структур. Причем в экстрактах присутствуют ароматические соединения, сопряженные с ненасыщенными двойными связями (типа сопряженных диенов), на что указывает дополнительная слабая полоса 1500 см-1 в сопровождении полосы 1632 см-1. Появление последней в совокупности с частотами 1489, 1450, 1091 и 1047 см–1 подтверждает наличие ароматических соединений с малой степенью замещения (диапазон 1650-1450 см-1 [9] и 1200-1000 см–1 [10]).
В области «отпечатков пальцев» («finger prints», области валентных и деформационных колебаний простых связей X–Н) — 1500-500 см-1, кроме отдельных типов молекул, наблюдается ряд полезных групповых частот. Среди колебаний этих групп частот наблюдаем ножничные и ассиметричные деформационные колебания метиленовых групп СН3, трудноотличимых от колебаний метильных СН2 (1475-1450 см-1). При 1392 см-1 находятся полосы, не имеющие практического значения и отвечающие плоскостным деформационным колебаниям связи фенольной группы О-Н (по справочным данным: 1450-1000 см-1) [5]. При этом, в области 1200-1180 см-1 наблюдаются деформационные колебаниям свободных фенольных групп -ОН, а полосы при 1047 см-1 указывают на присутствие гетероциклов с кислородным гетероатомом [10].
Отметим, что наличие полос средней интенсивности в диапазоне от 1370 до 1000 см-1 (1324, 1245, 1212, 1091 и 1046 см-1) в совокупности с поглощением в области 1700 см-1 в карбонильной области говорит о присутствии кетогрупп [10] и кето-эфирных соединений в экстракте [9], которые могут накладываться на область с крутильными и веерными деформационными колебаниями ароматической группы arС-Н (1275-950) [10] и arС-ОН (1275-1150 см-1) [9]. Наличие интенсивных полос в области спектра 1287-1273, 1124 и 1046 см-1, характеризует валентные колебания С-О- и С-О-С-связей. Отметим, что частота 1245 см-1 характеризуют валентные колебания связи С-О, обусловленные участием этой группы в скелетных колебаниях (по справочным данным: 1260-970 см-1 [9]). Возможно наложение указанных полос на ассиметричные валентные колебания полярной связи простых эфиров –СН2-О-СН2— (область 1310-1000 см-1), С-О-С в метоксильных группах (1290-1280 см-1), вторичных спиртовых групп СН2-ОН и СН-ОН (область 1075-1000 и 1125-1000 см-1, соответственно), а также их гликозидов [9]. Подтверждением наличия в анализируемых смесях сложно-эфирных группировок служит появление попеременно интенсивных полос ассиметричных колебаний С-О-С в области от 1245 до 1212 см-1 и симметричных колебаний от 1089 до 1046 см-1. Кроме того, слабое поглощение при 1091 и 1047 см–1 указывает на характеристические внеплоскостные деформационные колебания метильной группы γCH3 (крутильные и веерные) с перекрытием плоскостными деформационными колебаниями δС-Н связи (ножничными и маятниковыми) (область 1225-950 см-1 [11]). Последним также сопутствуют наложение полос колебания молекул в группе С=СН2 при 878 и 770 см–1 (диапазон 900-650 см–1 [9]) и маятниковых колебаний отдельных CH2 групп при 770, 756 и 739 см-1 (772-730 см-1) [10].
Итак, этанольный экстракт трехдневных семян пшеницы представлен широким кругом функциональных групп и образуемых ими соединений – углеводородами (1650-1580 см-1), насыщенными кислотами (2927 см-1) и белками (химическое окружение в области 1500 см-1) [14]. Наряду с этим, сильное поглощение в области от 1212 до 800 см-1 отнесено к валентным колебаниям C-O-группы углеводов, в более 80% присутствующих в эндосперме пшеницы. Так, регистрировалась полоса поглощения целлюлозы (1091 и 1046 см-1) [14] и крахмала (2927 см-1), в т.ч. его β-конфигурация (~890 см-1) [17]. Несмотря на это, большая часть функциональных групп детектируемого спектра относится к конденсированным фенольным соединениям и фенолокислотам в сочетании с ненасыщенными группировками [9]. Многие полосы поглощения, представленные нами, соответствуют пикам фенольной фракции экстракта семян пшеницы, полученной другими спектроскопистами: алкилрезорцинолов (1489, 1452 и 1441 см-1), лигнина, феруловой (1632 см-1), кумаровой (1630, 1449 и ~1214 см-1), синапиновой (1629 и 1392 см-1) и сирингиновой (1446 см-1) кислот, флавоноидов группы катехина (1321, 1247 и 759 см-1) и кверцетина (1440 и 1321см-1) [Ram et al., 2003], а также их производных [14].
Сравнение дифференциальных ИК спектров выделенных веществ из опытных образцов, подвергнутых воздействию НЧ, со спектром контрольных растений позволяет выделить такие общие структурные элементы, как ароматические кольца с различной степенью замещения (1000-800 см-1), вторичные спиртовые гидроксилы (1200-1050 см-1), фенольные гидроксилы (1400 см-1), карбонильные группы в виде кето- и карбоксильных групп (1800-1650 см-1), а также ассоциированные водородными связями гидроксилы (3500-3200 см-1) (Рис. 1). Модификация структуры молекул экстрактивных веществ пшеницы под воздействием НЧ может быть сопоставима с последними исследованиями C.M. Rico и J.R. Peralta-Videa (2015), которые отмечали композиционные изменения в виде смещения характеристических полос вытяжек из ксилемы корня пшеницы при экспозиции НЧ CeO2 [20].
Таким образом, результаты проведенных исследований свидетельствуют о том, что модификация структуры молекул экстрактивных веществ пшеницы под воздействием НЧ заключается в композиционных изменениях в виде смещения характеристических полос вытяжек из семян пшеницы. Вероятно, увеличение ассоциированных гидроксильных групп делает вероятным наличие пространственно затрудненных заместителей – бисфенольных структур, наличие которых уже служит показателем окислительного повреждения молекул под воздействием НЧ [12, 13]. Необходимо учесть, что изменения интенсивности максимумов характеристических полос поглощения может быть связано с разными концентрациями компонентов вследствие трудности полного гидролиза фенольных полимеров экстракта или вследствие их окисления свободными радикалами [2].
Работа выполнена в рамках Государственных работ в сфере научной деятельности базовой части государственного задания Министерства образования и науки Российской Федерации (проект №342 от 01.04.14 г.).
Список литературы
- Артюхова О.В., Лапина Г.П., Хижняк С.Д., Белоцерковец Н.И. ИК-спектроскопическое исследование экстрактов фенольных соединений проростков льна // Вестник ТвГУ. Сер. Биология и экология. — Вып. 7. — С. 61-62.
- Афанасьев Н.Б., Березина Н.А. Введение в экологию растений: учебное пособие / Н.Б. Афанасьев, Н.А. Березина. – М.: Изд-во Московского университета. – 2011. – 800с.
- Васильев А.В., Гриненко Е.В., Щукин А.О., Федулина Т.Г. Инфракрасная спектроскопия органических и природных соединений: Учебное пособие. СПб.: СПбГЛТА. – 2007. — 54 с.
- Егорова Е.М., Кубатиев А.А., Швец В.И. Биологические эффекты наночастиц металлов / Е.М. Егорова, А.А. Кубатиев, В.И. Швец. – М.: Наука, 2014. – 350с.
- Казицына Л.Α., Куплетская Н.Б. Применение УФ-, ИК-, ЯМР- и масс-спектроскопии в органической химии. М.: Изд-во Моск. ун-та, 1979. -240с.
- Короткова А.М. Влияние нано- и ионных форм меди на пигментный состав пшеницы обыкновенной. Химия растительного сырья. — 2014. — №3. — С. 133-138.
- Короткова А.М., Лебедев С.В. Эффекты наночастиц меди на изменение антиоксидантного статуса Triticum vulgare Vill // Микроэлементы в медицине, ветеринарии, питании: перспективы сотрудничества и развития – сб.тез.межд.НПК 24-26 сентября 2014 г. Одесса, 2014. С. 130-136.
- Полесская О.Г. Растительная клетка и активные формы кислорода / О.Г. Полесская; Под ред. И.П. Ермакова. – М.: КДУ, 2007. — 140 с.
- Преч Э. Определение строения органических соединений. Таблицы спектральных данных / Э. Преч, Ф. Бюльманн, К. Аффольтер. — М.: Мир; БИНОМ. Лаборатория знаний, 2012. — 438с.
- Смит А.Л. Прикладная ИК-спектроскопия. — М.: Мир, 1982. — 328с.
- Тарасевич Б.Н. ИК спектры основных классов органических соединений. — М.: МГУ, 2002. — 54 с.
- Фомин В.М. Радикально-цепное окисление органических соединений и его торможение ингибиторами фенольного типа. — Нижний Новгород: Нижегородский госуниверситет. — 2010. — 37с.
- Часов А.В., Минибаева Ф.В. Методические подходы к исследованию редокс-активности апопласта. Регуляция активности пероксидаз // Физиология растений. – 2014. – Т. 61. — №5. – С. 668-675.
- Amir R.M., Anjum F.M., Khan M.R., Imran M. application of fourier Transform Infrared (FTIR) Spectroscopy in foods // Internet J. Food Safety. – 2011. — Vol.13. — Р. 310-314.
- Burisova A.A., Tomaskova A.B., Sasinkova B.V., Ebringerova B.A. Isolation and characterization of the non-starch polysaccharides of amaranth seeds // Chem. Pap. – 2001. — №55(4). – Р. 254-260.
- Lebedev S.V., Korotkova A.M., Osipova E.A. Influence of Fe0 nanoparticles, magnetite Fe3O4 nanoparticles, and iron (II) sulfate (FeSO4) solutions on the content of photosynthetic pigments in Triticum vulgare // J.Plant Phys. — 2014. — Vol. 61. — №4. — РР. 564–569.
- Mikkelsen M.S., Jespersen B.M., Mоller B.L., Lærke H. N., Larsen F.H., Engelsen S.B. Comparative spectroscopic and rheological studies on crude and purified soluble barley and oat β-glucan preparations // Food Res.Intern. – 2010. — №43. – Р. 2417–2424.
- Mohammadi R., Maali-Amiri R., Mantri N.L. Effect of TiO2 nanoparticles on oxidative damage and antioxidant defense systems in chickpea seedlings during cold stress / Физиология растений. – 2014. – Т. 61. — №6. – С. 816-823.
- Ram M.S., Dowell F.E., Seitz L.M. FT-raman spectra of unsoaked and NaOH-soaked Wheat kernels, bran, and ferulic acid // Cereal Chemistry. – 2003. Vol. 80. — №2. – 188-192.
- Rico C.M.,Peralta-Videa J.R., Gardea-Torresdey J.L. Differential effects of cerium oxide nanoparticles on rice, wheat, and barley roots: a Fourier Transform Infrared (FT-IR) Microspectroscopy study // Spectrosc. – 2015. — №69(2). – Р. 287-295.
- Wang Y., Pei Z., Shan X., Chen G., Zhang J., Xie Y., Zheng L. Effects of metal cations on sorption-desorption of p-nitrophenol onto wheat ash // J.Envir.Sc. – 2011. — №23(1). – Р. 112–118.[schema type=»book» name=»ИК-СПЕКТРОСКОПИЯ В ИССЛЕДОВАНИИ МОДИФИКАЦИИ МОЛЕКУЛ В ЭКСТРАКТАХ ПШЕНИЦЫ ПОД ВОЗДЕЙСТВИЕМ НАНОЧАСТИЦ МЕТАЛЛОВ » author=»Короткова Анастасия Михайловна, Лебедев Святослав Валерьевич» publisher=»БАСАРАНОВИЧ ЕКАТЕРИНА» pubdate=»2017-05-05″ edition=»ЕВРАЗИЙСКИЙ СОЮЗ УЧЕНЫХ_ 28.02.2015_02(11)» ebook=»yes» ]

